小麥應對Cu2+脅迫的生理響應及ASA-GSH合成酶基因表達
鄭永興, 李鴿子, 康國章
(河南農業大學農學院, 國家小麥工程技術研究中心, 省部共建小麥玉米作物學國家重點實驗室, 鄭州 450046)
銅(Cu2+)是植物生長發育必需的微量元素之一,它參與植物的光合作用和一些必需的氧化還原反應,對植物的生長發育至關重要。然而過量的Cu2+損害植物細胞產生活性氧(reactive oxygen species,ROS),進而導致膜脂過氧化,使其體內的生理代謝紊亂,嚴重阻礙植物的生長發育[1-3]。近年來的研究表明,Cu2+作為重要的污染元素之一,影響農作物的正常生長和代謝,已對人類健康造成了較為嚴重的危害[4-5]。薛盈文等[6]研究表明,低濃度Cu2+促進小麥種子萌發,而高濃度Cu2+則抑制小麥種子發芽,且小麥生長發育隨著Cu2+濃度的增高而受阻,說明高濃度Cu2+嚴重影響了小麥種子萌發和生長發育。張剛等[7]對黑麥草進行不同濃度Cu2+脅迫處理發現,高濃度和長時間Cu2+脅迫降低黑麥草的發芽率、抑制根系生長和葉片葉綠素含量的增加。植物在長期的自然進化過程中已形成了一系列較為完善的自我防御機制,主要包括酶促反應和非酶促反應[8],其中超氧化物歧化酶(superoxide dismutase,SOD)、過氧化物酶(peroxidase,POD)、過氧化氫酶(catalase,CAT)等參與酶促反應,抗壞血酸(ascorbate,ASA)和谷胱甘肽(glutathione,GSH)等參與非酶促反應。其中,ASA-GSH循環是植物應對脅迫反應中不可或缺的非酶促反應,主要通過還原型的抗氧化物ASA和GSH、抗壞血酸過氧化物酶(ascorbate peroxidase, APX)、單脫水抗壞血酸還原酶(monodehydroascorbate reductase, MDHAR)、抗壞血酸還原酶(dehydroascorbate reductase, DHAR)和谷胱甘肽合成酶(glutathione reductase, GR)等多個酶促反應共同作用從而實現H2O2清除及ASA和GSH再生的過程,最終實現ASA-GSH循環反應來維持細胞氧化還原穩態,進而提高植物在逆境脅迫條件下的抗逆性[8-10]。Zeng等[11]研究發現,水稻汞耐性相關突變體植株中ASA-GSH循環比野生型植株能更有效地清除脅迫條件下產生的活性氧,說明ASA-GSH循環在水稻應對Hg2+脅迫過程中發揮了重要的作用,但具體的作用機制研究還未見報道。
目前,植物銅脅迫的研究多集中在其應對脅迫耐性的酶促和非酶促反應等生理作用機制方面,不能明確具體的相關作用機理[12-14]。因此,本研究利用不同濃度的Cu2+處理小麥幼苗,測定了脅迫條件下的生長參數、受傷害程度、及非酶促反應相關參數ASA和GSH等生理指標,并在此基礎上,檢測了ASA-GSH循環中 4個關鍵酶基因APX、DHAR、GR和MDHAR在轉錄水平上的表達差異,同時在生理和轉錄水平上探究了銅脅迫對小麥的傷害機理,為后續小麥銅污染相關的防御治理和小麥等糧食作物的生態環境評價提供了一定的理論依據。
1 材料與方法
1.1 試驗材料
供試材料為現今在黃淮海麥區大面積種植的小麥品種‘百農207’,種子由河南科技學院歐行奇教授和朱啟迪博士提供。
1.2 試驗方法
1.2.1試驗設計 種子經0.01% HgCl2消毒處理后,用蒸餾水清洗3次。在培養皿中用清水浸泡種子,直至種子萌動,挑選大小一致的萌動種子約60顆分別放于直徑為15 cm的培養皿中,將其置于LED光照培養箱(寧波揚輝儀器有限公司)進行培養,晝/夜培養條件16/8 h、24/18 ℃,光照10 000 lx,參照Li等[15]和Kang等[16]的研究方法,每隔1 d換一次1/2 Hoagland’s營養液。將小麥幼苗培養至三葉期,對小麥幼苗進行不同濃度CuSO4·5H2O處理,共設置0、0.05、0.10、0.50、1.00 mmol·L-1Cu2+5個處理,處理液為不同濃度Cu2++ 1/2 Hoagland’s營養液,處理10 d后,每個處理單獨采樣,測定相關生理指標。
1.2.2生長參數及生理指標測定 在脅迫處理的第10 d, 每個處理隨機挑選3~5棵小麥幼苗,測定其株高、根長、總鮮重、總干重等生長參數。分別取小麥幼苗的葉片及根各0.2 g,每個處理重復3次,利用組織研磨儀(SCIENTZ-48, 寧波新芝生物科技股份有限公司)研磨后分別加入2 mL 10% 三氯乙酸(TCA),混勻后再分別加入4 mL 10% TCA, 4 ℃、4 537 r·min-1離心10 min, 轉移上清液到新的離心管中,用于丙二醛(malondialdehyde,MDA)、抗壞血酸(ascorbate, ASA)、谷胱甘肽(glutathione, GSH)含量的測定。丙二醛含量采用硫代巴比妥酸法[15-16];抗壞血酸含量的測定,參考Kampfenkel等[17]方法;谷胱甘肽含量的測定參考Simth[18]方法;H2O2含量的測定參考Shan等[19]方法。
1.2.3基因表達量的測定 利用Trizol法提取小麥葉片和根系RNA,用TAKARA熒光定量反轉錄試劑盒合成dsDNA,于-20 ℃保存;進而采用熒光定量PCR(quantitative real-time PCR, qPCR)測定基因的表達量[20]。由于普通小麥為異源六倍體(AABBDD),每個基因至少存在3個以上的拷貝,且3個拷貝之間cDNA序列的同源性在95%以上[21]。基于此,本研究根據已知的基因序列,在小麥IWGSC數據庫同源搜索到相對應的染色體信息,在Ohdan等[22]研究基礎上,利用Primer 5.0軟件設計ASA-GSH合成途徑的4個合成酶基因的引物(表1)。引物合成由河南尚亞生物技術有限公司完成。qPCR反應程序參考Li等[23]和Livak等[24]方法進行,以Actin為內參基因,每個處理重復3次,以2-ΔΔCT方法檢測相關基因的表達量。
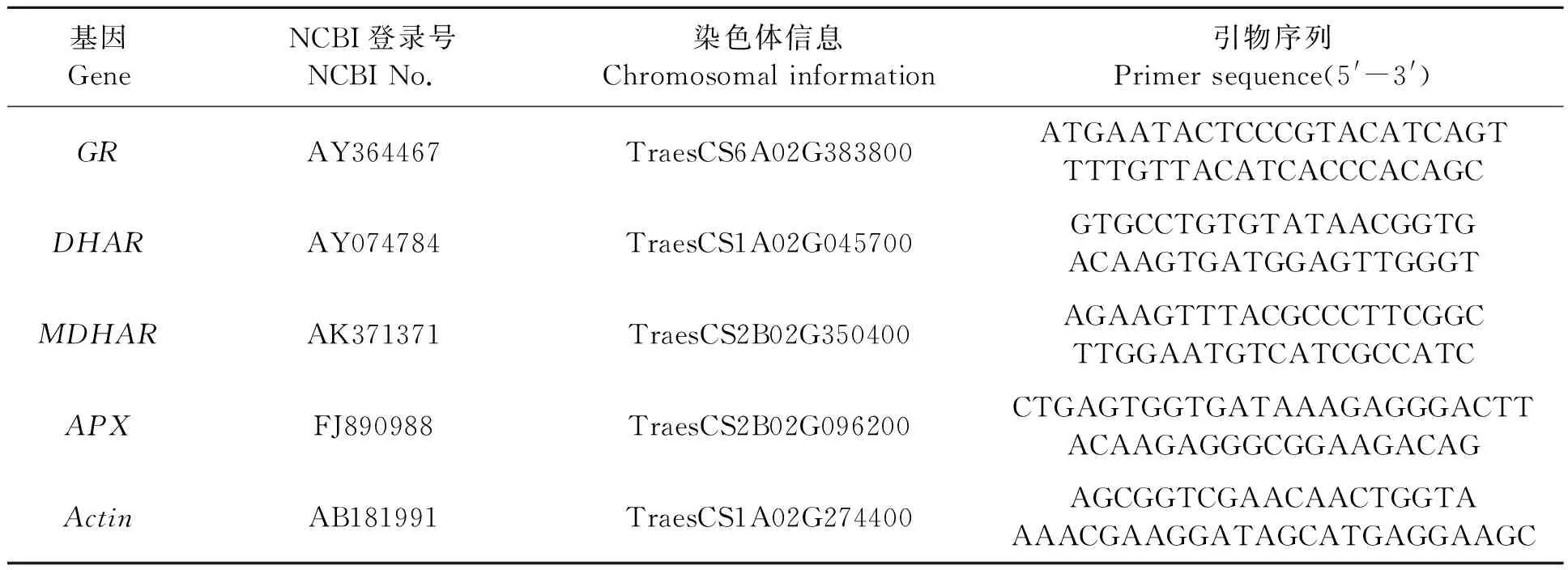
表1 qPCR引物Table 1 Primers for qPCR
1.3 數據處理
利用SPSS Statistics 19.0軟件(IBM)進行方差分析,并利用Origin 9.0進行制圖。
2 結果與分析
2.1 不同濃度Cu2+處理對小麥生長的影響
不同濃度Cu2+溶液處理三葉期的小麥幼苗10 d后,小麥植株的生長發育受到限制,葉片出現下垂、發黃、卷曲等癥狀(圖1)。生長參數測定結果(表2)表明,與對照相比,0.05、0.10、0.50、1.00 mmol·L-1Cu2+處理的小麥植株的株高分別下降13.90%、12.36%、27.32%、33.01%;根長分別下降21.20%、20.61%、32.60%、41.47%;植株總鮮重分別顯著降低了6.19%、21.41%、44.39%、59.53%;植株總干重與對照相比也顯著降低,分別降低了15.11%、15.11%、19.76%、40.31%, 其中,0.05、0.10、0.50 mmol·L-1Cu2+處理間總干重差異不顯著。同時,小麥長勢觀察顯示,小麥植株受傷害的程度隨著Cu2+濃度的增高而不斷增加,其中,0.50和1.00 mmol·L-1兩個濃度處理的小麥植株出現了葉片下垂、失綠甚至枯萎現象(圖1,表2)。說明小麥植株在防御逆境脅迫條件下其自身的抗氧化系統被激發,影響了植株體內水分的分配和利用,進而阻礙了其自身正常的生長發育。
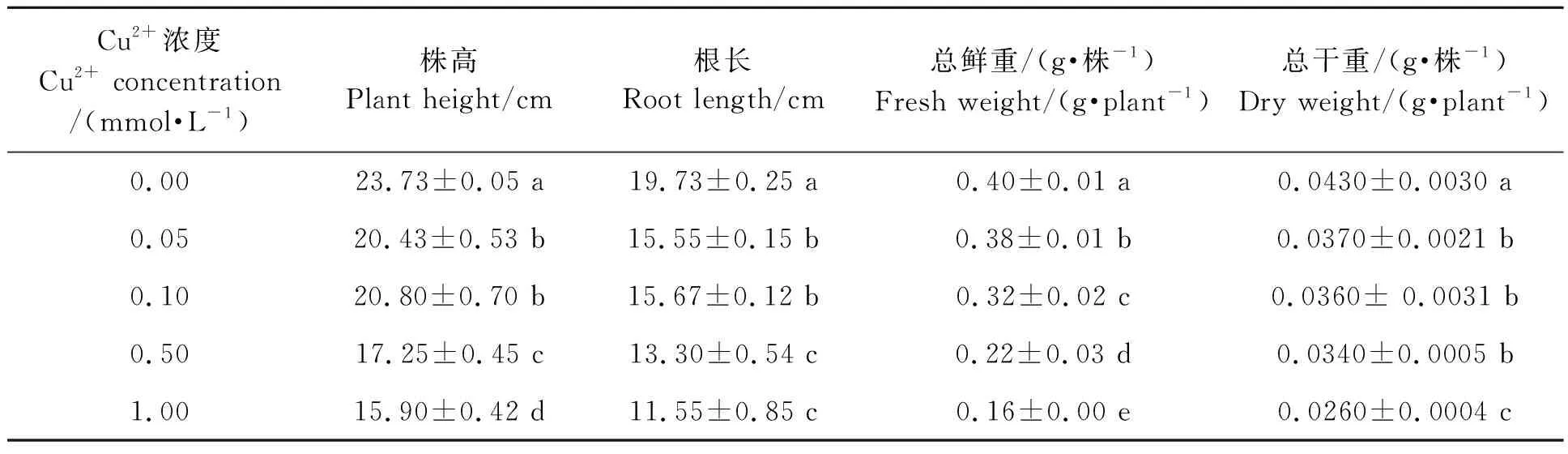
表2 不同濃度Cu2+處理的小麥幼苗生物量Table 2 Biomass of wheat seedlings treated with different Cu2+concentrations
2.2 不同濃度Cu2+處理對MDA和H2O2含量的影響
植物在應對脅迫反應過程中,其體內的膜脂過氧化物MDA和活性氧(如H2O2)不斷增加。小麥葉片和根系的MDA和H2O2含量結果(圖2)顯示,隨著Cu2+濃度的升高,葉片和根系的MDA和H2O2含量均呈現不斷增加的趨勢。不同處理間的葉片和根系的MDA含量均存在顯著性差異,且高濃度(1.00 mmol·L-1)Cu2+處理的小麥植株的葉片和根系中MDA含量達到最大值,其含量分別是對照植株的7.56和19.15倍;0.10、0.50和1.00 mmol·L-1Cu2+處理的小麥植株葉片和根系的H2O2含量與對照也均存在顯著差異,其在葉片中的含量分別是對照處理的1.31、1.50和1.80倍,在根系中的含量分別是對照的1.17、1.36和1.72倍。3個處理間葉片和根系的H2O2含量也均存在顯著差異。由此說明,Cu2+脅迫誘導小麥植株體內H2O2含量增加,從而引起其細胞膜的膜脂過氧化,破壞植株的正常生長發育。
2.3 不同濃度Cu2+處理對ASA和GSH含量的影響
脅迫條件下,植物體內抗氧化系統的重要成員ASA和GSH增加,能有效清除其體內活性氧的積累,來維護植物細胞免受脅迫所引發的氧化損傷。由表3可知,葉片中ASA含量在0.05 mmol·L-1處理條件下達到最高值,其含量比對照處理提高13.11%;0.10和1.00 mmol·L-1處理分別比對照顯著增加5.54%和6.70%,而0.50 mmol·L-1處理則顯著減少22.59%;在根系中,0.50 mmol·L-1Cu2+處理的ASA含量最高,是對照處理的10.33倍,0.05和1.00 mmol·L-1處理分別比對照顯著增加25.19%和286.63%,0.10 mmol·L-1處理比對照顯著降低69.77%。在0.05 mmol·L-1Cu2+處理條件下葉片中GSH 含量比對照顯著降低32.28%,而根系中GSH 含量則與對照處理無顯著差異;0.10、0.50和1.00 mmol·L-1Cu2+處理的葉片GSH含量顯著高于對照處理32.54%、40.06% 和129.11%,0.50和1.00 mmol·L-1Cu2+處理的根系GSH含量顯著高于對照201.86%和368.18%。表明不同濃度 Cu2+處理條件下,小麥植株可通過體內ASA和GSH含量的差異變化來維持和適應逆境脅迫所引發的體內抗氧化平衡系統,進而參與小麥應對Cu2+脅迫的響應。
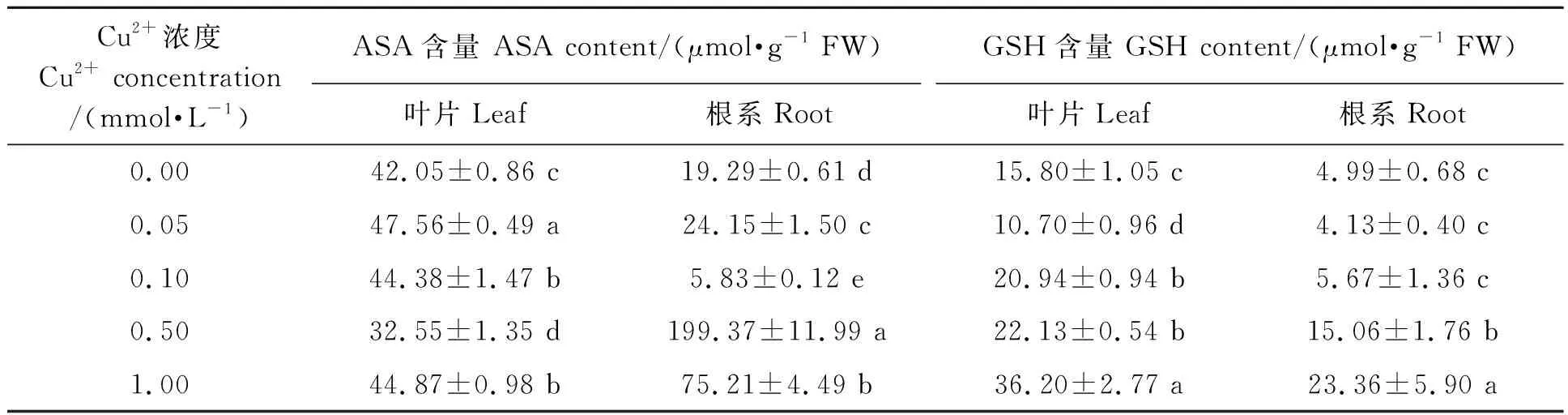
表3 不同濃度Cu2+處理小麥幼苗的ASA和GSH含量Table 3 Contents of ASA and GSH of wheat seedling in different Cu2+ concentrations
2.4 不同濃度Cu2+處理條件下4個ASA-GSH關鍵酶基因的變化
由圖3可知,APX基因在葉片和根系中的表達譜基本一致,在低濃度(0.05和0.10 mmol·L-1)Cu2+處理下表達顯著低于對照處理,其表達量在葉片中分別比對照顯著降低11.05%、31.74%,根系中較對照顯著降低19.79%、68.13%;高濃度(0.50和1.0 mmol·L-1)Cu2+處理下其表達量在葉片中分別比對照處理顯著增加2.19、2.67倍,根系中顯著增加1.18、3.25倍。DHAR和GR基因在葉片和根系中表達譜基本相似,其在葉片中均表現出低濃度(0.05和0.10 mmol·L-1)Cu2+處理表達量升高,而高濃度(0.50和1.0 mmol·L-1)Cu2+處理降低的趨勢。DHAR在0.05和0.10 mmol·L-1濃度分別增加到對照的2.05、2.00倍,GR增加到對照的2.10、2.56倍;在0.50和1.00 mmol·L-1濃度處理下DHAR的表達量分別比對照處理降低96.34%和69.42%,而GR的表達量在0.50 mmol·L-1Cu2+處理條件下為對照的1.42倍,但1.00 mmol·L-1Cu2+處理與對照無顯著差異。在根系中,DHAR和GR的表達量均隨著Cu2+處理濃度增加呈現遞增趨勢,0.05、0.10、0.50和1.00 mmol·L-1Cu2+處理的DHAR表達量分別增加到對照的1.42、3.06、5.33和3.56倍,4個處理的GR表達量分別增加到對照的1.63、2.09、3.61和3.77倍。在小麥葉片中,基因MDHAR在0.05和0.1 mmol·L-1Cu2+的表達譜與DHAR和GR基因相似,表達量均顯著高于對照植株,為對照的2.82倍和2.23倍;在1.0 mmol·L-1Cu2+處理的表達量顯著提高,為對照的2.61倍;但0.50 mmol·L-1Cu2+的表達量顯著低于對照處理。在小麥根系中,MDHAR基因的表達譜與基因APX相似,在0.10、0.50和1.00 mmol·L-1Cu2+處理下表達量分別顯著提高為對照的1.45、2.71和8.13倍。推測這些基因在不同組織間的差異表達可能與物種響應Cu2+脅迫的機制及處理濃度有關。
3 討論
重金屬脅迫影響作物的生長發育、使其產量下降,嚴重情況下可使其死亡甚至物種消失[5]。小麥作為世界上最重要的糧食作物之一,在其生長發育過程中經受著不同的脅迫傷害。有研究指出,過量Cu2+激活植物的POD、CAT、SOD酶促相關的保護酶系統,進而通過其在體內活性的增加來參與細胞活性氧的清除,引起膜質過氧化,進而影響小麥正常的生長發育[6]。MDA和H2O2是植物脅迫過程中評價其自身氧化脅迫程度和耐受性的關鍵指標[25-26]。本研究中,小麥MDA和H2O2含量隨著Cu2+濃度的升高呈現逐漸上升趨勢,并且小麥長勢受阻的表型相對于對照也逐漸明顯,說明小麥幼苗對Cu2+非常敏感,銅刺激可使幼苗細胞活性氧增加,引起膜質過氧化,進而阻止小麥幼苗的生長發育。Singh等[27]研究發現,Cu2+毒害通過膜脂損傷影響了小麥根系的生長和生物量的積累,進而影響小麥的正常生長發育;Janas等[28]對Cu2+脅迫下黃瓜幼苗研究也發現,高濃度Cu2+脅迫減緩黃瓜根系生長,使其葉片變黃枯萎,且葉片數量減少。本研究中高濃度的Cu2+積累引起小麥根系細胞氧化損傷,進而形成膜脂損傷,阻止植物對其他礦質元素的吸收利用,使小麥體內營養元素失調,影響其自身的代謝,從而抑制了小麥植株的正常生長發育。
在非生物脅迫條件下,植物抗氧化系統的重要成員ASA和GSH能阻止葉綠體中的ROS 積累,而高濃度ASA和GSH能保護植物細胞免受非生物脅迫引起的氧化損傷[29-30]。本研究結果顯示,Cu2+脅迫條件下,除0.10 mmol·L-1處理外,小麥根系ASA和GSH含量顯著高于對照處理,尤其在0.50 和1.00 mmol·L-1的高濃度處理下。這與Li等[15]和Kang等[16]的研究結果一致。但在0.50 mmol·L-1Cu2+條件下,小麥幼苗葉片中ASA含量顯著低于對照處理,而同處理的根系ASA含量是對照處理的10.33倍,可能是因為在此濃度條件下根系吸收Cu2+水平達到極限水平進而促使該器官中ASA的大量積累,同時植物為維持自身的體內平衡,阻止其向葉片轉移,顯著降低葉片ASA含量。這些結果表明,植物在不同濃度Cu2+脅迫條件下通過調控其體內不同器官的含量變化來應對逆境脅迫的傷害,進而維持其自身的生命活動。
對Cu2+脅迫的研究多集中在生理水平上,但轉錄水平通常比酶活性能更準確地反映某一或多種酶在脅迫下的變化,這是因為植物細胞內的酶大多數是由許多不同的同工酶組成,轉錄水平能夠定量測定單一同工酶在植物細胞內不同時空的變化。已有研究表明,不同物種在響應鹽、干旱、冷害等的非生物脅迫條件下,ASA-GSH合成相關酶在轉錄水平上的表達存在差異[15-16,31]。如Li等[15]對小麥幼苗鹽脅迫耐性研究發現,其通過影響APX,DHAR,MDHAR等8個ASA-GSH循環相關基因表達,進而參與其對逆境脅迫的傷害。因為,植物應對脅迫耐性中,ASA-GSH循環通過APX酶將脅迫產生H2O2還原為H2O,并生成不穩定的單脫氫抗壞血酸鹽(monodehydroascorbate, MDHA)或者發生歧化反應產生脫氫抗壞血酸鹽(dehydroascorbate, DHA);進而,MDHA通過MDHAR將其還原為ASA,而DHA則通過DHAR形成氧化型谷胱甘肽(oxidized glutathione, GSSG),在GR的催化下重新生成GSH,達到活性氧清除的目的[32]。因此,本研究利用qPCR的方法辨析了ASA-GSH合成相關4個酶基因APX、DHAR、MDHAR、GR在Cu2+脅迫下的轉錄表達變化,結果與之前研究[15-16,31]相似,銅脅迫對APX、DHAR、MDHAR、GR基因均有不同程度的誘導表達,且在根系中,參與ASA合成相關酶基因APX和MDHAR的表達趨勢一致(圖3),而參與GSH合成相關酶基因DHAR和GR的表達趨勢相同(圖3),說明這些基因在根系受銅脅迫條件下被誘導表達,與ASA和GSH含量的結果一致(表1)。在小麥葉片中,僅參與GSH合成相關酶基因DHAR和GR表達趨勢相同(圖3),而ASA合成相關酶基因APX僅受高濃度銅脅迫誘導,而MDAHR的表達與銅脅迫濃度相關性不大,是因為APX作為響應脅迫的受體,在低濃度范圍內,可維持其正常生長發育,而高濃度則受脅迫誘導而大量表達[32]。而MDAHR則是ASA生產的一個關鍵酶,因此,該基因在逆境脅迫中均能表達,因此對脅迫濃度不敏感。上述結果說明,小麥在應對銅脅迫耐性過程中,葉片和根系器官ASA-GSH循環存在一定的差異,進而導致了其合成相關基因的差異表達。因此,在銅脅迫條件下,小麥植株通過誘導ASA和GSH合成相關酶基因在根系和葉片器官中的差異表達來協調其植株體內脅迫耐性相關氧化平衡系統,進而提高ASA和GSH的含量來應對Cu2+脅迫。

