lncRNA NCK1-AS1在肝細胞肝癌組織中的表達及臨床意義*
楊鵬生,宋黎明,段希斌,梁馬可,梁占強,李學民
(鄭州市中心醫院肝膽胰腺外科,河南 鄭州 450000)
肝細胞肝癌(以下簡稱肝癌)是全世界最常見的惡性腫瘤之一。研究表明,我國是全球肝癌發病數和病死數最多的國家,約占全球一半以上[1-3]。目前,治療肝癌的主要方法是手術切除,但術后患者5年生存率僅約為50%,其復發率高達70%。導致肝癌患者預后不良的原因通常是缺乏有效的早期診斷[4-6]。因此,臨床亟須尋找一種與肝癌發生、發展密切相關,且能預測患者復發、轉移及預后的新型指標,從而為肝癌的早期診斷和治療提供新策略。
越來越多的證據表明,長鏈非編碼RNA(lncRNA)的表達具有組織特異性,在多種腫瘤中經常表達失調,一些lncRNA與腫瘤復發和預后不佳相關[7-8]。lncRNA被定義為長度超過200個核苷酸的非蛋白編碼轉錄本,一般來說,約78%的lncRNA具有組織特異性。除了更高的組織特異性外,lncRNA還具有更高的發育階段特異性,以及在異質組織(如人類新皮層)中的細胞亞型特異性[9-10]。現有研究指出,lncRNA可作為癌癥患者淋巴結轉移的分子標志物,與癌癥的進展密切相關[11]。lncRNA NCK1-AS1是lncRNA家族成員之一,在宮頸癌、前列腺癌的相關研究中顯示,其表達與患者不良預后相關[12-13]。本研究通過分析lncRNA NCK1-AS1在肝癌組織中的表達特點,探討其與臨床病理指標、預后的關系,以期為肝癌的診斷提供新靶點。
1 資料與方法
1.1一般資料 選取2015年4月至2017年6月本院肝癌確診患者73例,其中男48例,女25例;年齡42~78歲,平均54.4歲。所有患者均按照世界衛生組織中關于肝癌的診斷標準進行確診,且在術前未接受過放化療。采集肝癌組織及配對的癌旁組織(癌旁組織取于距腫瘤病灶2 mm以上的肝癌組織),放入凍存管進行標記,液氮貯存。根據肝癌組織中lncRNA NCK1-AS1表達水平將研究對象分為高表達組(33例)和低表達組(40例)。本研究經醫院倫理委員會批準,所有患者均知情且簽署知情同意書。術后對所有患者進行上門或電話隨訪,隨訪時間為手術當天至死亡當天或隨訪截止日。
1.2方法 (1)采用實時熒光定量聚合酶鏈式反應(qRT-PCR)檢測lncRNA NCK1-AS1表達水平。利用Trizol法提取組織樣品或培養細胞的總RNA,利用RNA反轉錄試劑盒將RNA反轉錄成cDNA。以cDNA為模板,利用Primer5.0設計引物,lncRNA NCK1-AS1正向引物為5′-TTC CCA TTT CTC CCA GGT CC-3′,反向引物為5′-TGG TTA CTT TGA GCC TGC CT-3′;β-actin正向引物為5′-AGC CTC GCC TTT GCC GA-3′,反向引物為5′-CTG GTG CCT GGG GCG-3′;miR-361-5p正向引物為GGG AGG TTA TCA GAA TCT CCA GG,反向引物為CAG TGC GTG TCG TGG AGT;U6正向引物為5′-ATT GGA ACG ATA CAG AGA AGA TT-3′,反向引物:5′-GGA ACG CTT CAC GAT TTG-3′。根據PCR試劑盒添加各組試劑配制熒光定量PCR反應體系,反應程序采用兩步法,每組設置3個重復,以β-action/U6為參照基因,采用2-ΔΔCt法計算lncRNA NCK1-AS1的相對表達水平。(2)lncRNA NCK1-AS1靶向基因預測。通過Starbase數據庫檢索發現lncRNA NCK1-AS1的靶向miR-361-5p,分析lncRNA NCK1-AS1與miR-361-5p表達的相關性。RNA提取試劑盒、Trizol試劑、熒光定量試劑盒均購自上海百研生物科技有限公司;引物序列由北京六合華大基因科技有限公司合成;NanoDrop微量核酸測定儀購自上海創萌生物科技有限公司。
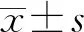
2 結 果
2.1肝癌組織和癌旁組織中lncRNA NCK1-AS1表達水平比較 肝癌組織組中lncRNA NCK1-AS1相對表達量高于癌旁組織,差異有統計學意義(P<0.05)。見圖1。

圖1 肝癌組織和癌旁組織中lncRNA NCK1-AS1表達情況
2.2不同lncRNA NCK1-AS1表達水平組臨床病理參數比較 低表達組分化程度、淋巴轉移及TNM分期情況與高表達組比較,差異均有統計學意義(P<0.05)。見表1。

表1 不同lncRNA NCK1-AS1表達水平組臨床病理參數比較(n)

續表1 不同lncRNA NCK1-AS1表達水平組臨床病理參數比較(n)
2.3不同lncRNA NCK1-AS1表達水平組生存期比較 低表達組中位生存期為20個月,明顯高于高表達組的15個月,差異有統計學意義(P<0.05)。
2.4lncRNA NCK1-AS1與miR-361-5p表達的相關性分析 通過Starbase數據庫檢索發現,lncRNA NCK1-AS1與miR-361-5p存在靶向調控位點,見圖2A。肝癌組織中miR-361-5p相對表達量低于癌旁組織,差異有統計學意義(P<0.05),見圖2B。lncRNA NCK1-AS1與miR-361-5p表達呈負相關(r2=0.078 6,P<0.001),見圖2C。利用Starbase數據庫進行lncRNA NCK1-AS1與miR-361-5p共表達分析,兩者呈負相關(P<0.05),見圖2D。

A為lncRNA NCK1-AS1與miR-361-5p的靶向序列信息;B為miR-361-5p在肝癌組織和癌旁組織中的表達;C為lncRNA NCK1-AS1與miR-361-5p表達的相關性;D為lncRNA NCK1-AS1與miR-361-5p共表達分析。
3 討 論
肝癌惡性程度高、隱匿性強、進展速度快,很多患者就診時已處于中晚期,失去手術機會。另外,肝癌術后易復發轉移,導致5年生存率低。肝癌的發生、發展涉及多步驟、多階段漸進演化,囊括多種基因的異常表達和表觀遺傳學的變化[14]。既往研究顯示lncRNA可參與腫瘤發生、發展過程,可能通過DNA、RNA、蛋白質3個方面參與復雜的分子調控機制。由于lncRNA的表達量或狀態均可作為效應分子,其表達水平高低反映腫瘤性質,故其與mRNA相比,是更好的腫瘤診斷層面標志物[15]。lncRNA作為一種新型腫瘤標志物,在肝癌組織發生、發展的調控過程中具有不可小覷的作用,對深入探究肝癌的發病機制并制定有效的早期診斷及治療策略具有重要意義。
國內外研究表明,lncRNA NCK1-AS1在膀胱癌、卵巢癌、宮頸癌、鼻咽癌中發揮重要作用。lncRNA NCK1-AS1在宮頸癌中過表達,并通過與miR-134的相互作用促進癌細胞的遷移侵襲和細胞增殖[16]。有研究發現,lncRNA NCK1-AS1促進NCK1表達會抑制化療過程中化學耐藥性的發展,促進卵巢癌的發生[17]。有研究顯示,前列腺癌中lncRNA NCK1-AS1表達會上調,而沉默lncRNA NCK1-AS1抑制了這種作用,會抑制膀胱癌細胞增殖和腫瘤細胞干性[18]。沉默lncRNA NCK1-AS1表達通過上調miR-135a抑制鼻咽癌癌細胞的遷移和侵襲[19]。lncRNA NCK1-AS1表達在肝癌中的作用研究鮮有報道。本研究利用qRT-PCR檢測肝癌患者肝癌組織和癌旁組織中lncRNA NCK1-AS1表達發現,肝癌組織中lncRNA NCK1-AS1表達水平明顯高于癌旁組織,lncRNA NCK1-AS1表達與分化程度、淋巴轉移和TNM分期等生物學行為相關,且lncRNA NCK1-AS1高表達患者預后較lncRNA NCK1-AS1低表達患者差。提示lncRNA NCK1-AS1可能成為肝癌預后的分子標記物。通過Starbase數據庫檢索發現,miR-361-5p可能為lncRNA NCK1-AS1潛在的靶向調控位點。肝癌患者miR-361-5p表達下調,其可通過靶向血管內皮生長因子A抑制肝癌細胞增殖和侵襲。miR-361-5p可通過抑制CXC趨化因子受體6表達而抑制肝癌細胞增殖,過表達miR-361-5p可顯著抑制裸鼠體內腫瘤生長。本研究結果顯示,肝癌組織miR-361-5p表達下調,lncRNA NCK1-AS1與miR-361-5p表達呈負相關。因此,lncRNA NCK1-AS1可能通過調控miR-361-5p表達來發揮作用。
綜上所述,肝癌組織中lncRNA NCK1-AS1呈高表達,與患者不良預后相關,其可能通過調控miR-361-5p表達來發揮作用。lncRNA NCK1-AS1可能會成為研究肝癌致病的分子機制之一,并可能成為肝癌診斷和預后判斷的新靶點。

