血站酶免檢測實驗室質量監控指標分析方法探討
刁麗波,梁艷嬌
(大理白族自治州中心血站,云南大理 671000)
酶免檢測是許多采供血機構在血液檢測策略中最常選擇的血清學檢測方法,《血站技術操作規程(2019 版)》〔1〕中明確規定:選擇能夠反映試驗系統變化的參數進行試驗系統監控,包括但不限于血清學檢測系統初復試反應率及兩者的比例(復試有反應性標本數∕初次試驗有反應性標本數)。但由于酶聯免疫吸附試驗(ELISA)的方法學特點,血站血液檢測的特殊性,實驗室檢測能力差異等原因,往往導致檢測質量參差不齊。本文擬通過對酶免檢測實驗室檢測數據的分析,探討通過觀察分析質量監控指標,做好過程控制的方法。
1 材料與方法
1.1 標本來源2018 年1 月—2019 年8 月大理白族自治州中心血站無償獻血者標本,獻血前征詢及體格檢查均符合《獻血者健康檢查要求》。標本于獻血時同步留取,其中,酶免檢測標本在采集當日經3 000 r∕min 離心10 min,于2~8 ℃保存,1 周內檢測完畢。
1.2 檢測試劑HBsAg 檢測試劑盒(北京萬泰生物藥業股份有限公司,批號:B20170628、B20170839、B20180102 等8 批次;法 國BIO-RAD 公 司,批號:7A0226、7G0232、7M0239 等6 批次);抗-HCV 檢測試劑盒(北京萬泰生物藥業有限公司,批號:CS20170605、CS20180101、CS20180304 等8 批 次;英科新創(廈門)科技股份有限公司,批號:2017065815、2017105824、2017125829 等9 批次);抗-HIV-Ag∕Ab-1+2 檢測試劑盒(北京萬泰生物藥業股份有限公司,批號:H20170707、H20170910、H20171213 等8 批次;法國BIO-RAD 公司,批 號:7C0393、7H0405、8C0424 等6 批次);抗-TP 檢測試劑盒(北京萬泰生物藥業有限公司,批號:N20170725、N20171033、N20180102 等8 批次;英科新創(廈門)科技股份有限公司,批號:2017067514、2017127523、2017127529等9批次)。
1.3 主要檢測設備Hamilton STAR-Let 液體工作站(瑞士HAMILTON 公司);FAME 全自動酶免分析儀(瑞士HAMILTON公司)。
1.4 檢測策略及判定規則每份標本均使用2 個不同廠家的ELISA 試劑進行酶免檢測,嚴格按照試劑說明書進行操作并判定結果。2 種試劑檢測結果均為有反應性和均為灰區的判為酶免檢測不合格;1 種試劑檢測結果為有反應性或灰區的,使用該試劑對原血樣標本進行雙孔復試,結果均為無反應性的判為酶免檢測合格,結果任意1孔為反應性或灰區的判為酶免檢測不合格。灰區設置:HBsAg為0.6 ≤s∕co<1,抗-HCV、抗-HIV 和 抗-TP 均 為0.8 ≤s∕co<1。
1.5 質量控制使用試劑盒提供的陰陽性對照和康徹斯坦公司的室內質控品進行有效性控制;實驗室每年參加國家衛生健康委員會臨床檢驗中心開展的室間質評活動對檢測質量進行評價,成績合格。
2 結果
2.1 酶免檢測2018 年1 月— 2019 年8 月共檢測54 622 份標本,由反應性數分別計算出試劑1 及試劑2的反應性率。見表1。
2.2 單試劑初次檢測反應性標本雙孔復試反應性率檢測使用χ2檢驗比較同一項目2 種試劑的復試反應性率,HBsAg 復試反應性率差異有統計學意義(P<0.05),抗-HCV、抗-HIV 和抗-TP 復試反應性率差異均無統計學意義(P>0.05)。見表2。
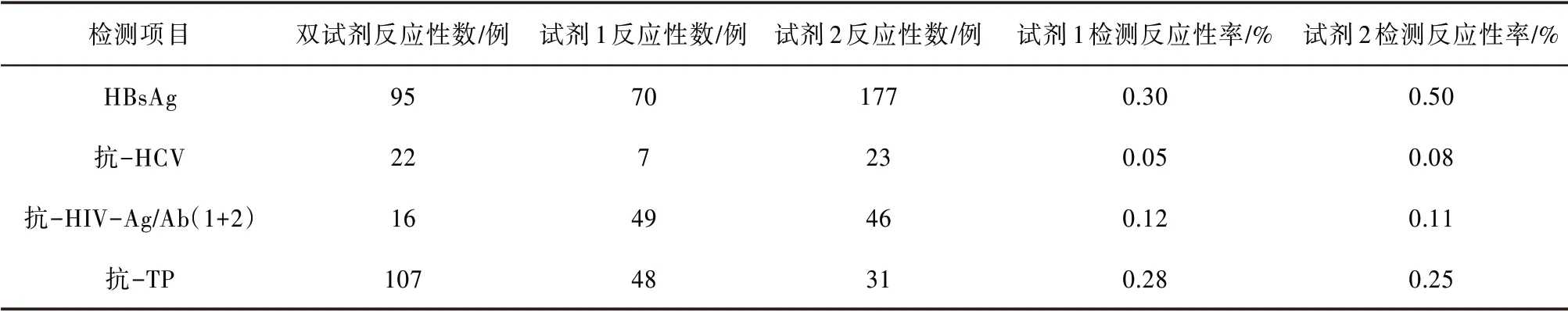
表1 酶免四項檢測結果統計(n=54 622)
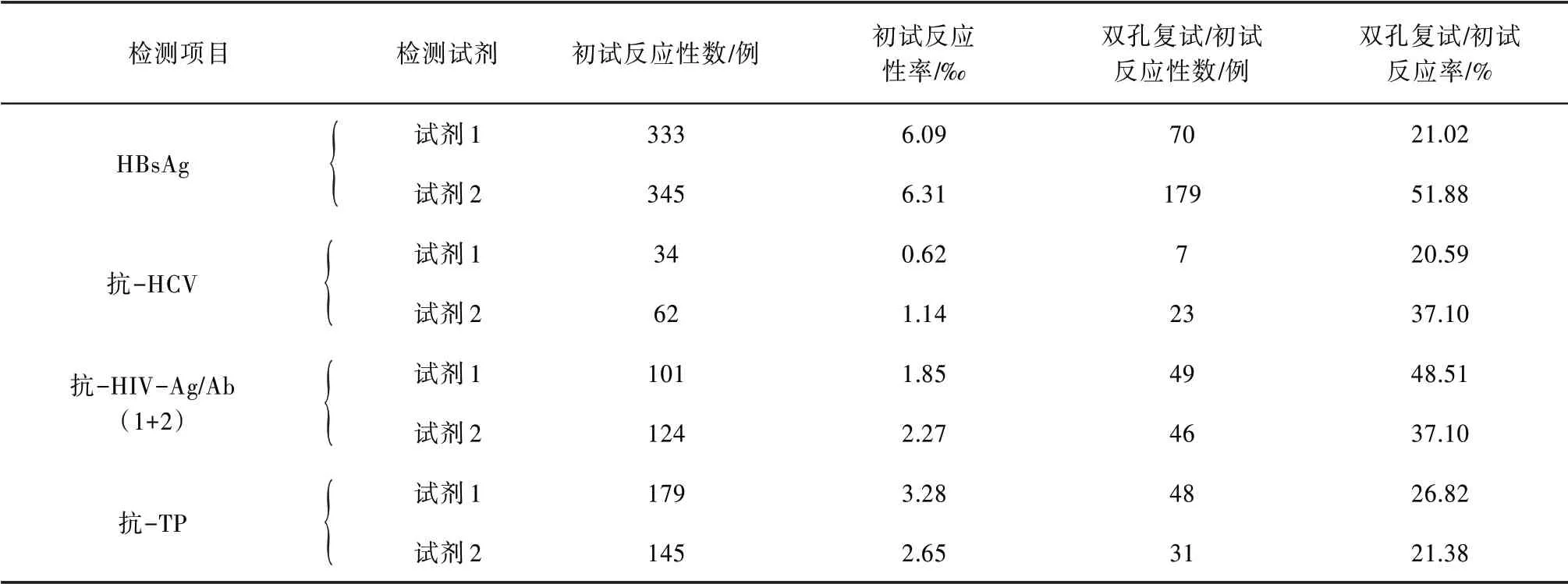
表2 單試劑初次檢測反應性標本雙孔復試反應性率檢測情況統計(n=54 622)
2.3 同一試劑所有批次的單試劑初次檢測反應性標本復試平均反應性率用各批次復試反應性率計算SD、CV(%),分析反應性率的離散程度。見表3。
2.4 試劑檢測反應性率分布根據檢測結果,按月統計2 個不同廠家的ELISA 試劑檢測反應性率分布。見圖1~4。

表3 2種試劑各批次單試劑初次檢測反應性標本雙孔復試平均反應性率統計
3 討論
血站酶免檢測中,由于實驗室檢測體系和檢測能力存在差別,檢測過程質量控制問題在小型血站實驗室中尤為突出。本文擬通過對大理白族自治州中心血站酶免檢測質量監控指標的回顧性分析,提供一些小型血站酶免檢測中的關注視角。
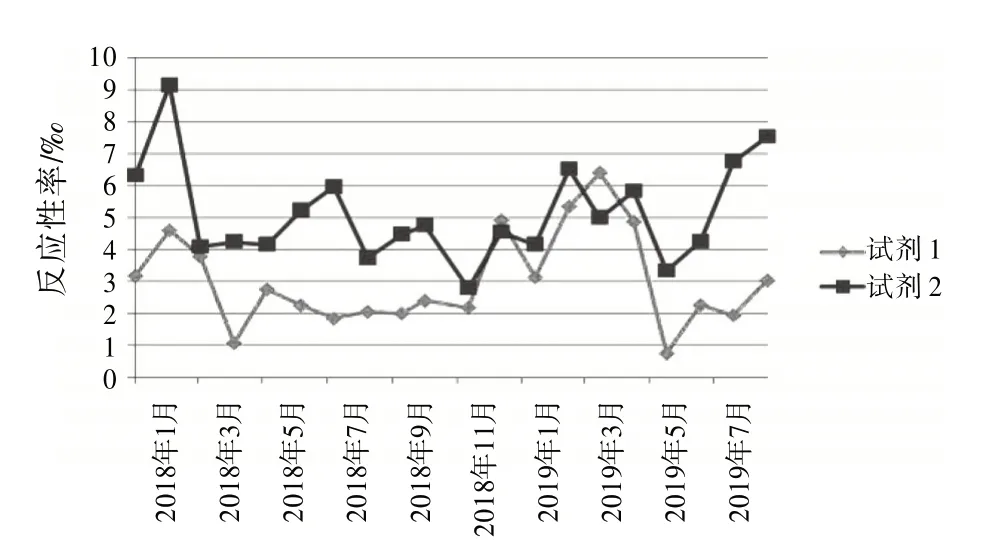
圖1 HBsAg 2種試劑檢測反應性率分布圖
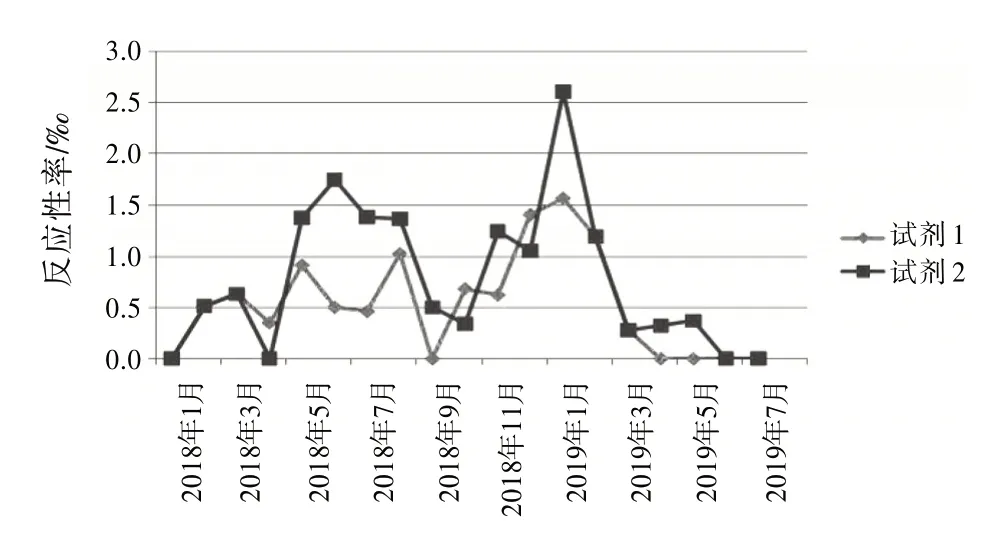
圖2 抗-HCV 2種試劑檢測反應性率分布圖
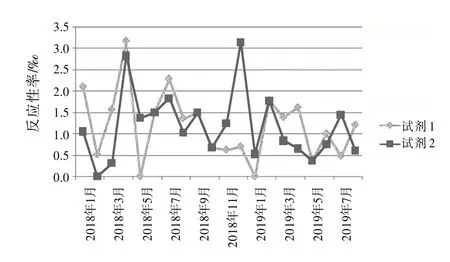
圖3 抗-HIV Ag∕Ab(1+2)2種試劑檢測反應性率分布圖
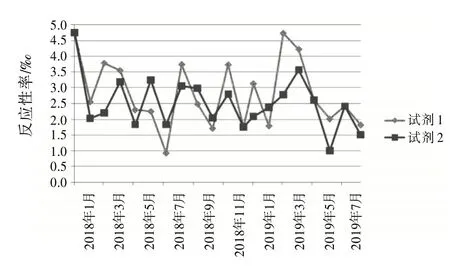
圖4 抗-TP 2種試劑檢測反應性率分布圖
同一ELISA 項目,反應原理不同,檢測性能并非一致〔2〕。從表2可以看出,2種抗-HCV試劑,一為夾心法,一為間接法,雙孔復試反應性率相差較大;2 種抗-HIV 試劑,均為第四代試劑(Ag-Ab 聯合檢測),雙孔復試反應性率接近;2種HBsAg試劑,同為夾心法,理論上復試反應性率應接近,但實際上在檢測中差異較大。由此提示,應進一步關注HBsAg檢測的過程控制,如試劑配制、液體分配、孵育溫度、洗板參數等。
由于ELISA 方法的局限性,假陽性較多〔3〕,加之為了進一步降低經血傳播相關傳染病的風險,血站普遍建立了“灰區”緩沖帶〔4-6〕。有報道〔7〕認為獻血者篩查的ELISA 檢測,HBsAg 的假陽性率甚至達到了6成。從表3可以看出,HBsAg試劑2各批號雙孔復試平均反應性率最高,CV最小,抗-HCV試劑1 各批號雙孔復試平均反應性率最低,CV 最大。HBsAg(試劑2)、抗-HIV(試劑1∕試劑2)、抗-TP(試劑1)同一廠家多個批號間差異較小,CV 均在40%以下;2 種抗-HCV 試劑多個批號間差異均較大,其中試劑1 的CV 最高,為147.10%。當然,抗-HCV(試劑1)反應性標本數最少,檢測下限也較低,雙孔復試反應性率的這種差異可能跟樣本總數少及檢測下限低有關。但也提示我們,選擇酶免試劑,不能僅僅追求較低的檢測下限,也應把重復性作為酶免檢測質量保證的關鍵控制點之一。
復試∕初試反應性率的變化體現了試驗過程狀態、實驗室檢測能力和質量管理體系運行狀態,反映了實驗室檢測的整體情況〔8〕。結合表1和圖1~4,月檢測反應性率明顯高于總反應性率時,應考慮是否因檢測過程,包括獻血者篩選、實驗人員操作方法、設備故障頻率、試劑物料儲存、使用條件和批號更換、試驗環境溫濕度改變等導致假反應性增多;月檢測反應性率明顯低于總反應性率時,應分析是否有漏檢的風險。2 種試劑的反應性率趨勢不一致時,如圖3 中抗-HIV 2018 年11 月與12 月2 種試劑的反應性率相比,試劑1 的11∕12 月反應性率接近,而試劑2的12月反應性率明顯升高,應考慮12月跟試劑2 有關的檢測過程是否存在問題,有無改進的方法;2 種試劑反應性率的總趨勢突然改變時,如圖1 中,HBsAg 檢測的反應性率一直是試劑2 高于試劑1,但在2019 年3 月,試劑1 的反應性率突然高于試劑2,應及時回顧分析發生趨勢改變的原因并找出改進措施。
自動化檢測過程應實時監控,盡量減少人工干預。文中所述的單試劑初試反應性標本,雙孔復試時均為手工加樣,雖然手工移液器和自動化加樣設備均經過檢定或校驗,但二者仍然存在差異,并在多次分配液體等過程中放大了這種差異。全自動檢測的精準、低錯是必然的〔9〕,因此,從2019 年9 月1日起,對所有雙孔復試的標本,全部采用自動化加樣,以保證檢測體系的穩定性,效果如何,我們將持續關注。
綜上所述,酶免檢測實驗室應重視對質量控制指標的分析,不能把某次試驗及結果當做一個獨立的事件,建立檢測結果是檢測體系整體過程綜合能力體現的觀念,通過對質量控制指標的分析與回顧,進一步提高檢測質量。

