H2A.X 和NPM1 哺乳動(dòng)物雙雜交表達(dá)載體的構(gòu)建及其在MCF-7 細(xì)胞中的表達(dá)
高秀麗 段文博 王 婧 王 濤 任 珊
(1.齊齊哈爾醫(yī)學(xué)院醫(yī)藥科學(xué)研究院,黑龍江齊齊哈爾 161006;2.齊齊哈爾醫(yī)學(xué)院醫(yī)學(xué)技術(shù)學(xué)院,黑龍江齊齊哈爾 161006)
組蛋白H2A.X(histone H2A.X,H2A.X)是組蛋白H2A 的一個(gè)變體,在DNA 損傷應(yīng)答過程中發(fā)揮關(guān)鍵作用。在DNA 損傷誘導(dǎo)的腫瘤形成過程中,H2A.X 發(fā)生139 位絲氨酸的磷酸化,同時(shí)招募一些DNA 損傷修復(fù)蛋白及一些信號(hào)蛋白,在DNA 損傷位點(diǎn)附近形成復(fù)合物,進(jìn)而啟動(dòng)細(xì)胞對(duì)DNA 損傷的應(yīng)答、修復(fù)等過程[1]。核仁磷蛋白(nucleophosmin,NPM1)是一種組蛋白伴侶蛋白,其可同組蛋白相互結(jié)合,負(fù)責(zé)調(diào)解不同的細(xì)胞功能,例如組蛋白轉(zhuǎn)運(yùn)、基因組穩(wěn)定及轉(zhuǎn)錄調(diào)控等[2]。研究表明,在放射線誘導(dǎo)的條件下,H2A.X 會(huì)在DNA 損傷及修復(fù)的不同的時(shí)期形成動(dòng)態(tài)復(fù)合物,而NPM1 是整個(gè)過程的常駐成員[3]。DNA 損傷的積累是癌癥發(fā)生的主要原因,而誘導(dǎo)癌細(xì)胞發(fā)生DNA 損傷又是癌癥放化療的主要手段[4],因此研究DNA 損傷對(duì)癌癥的病因和治療靶點(diǎn)的篩選具有重要意義,而H2A.X 與NPM1的相互結(jié)合有望成為連接DNA 損傷與癌癥之間的關(guān)鍵橋梁。哺乳動(dòng)物雙雜交能夠有效地檢測(cè)蛋白質(zhì)之間在體內(nèi)條件下的相互作用,彌補(bǔ)了體外研究蛋白質(zhì)相互作用的不足。本研究分別構(gòu)建了H2A.X 及NPM1 哺乳動(dòng)物雙雜交表達(dá)載體,并實(shí)現(xiàn)了其在人乳腺癌MCF-7 細(xì)胞中的表達(dá),以期為深入研究乳腺癌中H2A.X 同NPM1 的結(jié)合及其功能提供實(shí)驗(yàn)基礎(chǔ)。
1 材料和方法
1.1 實(shí)驗(yàn)細(xì)胞
MCF-7 細(xì)胞購(gòu)自中國(guó)科學(xué)院上海細(xì)胞庫(kù)。
1.2 主要試劑與儀器
MEM 培養(yǎng)液(HyClone,SH30024.01B,美國(guó));Opti-MEM 培養(yǎng)液(Gibgo,31985070,美國(guó));胎牛血清(Clark,FB25015,美國(guó));Lip3000 轉(zhuǎn)染試劑(Invitrogen,美國(guó));限制性內(nèi)切酶(TaKaRa,日本);TRIzol(Invitrogen,15596-026,美國(guó));逆轉(zhuǎn)錄試劑盒(全式金,AE301-02,中國(guó));Ex Taq HS 聚合酶(TaKaRa,RR006,日本);凝膠回收試劑盒(全式金,EG101 -01,中國(guó));T5 Zero 載體(全式金,CT501,中國(guó));質(zhì)粒小量提取試劑盒(康為,CW2016,中國(guó));T4 DNA 連接酶(全式金,FL101-01,中國(guó))。
PCR 儀(Bio-Rad,C1000 Touch,美國(guó));臺(tái)式冷凍離心機(jī)(Eppendorf,5804R,德國(guó));紫外可見分光光度計(jì)(島津,Biospec-nano,日本);凝膠成像分析系統(tǒng)(Bio-Rad,ChemiDoc1708280,美國(guó));正置顯微鏡(尼康,E100 Eclipse,日本);二氧化碳培養(yǎng)箱(Thermo,3111,美國(guó));暗箱式紫外分析儀(上海馳唐,WFH-203B)。
1.3 實(shí)驗(yàn)方法
1.3.1 細(xì)胞及培養(yǎng)方法
MCF-7 細(xì)胞培養(yǎng)于MEM 培養(yǎng)液,添加10%胎牛血清,0.11 g/L 丙酮酸鈉及0.01 mg/mL 牛胰島素,培養(yǎng)于37℃含5% CO2的細(xì)胞培養(yǎng)箱中。
1.3.2 細(xì)胞轉(zhuǎn)染
MCF-7 細(xì)胞采用Lip3000 轉(zhuǎn)染試劑進(jìn)行瞬時(shí)轉(zhuǎn)染:將7.5 μL Lip3000 轉(zhuǎn)染試劑和2.5 μg 質(zhì)粒DNA分別加至125 μL Opti-MEM 培養(yǎng)液中,之后將含DNA 的Opti-MEM 培養(yǎng)液轉(zhuǎn)移至含轉(zhuǎn)染試劑的培養(yǎng)液中,混勻并靜止20 min 后滴加至細(xì)胞中。轉(zhuǎn)染約36 h 后利用RT-PCR 方法檢測(cè)基因轉(zhuǎn)染效率。
1.3.3 H2A.X 及NPM1 表達(dá)載體的構(gòu)建
根據(jù)人源H2A.X(GeneBank accession:NM_002105.3) 及 NPM1 (GeneBank accession:NM _002520.6)基因序列在編碼區(qū)上游和下游設(shè)計(jì)并合成擴(kuò)增引物:H2A.X(上游5’-GCTCTAGAGCTA GCATGTCGGGCCGCGGCAAG-3’,下游 5’-GGGG TACCTTAGTACTCCTGGGAGGCCTGGGT-3’);NPM1(上游5’-GCTCTAGACACCCGATGGAAGATTCGAT GGA-3’,下游5’-GGGGTACCTTAAAGAGACTTCC TCCACTGCCAG-3’),并在引物兩端引入限制性酶切位點(diǎn)(上游:XbalⅠ,下游:KpnⅠ)。常規(guī)TRIzol法提取MCF-7 細(xì)胞總RNA 并將RNA 逆轉(zhuǎn)錄成cDNA。以獲得的cDNA 為模板,由Ex Taq HS 聚合酶擴(kuò)增H2A.X 及NPM1 mRNA 全長(zhǎng)序列,擴(kuò)增條件:94℃變性30 s,55℃退火30 s,72℃延伸1 min,以上過程重復(fù)30 循環(huán),最后執(zhí)行72℃10 min。PCR產(chǎn)物經(jīng)1%瓊脂糖凝膠電泳鑒定后由凝膠回收試劑盒按說明書純化回收并與T5 Zero 載體在37℃條件下連接2 h,連接產(chǎn)物轉(zhuǎn)化大腸桿菌DH5a 感受態(tài)細(xì)胞,轉(zhuǎn)化產(chǎn)物經(jīng)37℃孵育16 h 后挑取平板上生長(zhǎng)飽滿的單克隆菌落培養(yǎng)14 h,提取細(xì)菌質(zhì)粒DNA 并進(jìn)行電泳及雙酶切驗(yàn)證(酶切體系:XbalⅠ0.5 μL,KpnⅠ0.5 μL,M buffer 2 μL,質(zhì)粒DNA 1 μg,雙蒸水補(bǔ)充至20 μL;酶切條件:37℃,2 h),經(jīng)酶切驗(yàn)證正確的產(chǎn)物分別由T4 DNA 連接酶連接至線性p-BIND及PACT 表達(dá)載體(連接體系:線性目的片段17 μL,線性載體2 μL,T4 DNA 連接酶1 μL,5×DNA 連接酶緩沖液5 μL;連接條件:16℃,14 h),獲得的連接產(chǎn)物通過電泳及雙酶切驗(yàn)證后送至上海生工生物工程有限公司進(jìn)行測(cè)序驗(yàn)證。
1.3.4 RT-PCR 檢測(cè)H2A.X 及NPM1 mRNA 表達(dá)水平
MCF-7 細(xì)胞采用常規(guī)TRIzol 法提取RNA 并逆轉(zhuǎn)錄成cDNA。以獲得的cDNA 為模板,以H2A.X、NPM1 及GAPDH RT-PCR 引物進(jìn)行PCR 擴(kuò)增,擴(kuò)增條件:94℃變性30 s,55℃退火30 s,72℃延伸1 min,以上過程重復(fù)30 循環(huán)。H2A.X 引物序列:上游5’-TACCTCGCTAGCATGTCGGG-3’,下游5’-TTAGTACTCCTGGGAGGCCTGGGTG-3’;NPM1 引物序列:上游5’-TGTGAACTAAAGGCCGACAAAGATT-3’,下游5’-CACTAATATGCACTGGCCCTGAACC-3’,GAPDH 引物序列:上游5’-GGACCTGACCTG CCGTCTA-3’,下游5’-GAGTGGGTGTCGCTGTTGA-3’。將獲得的PCR 產(chǎn)物進(jìn)行1%瓊脂糖凝膠電泳,并通過Bio-Rad 凝膠成像儀進(jìn)行凝膠成像。
2 結(jié)果
2.1 H2A.X-pBind 表達(dá)載體的構(gòu)建
電泳結(jié)果表明,獲得的H2A.X PCR 產(chǎn)物同NCBI 上報(bào)道的H2A.X 編碼序列大小相一致(圖1 A),將純化后的PCR 產(chǎn)物進(jìn)行TA 克隆及酶切驗(yàn)證后,獲得預(yù)期大小的DNA 片段(圖1B、1C)。將驗(yàn)證正確的酶切產(chǎn)物與p-BIND 線性載體連接并酶切驗(yàn)證后,同樣獲得預(yù)期DNA 片段(圖1D、1E)。選取驗(yàn)證結(jié)果正確的連接產(chǎn)物進(jìn)行測(cè)序,測(cè)序結(jié)果與NCBI 中H2A.X 編碼序列比對(duì)驗(yàn)證,插入片段匹配率為100%(圖1F)。以上結(jié)果說明H2A.X-pBIND表達(dá)載體構(gòu)建成功。
2.2 NPM1-PACT 表達(dá)載體的構(gòu)建
電泳結(jié)果表明,獲得的NPM1 PCR 產(chǎn)物同NCBI 上報(bào)道的NPM1 編碼序列大小相一致(圖2 A),將純化后的PCR 產(chǎn)物進(jìn)行TA 克隆及酶切驗(yàn)證后,獲得預(yù)期大小的DNA 片段(圖2B、2C)。將驗(yàn)證正確的酶切產(chǎn)物與PACT 線性載體連接并酶切驗(yàn)證后,同樣獲得預(yù)期DNA 片段(圖2D、2E)。選取驗(yàn)證結(jié)果正確的連接產(chǎn)物進(jìn)行測(cè)序,測(cè)序結(jié)果與NCBI 中NPM1 編碼序列比對(duì)驗(yàn)證,插入片段匹配率為100%(圖2F)。以上結(jié)果說明NPM1-PACT 表達(dá)載體構(gòu)建成功。
2.3 H2A.X 及NPM1 在MCF-7 細(xì)胞中表達(dá)效果
將構(gòu)建好的H2A.X-pBIND 及NPM1-PACT 表達(dá)載體及其對(duì)照空載體分別轉(zhuǎn)染至MCF-7 細(xì)胞中,并利用RT-PCR 方法檢測(cè)兩種基因的表達(dá)水平。結(jié)果表明,同對(duì)照組相比,實(shí)驗(yàn)組中H2A.X 及NPM1 mRNA 表達(dá)水平均明顯增加(圖3),說明構(gòu)建的H2A.X 及NPM1 表達(dá)載體可成功在MCF-7 細(xì)胞中表達(dá)。
3 討論
女性乳腺癌因其高發(fā)病率、難治愈性以及發(fā)病群體的年輕化而成為癌癥領(lǐng)域急需攻克的難題之一。眾多研究結(jié)果表明,DNA 損傷的積累是乳腺癌發(fā)生的主要原因,而誘導(dǎo)癌細(xì)胞發(fā)生DNA 損傷又是乳腺癌放化療的主要途徑,因此研究DNA 損傷應(yīng)答對(duì)乳腺癌的病因和治療靶點(diǎn)的篩選具有重要的意義。H2A.X 因其同DNA 損傷應(yīng)答的密切關(guān)系而成為研究熱點(diǎn)。目前,ATM-H2A.X-p53 已成為經(jīng)典的DNA 損傷信號(hào)途徑:ATM 是DNA 損傷的感受器并磷酸化H2A.X,激活p53,進(jìn)而啟動(dòng)細(xì)胞周期阻滯、DNA 修復(fù)及細(xì)胞凋亡[5-7]。然而,除以上經(jīng)典途徑外,H2A.X 可在DNA 損傷應(yīng)答的不同時(shí)期招募不同蛋白形成動(dòng)態(tài)變化的復(fù)合物,Du 等[3]研究表明NPM1 是多種動(dòng)態(tài)復(fù)合物中的常駐成員,而其在H2A.X 介導(dǎo)的DNA 損傷應(yīng)答過程中的作用尚不清楚。目前,針對(duì)NPM1 的研究主要集中NPM1 的突變、過表達(dá)及其翻譯后修飾同癌癥之間的關(guān)系[8]。研究表明,NPM1 突變已成為急性髓性白血病的標(biāo)志之一[9-11],而在胃癌[12]、結(jié)腸癌[13]、卵巢癌[14]等癌中NPM1 則呈高表達(dá),并通過促進(jìn)細(xì)胞增殖和抑制細(xì)胞凋亡發(fā)揮其促癌作用[15-16]。另外,NPM1 是一種可發(fā)生多種翻譯后修飾的蛋白,翻譯后修飾會(huì)直接調(diào)控NPM1 的功能,且同多種癌癥的發(fā)生發(fā)展密切相關(guān)[17-18]。近年來,NPM1 的組蛋白伴侶功能也逐漸受到人們的重視,其同組蛋白結(jié)合后對(duì)組蛋白的轉(zhuǎn)運(yùn)、染色質(zhì)轉(zhuǎn)錄的調(diào)控功能逐漸為人們所揭示[19]。這提示我們,NPM1 可能因其組蛋白伴侶蛋白的特性同H2A.X 結(jié)合,并以DNA 損傷為橋梁在乳腺癌的發(fā)生發(fā)展過程中扮演重要角色。
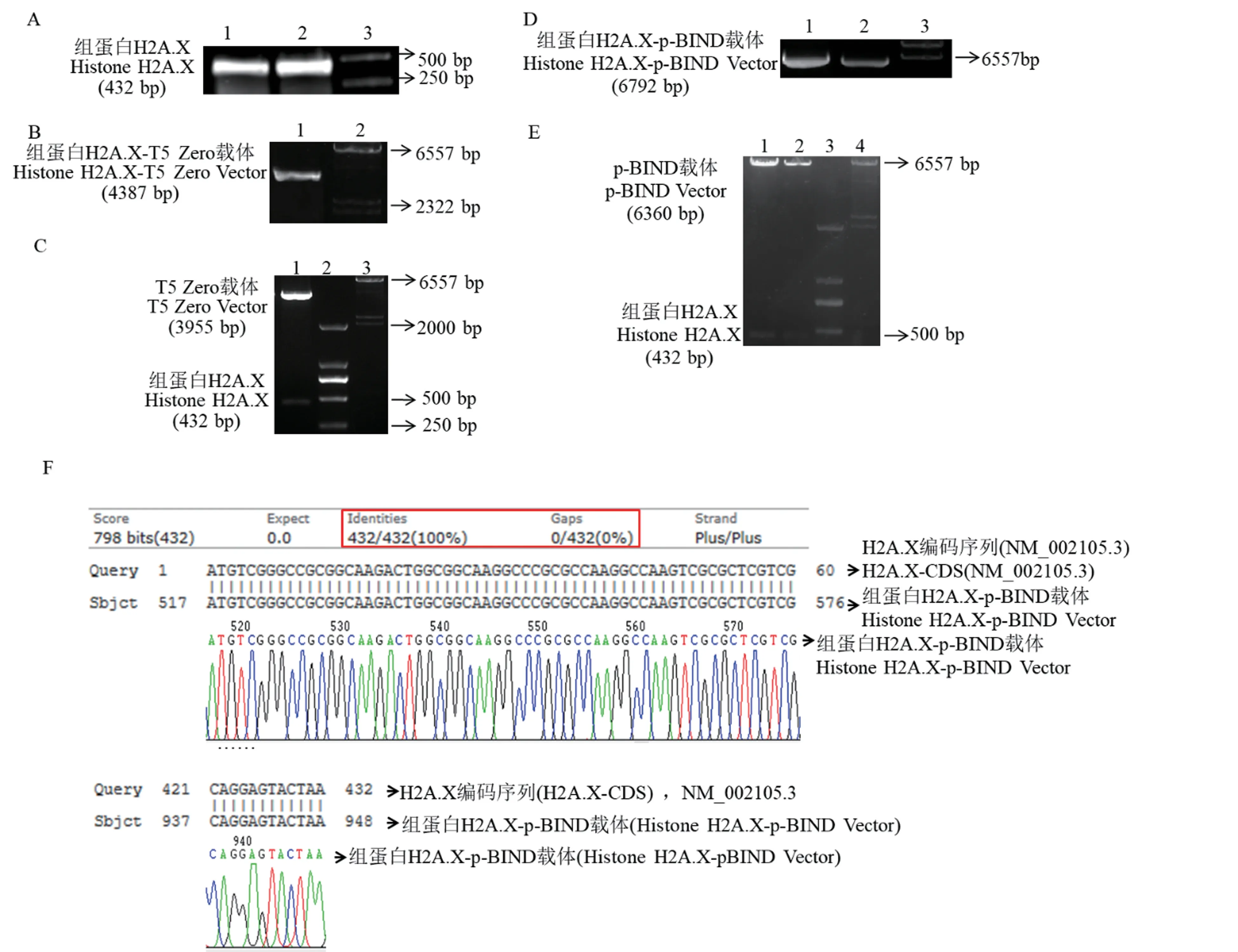
圖1 H2A.X-pBIND 表達(dá)載體的構(gòu)建Note.A,Amplification of H2A.X gene expression sequence by PCR method.1/2,Replication experiments for increasing PCR products;3,DL2000 DNA Marker.B,TA clone of H2A.X PCR products.1,TA clone products of H2A.X-T5 Zero;2,λ-Hind ⅢDNA Marker.C,Double enzyme validation of H2A.X TA clone.1,H2A.X-T5 Zero double enzyme products by Xbal Ⅰand Kpn Ⅰ;2,DL2000 DNA Marker;3,λ HindⅢDNA Marker.D,Clone between H2A.X and target vector p-BIND.1/2,Clone products of H2A.X-pBIND;3,λ-HindⅢDNA Marker.E,Double enzyme validation of H2A.X-pBIND clone.1/2,H2A.X-pBIND double enzyme products by Xbal Ⅰand Kpn Ⅰ;3,DL2000 DNA Marker;4,λ-Hind ⅢDNA Marker.F,Sequencing results of H2A.X-pBIND.Figure 1 Construction of H2.X-pBIND expression vector
蛋白質(zhì)是生物功能的最終執(zhí)行者,幾乎每一項(xiàng)功能的完成都需要不同蛋白之間的協(xié)同合作。因此,研究蛋白質(zhì)與蛋白質(zhì)之間的相互作用是解析各種調(diào)控機(jī)制的關(guān)鍵。哺乳動(dòng)物雙雜交方法衍生于酵母雙雜交[20-21],該方法分別將兩種目標(biāo)蛋白與轉(zhuǎn)錄因子的DNA 結(jié)合結(jié)構(gòu)域與轉(zhuǎn)錄激活結(jié)構(gòu)域相融合,利用目標(biāo)蛋白的相互結(jié)合,使轉(zhuǎn)錄因子的兩種結(jié)構(gòu)域在空間上相互靠近,進(jìn)而啟動(dòng)報(bào)告基因的轉(zhuǎn)錄,最終利用報(bào)告基因的活性指示兩種目標(biāo)蛋白的結(jié)合情況,是研究蛋白質(zhì)-蛋白質(zhì)相互作用的經(jīng)典方法[22-23]。同目前主流的蛋白質(zhì)免疫共沉淀方法相比,哺乳動(dòng)物雙雜交的優(yōu)點(diǎn)在于可最大程度地模擬體內(nèi)蛋白質(zhì)-蛋白質(zhì)的相互作用,也常作為蛋白質(zhì)免疫共沉淀的互補(bǔ)方法;同GST pull-down 實(shí)驗(yàn)及組學(xué)方法相比,哺乳動(dòng)物雙雜交具有操作簡(jiǎn)單、成本低的優(yōu)勢(shì)。因此,哺乳動(dòng)物雙雜交是研究蛋白質(zhì)互作中不可缺少的主要方法。
本研究以哺乳動(dòng)物雙雜交實(shí)驗(yàn)為基礎(chǔ),構(gòu)建了H2A.X 和NPM1 相應(yīng)表達(dá)載體,同時(shí)實(shí)現(xiàn)了兩種表達(dá)載體在乳腺癌MCF-7 細(xì)胞中的表達(dá),為后續(xù)研究乳腺癌中H2A.X 同NPM1 的結(jié)合及功能提供了實(shí)驗(yàn)基礎(chǔ)。但二者在乳腺癌中的相互作用模式以及在乳腺癌DNA 損傷應(yīng)答過程中扮演的角色仍需進(jìn)一步的研究。

圖2 NPM1-PACT 表達(dá)載體的構(gòu)建Note.A,Amplification of NPM1 gene expression sequence by PCR method.1/2,Replication experiments for increasing PCR products;3,DL2000 DNA Marker.B,TA clone of NPM1 PCR products.1,TA clone products of NPM1-T5 Zero;2,λ-Hind ⅢDNA Marker;C,Double enzyme validation of NPM1 TA clone.1,H2A.X-T5 Zero double enzyme products by Xbal Ⅰand Kpn Ⅰ;2,DL2000 DNA Marker;3,λ HindⅢDNA Marker.D,Clone between NPM1 and target vector PACT.1/2,Clone products of NPM1-PACT;3,λ-Hind ⅢDNA Marker.E,Double enzyme validation of NPM1-ACT clone.1/2,NPM1-PACT double enzyme products by Xbal Ⅰand Kpn Ⅰ;3,DL2000 DNA Marker.F,Sequencing results of NPM1-PACT.Figure 2 Construction of NPM1-PACT expression vector

圖3 H2A.X-pBIND 和NPM1-PACT 在MCF-7 細(xì)胞中的表達(dá)Note.1,MCF-7 cells transfected with pBIND (control group);2,MCF-7 cells transfected with H2A.X-pBIND (experiment group);3,MCF-7 cells transfected with PACT(control group);4,MCF-7 cells transfected with NPM1-PACT (experiment group);5,DL2000 DNA Marker.Figure 3 Expression of H2A.X-pBIND and NPM1-PACT in MCF-7 cells

