等摩爾連續(xù)變化法測定絡(luò)合物穩(wěn)定常數(shù)數(shù)據(jù)處理法
王子迎 韓冬晴 張飛燕 開小明 方皓文

摘 要:等摩爾連續(xù)變化法測定絡(luò)合物穩(wěn)定常數(shù)是本科教學(xué)內(nèi)容,但實際實驗效果并不理想。模擬了摩爾連續(xù)變化法曲線,對濃度為10-4mol/L的金屬離子,1:1的絡(luò)合物穩(wěn)定常數(shù)要大于106,否則不能得出正確的結(jié)果。給出了絡(luò)合物穩(wěn)定常數(shù)的計算方法,指出了教科書中酸度影響絡(luò)合物組成的不妥之處。
關(guān)鍵詞:等摩爾連續(xù)變化法; 磺基水楊酸; 銅; 穩(wěn)定常數(shù); 酸度
中圖分類號:O657.32;G64;O6? ? ? ? ? 文獻標(biāo)識碼:A? ? 文章編號:1006-3315(2021)3-195-002
Job提出等摩爾連續(xù)變化法測定絡(luò)合物組成和穩(wěn)定常數(shù),在無機化學(xué)實驗、分析化學(xué)實驗和物理化學(xué)實驗教科書中[1-3]常作為實驗內(nèi)容。此法要求絡(luò)合物穩(wěn)定常數(shù)較大,但沒有具體說多大。另外,絡(luò)合物也是逐級形成的,其每級穩(wěn)定常數(shù)是越來越小的,如果能進行定量分析,相鄰的兩種絡(luò)合物型體穩(wěn)定常數(shù)必須相差105以上。假如分析對象非1[∶]1的絡(luò)合物,在顯色劑濃度較低時,溶液中就可能存在多種型體,那Job法就不合適,各種型體吸收曲線不一樣;但作者確實測定了亞鐵離子與鄰二氮菲的絡(luò)合物,是符合Job曲線的,這可能吸光度與鄰二氮菲依數(shù)性有關(guān),即吸光度僅與絡(luò)合物中顯色劑的數(shù)量有關(guān)。確定絡(luò)合物組成不難,只要確定金屬離子與顯色劑濃度整數(shù)摩爾比時,吸光度最大就行。下面僅討論1[∶]1的絡(luò)合物,Job法測定絡(luò)合物穩(wěn)定常數(shù)的問題。
1.計算絡(luò)合物穩(wěn)定常數(shù)原理
Job法從曲線兩側(cè)引出直線,求出交叉點。引出直線的主觀性很大,交叉點也不一定落在最大吸光度的上方,我們對此進行理論分析。
對于絡(luò)合反應(yīng):
其穩(wěn)定常數(shù)K為:
式(1)中[M][R][MR]分別是溶液中金屬離子M、顯色劑R、生成絡(luò)合物MR型體的濃度,C[M]、C[R]分別為M、R的分析濃度。上式整理得:
依據(jù)式(4),以[MR]為縱坐標(biāo),[α]為橫坐標(biāo)模擬作圖1。如果c的濃度為0.0001mol/L,希望[α]小于0.4的數(shù)據(jù)點,擬合成一條直線,穩(wěn)定常數(shù)K要達到106,在[α]=0.4時,95.6%的金屬離子生成絡(luò)合物;如果c的濃度為0.001mol/L,穩(wěn)定常數(shù)K要達到105,在[α]=0.4時,95.6%的金屬離子生成絡(luò)合物。上述分析表明,穩(wěn)定常數(shù)小,通過Job法求穩(wěn)定常數(shù)誤差是很大的。
2.穩(wěn)定常數(shù)K計算方法
計算穩(wěn)定常數(shù)是困難的,怎樣求出在MR吸光度最大,對應(yīng)的金屬離子完全絡(luò)合時的吸光度,理論推導(dǎo)如下。
式(5)中下標(biāo)1、2分別對應(yīng)1、2數(shù)據(jù)點的物理量值。[ε]為MR的摩爾吸光系數(shù),A為MR的吸光度。
上式整理得:
依據(jù)[α]=0.5時的吸光度A,將比色皿厚度固定為1cm。
3.實驗結(jié)果的檢驗
文獻[4],在pH=5的溶液中,測定磺基水楊酸銅絡(luò)合物穩(wěn)定常數(shù),實驗測定數(shù)據(jù)如表1
以吸光度最大的中間值求其兩側(cè)摩爾吸光系數(shù),摩爾吸光系數(shù)僅為121L·mol-1·cm-1,表觀穩(wěn)定常數(shù)為209,而原文獻給出計算機處理結(jié)果為420,作圖結(jié)果為381,與本文結(jié)果相差很大。
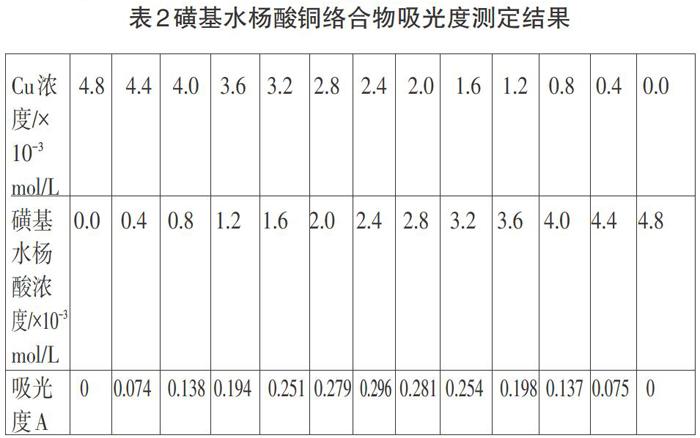
文獻[5],在pH=5.6的六亞甲基四胺溶液中,用2cm比色皿,測定磺基水楊酸銅絡(luò)合物穩(wěn)定常數(shù),實驗測定數(shù)據(jù)如表2
同上數(shù)據(jù)處理法,求得摩爾吸光系數(shù)為83L·mol-1·cm-1,表觀穩(wěn)定常數(shù)為3641,如文獻作圖給出計算結(jié)果3.6×103一致。如果將文獻溶液濃度和求出表觀穩(wěn)定常數(shù)代入公式(4)計算,在[α]=0.3時,88.4%的金屬離子生成絡(luò)合物,說明文獻作圖結(jié)果具有很大的主觀性。
4.結(jié)論
Job法只能測定組成單一,穩(wěn)定常數(shù)很大的絡(luò)合物穩(wěn)定常數(shù),如果絡(luò)合物穩(wěn)定常數(shù)不大,還是建議采用作者提供的數(shù)據(jù)處理方法。也有文獻[6]與作者提出相反的結(jié)論,推薦1:1的絡(luò)合物穩(wěn)定常數(shù)1 參考文獻: [1]中山大學(xué)等編著.無機化學(xué)實驗[M]北京:高等教育出版社,1978:129-131 [2]北京大學(xué)化學(xué)系分析化學(xué)教學(xué)組.基礎(chǔ)分析化學(xué)實驗(第二版)[M]北京:北京大學(xué)出版社,2003:64-67 [3]東北師范大學(xué)等校編.物理化學(xué)實驗[M]北京:人民教育出版社,1982:79-84 [4]張衛(wèi)華,李國屏.磺基水楊酸銅(Ⅱ)絡(luò)合物組成及穩(wěn)定常數(shù)測定實驗數(shù)據(jù)的計算機處理[J]湖北師范學(xué)院學(xué)報(自然科學(xué)版),1989,8(2):72-78 [5]劉紹乾,方正法,楊章鴻等.磺基水楊酸合銅配合物組成和穩(wěn)定常數(shù)測定實驗的改進[J]大學(xué)化學(xué),2018,33(3):59-62 [6]王榮,王晴.針對連續(xù)變化法測定絡(luò)合物穩(wěn)定常數(shù)實驗中可能出現(xiàn)的設(shè)計缺陷的討論[J]化學(xué)教育,2018,39(16):75-77 [7]華中師范大學(xué)等編.分析化學(xué)(第四版)[M]北京:高等教育出版社,2012:344

