棗果實糖組分含量動態變化與相關基因表達分析
張亞若,童盼盼,梁豐志,吳翠云,3,王江波,3*
(1.塔里木大學 植物科學學院,新疆 阿拉爾 843300;2.塔里木大學 南疆特色果樹高效優質栽培與深加工技術國家地方聯合工程實驗室,新疆 阿拉爾 843300;3.新疆生產建設兵團 塔里木盆地生物資源保護利用重點實驗室,新疆 阿拉爾 843300)
棗(ZiziphusjujubeMill.)為鼠李科(Rhamnaceae)棗屬(ZiziphusMill)植物[1]。棗樹是我國第一大干果樹種,具有很強的適應性,在平川、山地、丘陵均能種植,在我國的栽培大致分布在北緯23.0°~42.5°與東經76°~124°區間內,除吉林、黑龍江、西藏、青海外,其他地區均有栽培[2]。得天獨厚的水土光熱氣候等自然資源,造就了新疆紅棗卓越的品質,新疆的紅棗產量超過全國的1/4[3],已經成為新興棗產區。新疆紅棗價格最高時達到50~60元/kg;受紅棗價格暴漲的影響,棗農迫切追求產量效益,忽視果品品質,造成了紅棗產業的不健康發展[4]。優化果實糖酸比、提升品質是提高紅棗生產效益和經濟效益的關鍵因素,也成為近年來學者們關注的重點。在果實發育過程中,糖含量和糖代謝相關酶活性的變化特點及相互間的關系已較為明確[5-9]。隨著分子生物技術的發展,國內外有關蘋果、梨[11-12]、桃[13]、柑橘[14]的分子生物學研究已十分廣泛,例如:楊靜靜[10]利用農桿菌介導法轉化‘嘎啦’蘋果,經分子和酶活性鑒定,獲得了3個MdFRK2基因過表達的陽性轉基因植株;李馨玥等[12]分析了不同基因在‘南果梨’果實發育過程中的表達變化,以及在蔗糖轉運以及糖的積累和代謝過程中的功能;張春華等[13]利用熒光定量PCR測定了6個蔗糖合成酶基因的表達水平,結果表明PpSus3在果實和韌皮部,以及PpSus1在葉片中對糖類代謝可能具有更重要的作用。然而在棗上的研究始終落后于其他大宗果樹。我們選取新疆南疆地區的主栽紅棗品種為試驗材料,通過高效液相色譜法和實時熒光定量PCR法對棗果實發育過程中糖組分含量的變化以及糖代謝關鍵基因的表達趨勢進行了研究,以期從分子生物學角度明確棗果實的糖代謝及其調控機理,為今后棗樹的分子育種和遺傳改良奠定基礎。
1 材料與方法
1.1 試驗地概況
供試紅棗材料采自塔里木大學棗種植資源圃,該資源圃地處北緯40°32′、東經81°17′,屬暖溫帶大陸干旱荒漠氣候區,年均氣溫≥10 ℃,年積溫為4113 ℃·d,無霜期220 d,年均日照時數2900 h,年均降水量為40.1~82.5 mm;土壤為輕鹽化土。
1.2 供試材料
試驗材料選自資源圃保存的駿棗、灰棗與冬棗品種(圖1)。選擇樹體生長水平良好、樹勢一致的單株各3株作為樣本樹。自棗果實發育膨大期(8月13日)至完熟期(10月2日),每隔10 d,采取果實樣本1次。采果時從每株樹的不同方向選取大小一致的30個棗果,放入采樣盒中,立即帶回實驗室,洗凈后去核切碎,同時分成兩等份,經液氮速凍后,放于-80 ℃冰箱中保存,分別用于糖組分含量、相關基因表達的測定。

圖1 駿棗、灰棗和冬棗在不同時期的果實
1.3 試驗方法
1.3.1 糖組分含量的測定 采用高效液相色譜法[15]進行測定。樣品制備:精確稱取1.0000 g棗樣,充分研磨后加入10 mL的80%乙醇混勻,于80 ℃水浴加熱30 min,待冷涼至室溫后以4000 r/min轉速離心10 min;然后取上清液,殘渣繼續用80 ℃的乙醇重復提取;合并濾液,旋轉蒸發除去其中乙醇,用超純水定容至25 mL容量瓶中,過0.45 μm微孔濾膜,待測。高效液相色譜儀1260由美國Agilent公司生產。液相色譜條件:色譜柱Waters XBridgeTM Amide (250 mm×4.6 mm,5 μm);將溶液A[0.2%三乙胺(TEA)的超純水溶液]和溶液B (0.2%TEA和乙腈)按照24∶76的體積比混合作為流動相;柱溫為30 ℃;霧化管溫度為60 ℃;漂移管溫度為60 ℃;氣流量為1.6 L/min;增益值為1.0。標準曲線建立:將糖混合標準溶液用超純水逐級稀釋,配制成0.1、0.2、0.4、0.6、0.8、1.0 mg/mL等6個不同濃度的標準液,過0.45 μm微孔濾膜,依次進樣10 μL,以糖濃度(X)作為橫坐標,峰面積(Y)作為縱坐標,制作標準曲線,建立回歸方程(表1),相關系數為0.9986~0.9997。

表1 糖組分測定的回歸方程及其相關系數
1.3.2 Q-PCR分析糖代謝相關基因的表達 采用生工生物工程(上海)股份有限公司生產的B518661柱式植物總RNA抽提純化試劑盒,按說明書對駿棗、灰棗和冬棗發育過程中果實的RNA進行提取。使用南京諾唯贊生物科技有限公司生產的R312-01/02試劑盒HiScript III 1st Strand cDNA Synthesis Kit(+gDNA wiper)進行反轉錄得到cDNA。以UBQ作為內參基因[16],表2 為內參基因和目的基因的引物序列,由生工生物公司合成特異性引物。以合成的cDNA為模板進行PCR反應,反應體系10 μL:cDNA模板0.5 μL、左右引物各0.2 μL、PowerUpTMSYBRTMGreen Master Mix 5 μL、ddH2O 4.1 μL。在QuantStudioTM5 System熒光定量PCR儀上進行熒光定量表達分析,采用2-ΔΔCT方法進行數據分析。

表2 qRT-PCR的引物序列
1.4 統計分析
應用Excel 2010和DPS 7.55軟件對試驗數據進行統計整理和方差分析;采用QuantStudio Design & Analysis Software軟件對相關基因的表達量進行分析。
2 結果與分析
2.1 棗果實發育過程中糖組分含量的變化
圖2顯示了駿棗、灰棗和冬棗果實在發育過程中糖組分含量的變化。在這3個主栽品種中,蔗糖含量的變化均表現為前期低、后期高。在8月13日和8月23日,蔗糖含量明顯低于果糖和葡萄糖含量;自9月2日起,蔗糖含量均高于果糖和葡萄糖含量,且隨著果實的成熟而逐漸上升,在每隔10 d的含量之間都存在極顯著性差異,到10月2日時,駿棗、灰棗、冬棗的蔗糖含量分別達到490.96、507.28、443.06 mg/g。在棗果實的發育過程中,果糖和葡萄糖的含量始終保持在較為接近的水平,但不同品種的變化趨勢不盡相同。駿棗果實在發育過程中,果糖和葡萄糖的含量在9月22日最高,分別為102.91和100.29 mg/g。在灰棗中,果糖和葡萄糖的含量在10月2日最高,分別達到107.28和109.18 mg/g。冬棗中的葡萄糖和果糖含量在9月2日最高,分別為57.80和51.53 mg/g。
2.2 棗果實發育過程中糖代謝相關基因表達水平的變化
對棗果實中12個糖代謝相關基因的表達量進行檢測,包括5個蔗糖合成關鍵基因(ZjSPS1~2、ZjSS1~3)、2個轉化酶類基因(ZjvINV1~2)、2個己糖基因(ZjHK3、ZjHK6)、3個糖轉運蛋白基因(SUC2~3、SWEET2)。以各品種果實中各基因在8月13日的表達水平為參照做相對分析。
圖3顯示的是蔗糖合成關鍵基因(ZjSPS1、ZjSPSP2、ZjSS1、ZjSS2、ZjSS3)在駿棗、灰棗及冬棗的果實發育過程中表達量的變化。ZjSPS1和ZjSS2在3個主栽品種果實發育過程中表達量的變化趨勢大致相同,都在9月12日最高,之后下降,在10月2日又有所上升。ZjSPSP2、ZjSS1、ZjSS3的表達量在不同品種中呈現不同的變化趨勢。在駿棗果實的發育過程中,9月2日ZjSPSP2、ZjSS1、ZjSS3的表達量極低;9月22日ZjSPSP2的表達量極低,ZjSS3的表達量達到最高;ZjSPSP2和ZjSS1的表達量在10月2日達到最高。ZjSS1在灰棗果實發育過程中的表達量始終較低,在9月2日最高;ZjSPSP2和ZjSS3在灰棗中的表達量在9月12日達到最高,之后逐漸降低。在冬棗中,ZjSPSP2在9月12日的表達量最高,在10月2日次之;ZjSS1在9月22日的表達量最高,在8月23日次之;ZjSS3的表達量始終處在較低水平,以10月2日最低。
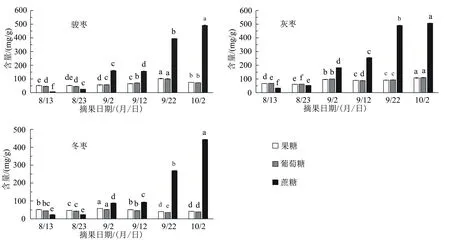
圖2 駿棗、灰棗和冬棗果實中糖組分含量的變化
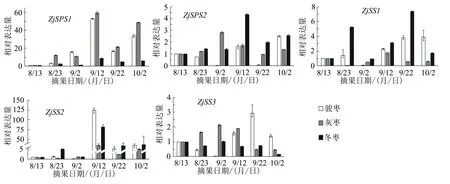
圖3 棗果實發育過程中ZjSPS1、ZjSPS2、ZjSS1、ZjSS2、ZjSS3基因的表達量
如圖4所示,轉化酶基因(ZjvINV1、ZjvINV2)在3個主栽品種的果實發育初期(8月13日)表達量較高,在其他日期的表達量大都顯著低于8月13日的表達量,僅駿棗果實中ZjvINV1在9月2日的表達量略高于8月13日的。己糖激酶基因(ZjHK3、ZjHK6)的表達量在3個主栽品種果實發育期間都表現為前期上升,后期下降之后再上升,其中駿棗和冬棗果實中ZjHK3和ZjHK6在不同時期的表達量差異波動明顯,而灰棗果實中ZjHK3和ZjHK6的表達量在一個較為接近的水平中變化。
從圖4還可以看出,本試驗檢測的糖轉運蛋白基因(ZjSUC2、ZjSUC3、ZjSWEET2)的表達量在不同品種中呈現出各不相同的變化趨勢。ZjSUC2在駿棗果實中9月22日至10月2日期間表達量顯著升高,在灰棗果實中9月2日至9月12日期間上升最為明顯,在冬棗果實中8月13日至8月23日期間出現明顯上升,后期大致穩定。駿棗和灰棗中ZjSUC3的表達量均在9月12日最高,在9月22日最低;冬棗中ZjSUC3的表達量在8月23日最高,在中期趨于穩定,在10月2日最低。ZjSWEET2在駿棗整個發育期間的表達量都極低,在灰棗和冬棗果實發育前期的表達水平低,在9月22日幾乎不表達,但在9月22日至10月2日期間的表達量上升,在10月2日的表達量達到最高。
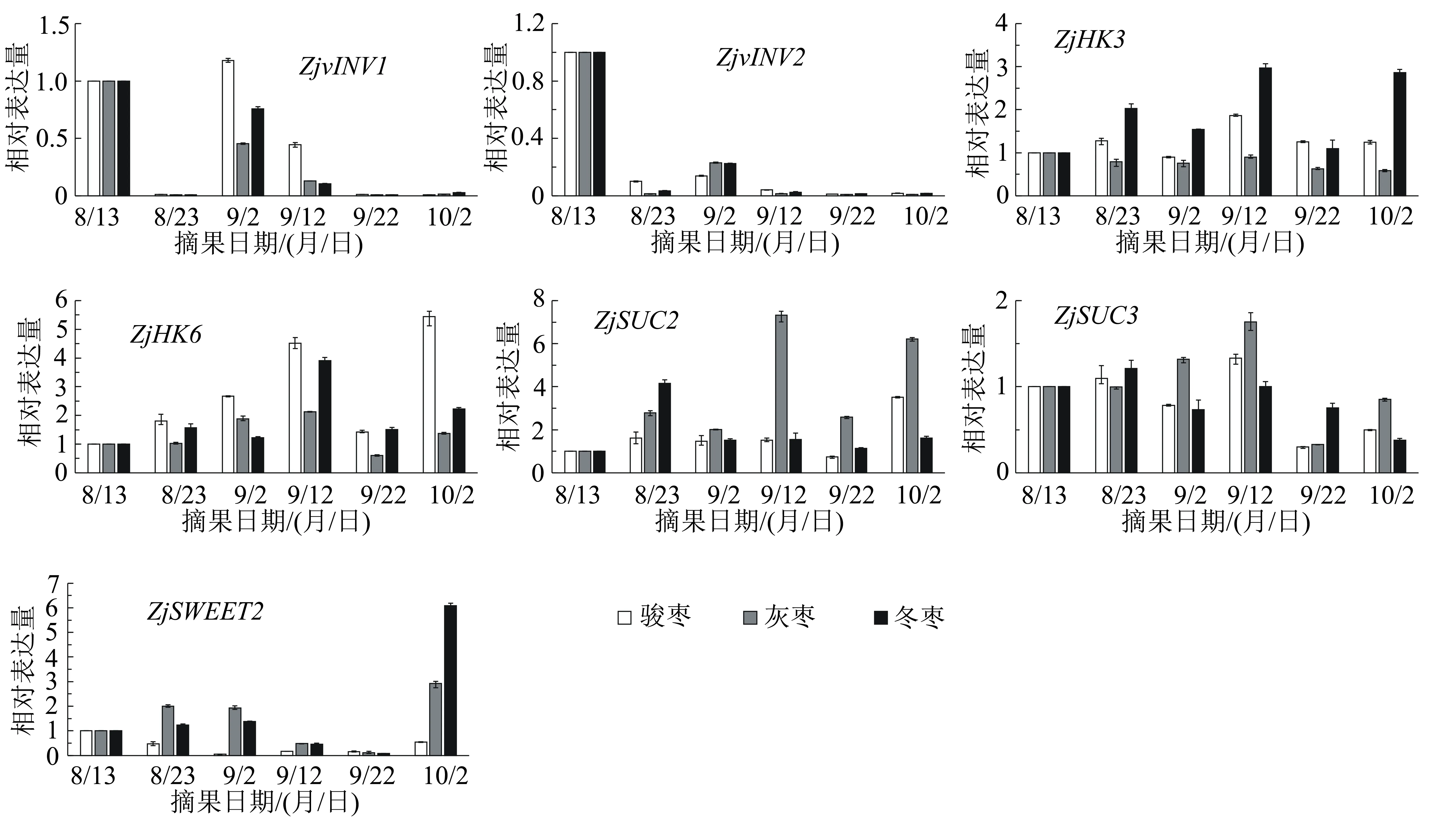
圖4 棗果實發育過程中ZjvINV1、ZjvINV2、ZjHK3、ZjHK6、SUC2、SUC3、SWEET2基因的表達量
2.3 糖組分含量與相關基因表達量間的相關性分析
圖5是3個主栽品種棗果實的糖組分含量與糖代謝相關基因的表達量做相關性分析的熱圖結果。果糖含量、葡萄糖含量與ZjSPS1的表達量呈極顯著正相關,與ZjSS3的表達量呈顯著正相關,與ZjHK3的表達量呈顯著負相關;果糖含量還與ZjSUC2的表達量呈顯著正相關。蔗糖含量與ZjSPS1的表達量呈顯著正相關,與ZjvINV1、ZjvINV2和ZjSUC3的表達量呈顯著負相關。
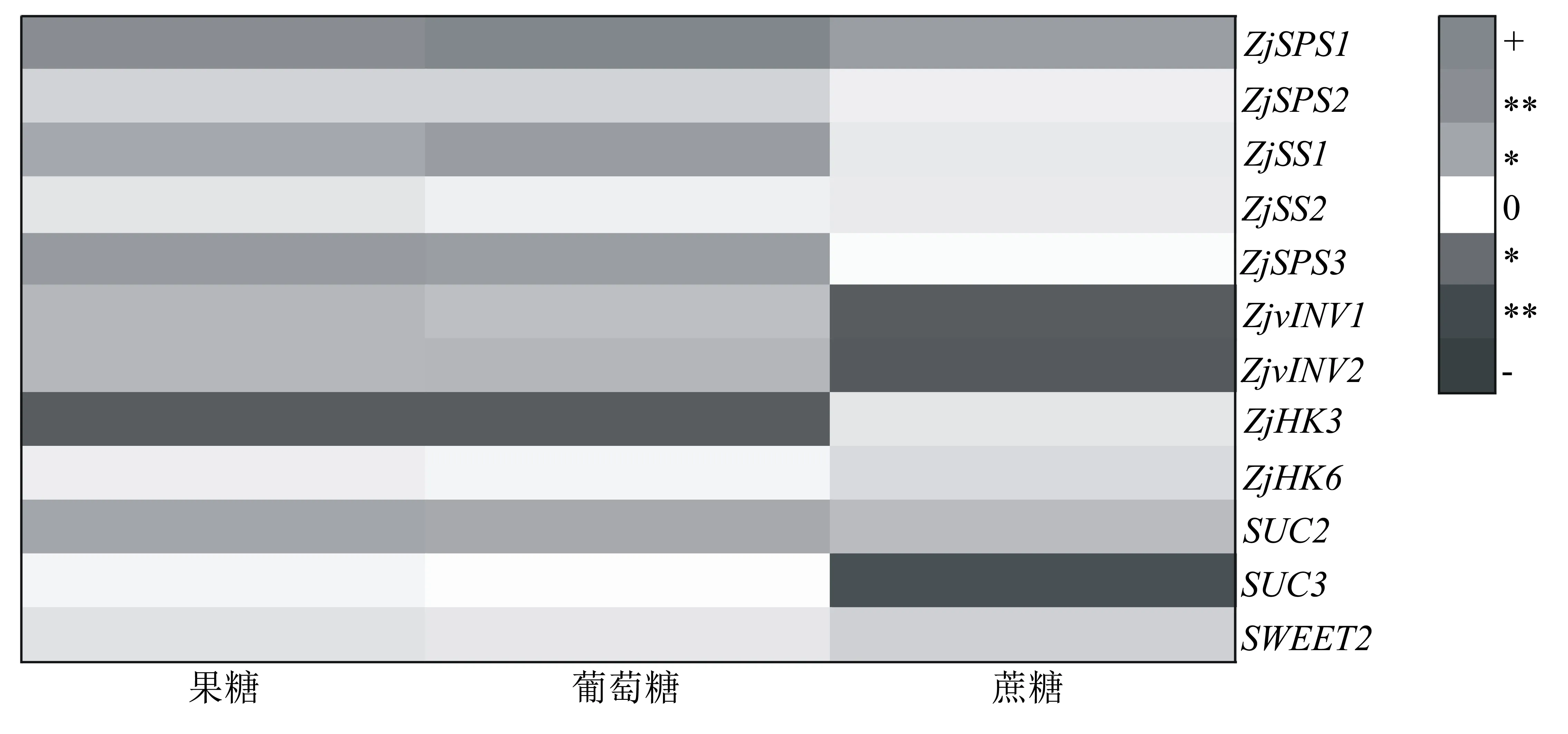
“+”和“-”分別表示正相關和負相關;“*”和“**”分別表示顯著相關(P<0.05)和極顯著相關(P<0.01)。
3 討論與結論
棗果實在發育時,碳水化合物輸入果實后,僅少量以淀粉的形式積累,大部分以可溶性糖的形式貯存于果實中,是典型的糖積累型果實[17]。根據成熟時糖組分的比例,可以將糖積累型果實又分為還原糖積累型、中間型、蔗糖積累型3種類型[18]。大多數研究學者已明確駿棗、灰棗和冬棗皆屬于蔗糖積累型果實[19-20]。在本試驗中,駿棗、灰棗和冬棗果實在發育前期以還原糖積累為主,在后期蔗糖含量逐漸上升,還原糖含量略微下降,至果實成熟時,蔗糖含量顯著高于還原糖含量,符合蔗糖積累型果實糖組分含量的變化規律。糖代謝關鍵酶主要包括蔗糖合成酶類:蔗糖磷酸合酶(SPS)和蔗糖合酶(SS),轉化酶類(INV)及單糖降解酶類(己糖激酶)[21]。蔣爽等[22]的研究結果表明,SPS1和SPS2在梨果實糖合成中起關鍵作用。本試驗結果表明,在駿棗果實發育過程中,ZjSPS1和ZjSS2在果實發育后期呈現特異高表達趨勢,說明ZjSPS1和ZjSS2在駿棗果實蔗糖積累過程中的調控作用較強;SWEET2在8月13日之后的表達水平始終明顯低于8月13日的,這可能是果實中其他糖組分含量低的重要原因。在灰棗中,ZjSPS1自8月23日起的表達量極顯著高于8月13日的,表明ZjSPS1是灰棗果實蔗糖積累過程中的主要調控基因;ZjSS2在9月12日時特異高表達,9月12日灰棗果實中的蔗糖含量開始顯著高于還原糖含量,ZjSS2可能在這其中起到關鍵作用;ZjHK6的表達量呈前期上升、后期下降的趨勢。張春梅[16]認為ZjHK3和ZjHK6可將葡萄糖轉化為6-磷酸-葡萄糖,進而分解為磷酸烯醇丙酮酸,為酸代謝提供底物;還有學者發現ZjSUC在棗果可溶性糖積累尤其是在蔗糖積累過程中發揮了重要的作用[23]。本試驗發現,ZjSUC2在灰棗各時期的表達量均高于8月13日的,且在其表達量明顯上升時蔗糖含量也顯著升高,因此推測ZjSUC2在灰棗果實蔗糖積累中起重要作用。在冬棗中,ZjSPS1和ZjSPS2表達量的變化趨勢基本一致,均為前期低、后期高;ZjSS1在冬棗果實發育初期的表達量即出現顯著性上升,而ZjSS2在果實發育后期出現特異性高表達,說明ZjSPS1、ZjSPS2、ZjSS1和ZjSS2共同調控冬棗的蔗糖積累過程,且ZjSS2可能具有較強的調控能力;ZjSWEET2在冬棗成熟期表達量顯著上升,這可能是成熟期冬棗口感脆甜的主要原因。張春梅[16]對棗和酸棗的研究顯示,ZjvINV1和ZjvINV2在酸棗中的表達量較高,而在棗中的表達量極低。本試驗基因表達分析的結果顯示,ZjvINV1和ZjvINV2在3個品種的果實發育期間幾乎不表達,推測ZjvINV1和ZjvINV2在棗果實中的低表達是果實還原糖含量低于蔗糖含量的重要原因。果實糖組分含量的變化與各基因表達量變化的相關性分析結果表明:在棗果實發育過程中,ZjSPS1對蔗糖和還原糖的積累都具有一定的調控作用,與還原糖的積累相關性更強;ZjSS3和ZjSUC2的表達促進了棗果實中還原糖的積累;ZjHK3的表達在還原糖的積累中起抑制作用;ZjvINV1、ZjvINV2和ZjSUC3的低表達在一定程度上促進了蔗糖的積累。
綜上所述,本研究得出結論,在相同的糖積累類型品種中,棗果實糖組分含量在果實發育過程中的變化規律大致相同,但不同品種中各基因表達量的變化趨勢存在一定的差異,其中ZjSPS1和ZjSS2在駿棗果實糖積累過程中起到重要調控作用;ZjSPS1、ZjSS2、ZjHK6、ZjSUC2在灰棗果實的蔗糖積累中起重要作用;ZjSPS1、ZjSPS2、ZjSS1和ZjSS2共同調控冬棗的蔗糖積累過程。本研究初步分析了不同基因在駿棗、灰棗及冬棗果實發育過程中的表達變化,但不同基因在棗果實蔗糖轉運以及糖積累和代謝過程中的具體功能還需進一步研究。

