解剖程序化后腹腔鏡下保留腎單位手術治療局限性腎癌近期效果研究
劉光華 崔光明
河南周口永興醫院泌尿外科 太康 461400
腎細胞癌(renalcellcarcinoma,RCC)簡稱腎癌,是臨床常見的泌尿系統疾病,而局限性RCC為癌細胞尚未侵入鄰近器官及腎周圍組織,亦未發生遠處轉移,僅局限于腎實質內的RCC[1]。目前,臨床對于局限性RCC主要采用根治性腎切除術,但對于雙側RCC、孤立腎RCC、對側腎功能衰退患者,該術式存在一定局限性[2]。近年來,后腹腔鏡下根治性腎切除術(radicalnephrectomy,RN)已逐漸應用于局限性RCC患者的治療中,但術中因阻斷腎動靜脈造成熱缺血,可對腎臟造成一定損傷[3]。解剖程序化后腹腔鏡下保留腎單位手術(nephronsparingsurgery,NSS)具有保留殘腎腎功能的顯著優勢[5]。本研究通過對74例行后腹腔鏡手術的局限性RCC患者的臨床資料進行分析,以探討解剖程序化NSS的治療效果。
1 資料與方法
1.1一般資料回顧性分析2018-02—2020-02間我院收治的74例局限性RCC患者的臨床資料。納入標準:(1)均依據臨床表現和超聲、CT等影像學檢查確診,并符合RN及NSS術的指征[4]。(2)均順利完成后腹腔鏡手術,并經術后病理學檢查結果證實。排除標準:(1)凝血功能障礙、心肝腎功能不全,以及難以耐受手術的患者。(2)臨床及隨訪資料不全的患者。根據不同手術方案分為RN組和NSS組,各37例。2組患者的基線資料差異無統計學意義(P>0.05),見表1。患者均簽署知情同意書。
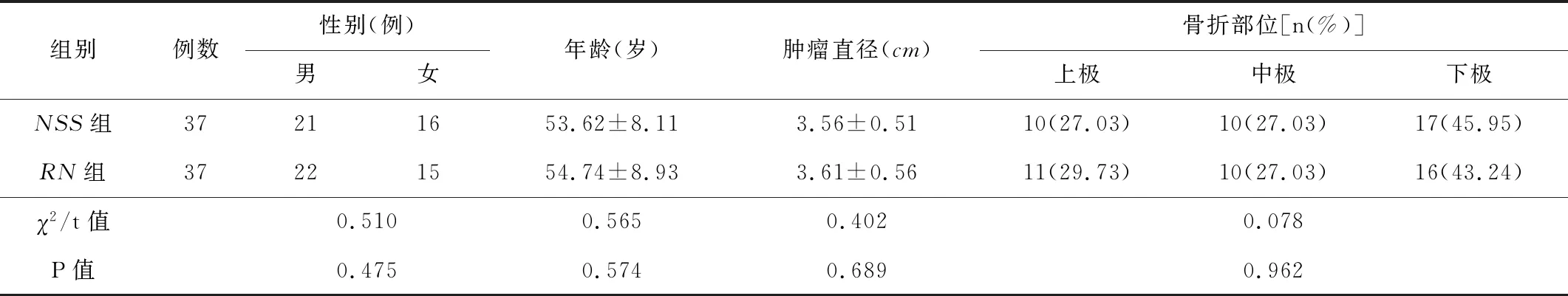
表1 2組患者的基線資料比較
1.2方法全麻,健側腰部墊高臥位,常規消毒、鋪巾。取患側第12肋下緣2cm骶棘肌外側的1.5~2.0cm橫切口,建立腰背筋膜下與腹膜后脂肪間隙。放置12mmTrocar和腹腔鏡。依次于腋前線肋緣下、腋后線12肋緣下各置入一枚5mmTrocar,建立CO2腹膜后脂肪間隙,維持氣壓13mmHg(1mmHg=0.133kPa)。NSS組:游離并切除部分腹膜后脂肪,將Gerota筋膜縱行切開,明確病灶精確位置后,將病灶組織周圍脂肪組織切除,“哈巴狗鉗”阻斷腎動脈,沿病灶邊緣1cm左右處將腎被膜剪開,切除病灶及其周圍約1cm正常腎實質,可吸收線“8”字縫合創面止血。腎周放置引流管,縫合切口。RN組:在腎周脂肪囊內側分別游離、顯露腎動、靜脈和輸尿管。以Home-lock夾夾閉后用超聲刀切斷。創面止血,留置引流管,縫合各切口。術后2組均常規抗感染治療。
1.3觀察指標(1)術中出血量及術后腸胃功能恢復時間和住院時間。(2)術前及術后1個月、3個月采集晨新鮮血液樣本3mL,離心取清液,利用DXC全自動生化分析儀,以谷丙轉氨酶檢測法測定血清肌酐(Scr)水平。(3)隨訪6個月的結果。
2 結果
2.1手術相關指標NSS組術中出血較RN組低,腸胃功能恢復及術后住院時間較RN組短,差異有統計學意義(P<0.05)。見表2。

表2 2組手術相關指標比較
2.2血清Scr水平及隨訪結果術后1個月、3個月時,2組患者的血清Scr水平均高于術前,其中NSS組的血清Scr水平低于RN組,差異有統計學意義(P<0.05)。見表3。術后隨訪6個月,2組均無瘤生存,未出現復發、轉移及死亡事件。

表3 2組手術前后血清Scr水平比較
3 討論
據統計,發源于腎上皮的腫瘤約占全身實體腫瘤的3%,其中最為常見的是RCC,占腎上皮腫瘤的80%~90%,而且發病率呈逐漸上升趨勢[6]。在我國,RCC的男女發病比率為1.83∶1,而城市發病率明顯高于農村地區[7]。近年來,隨影像學技術不斷進步與發展,尤其是CT掃描普遍應用于及健康體查和腎臟疾病的篩查,越來越多的無癥狀RCC患者被早期發現和診斷,且多數為局限性RCC[8]。目前RN術依然是治療局限性RCC的主要微創術式,其中解剖程序化NSS術憑其可最大限度保護腎功能的優勢已受到臨床廣泛關注[9]。
解剖程序化NSS術中腫瘤切緣陽性會降低手術效果。多數學者認為,病灶切緣距離與腫瘤擴散、進展及生存率無相關性,只要確保切緣陰性,病灶切緣距離1~2mm就可實現完全局限性切除[10-11]。此外,解剖程序化NSS中,腹腔鏡的清晰放大圖像可協助術者準確識別腫瘤組織,對于精準保留腎單位腎部分切除具有重要價值;同時術中對腎血流進行阻斷,不僅可降低切面出血量,更能確保腔鏡下術野清晰。在腎血管阻斷下,腎體積減小,變軟,有助于切面縫合。且利用“哈巴狗鉗”對腎動脈進行單純阻斷,可有效減少腎靜脈損傷,并進一步減少術中出血量和加快患者術后恢復[12]。
收集近年來我院收治的74例局限性RCC患者,通過對其臨床資料進行回顧性分析,結果顯示,行解剖程序化NSS術患者的術中出血量,以及術后腸胃功能恢復時間、住院時間和術后1個月、3個月的血清Scr水平等指標,均顯著優于行RN術的患者,近期效果滿意。但其遠期效果有待長期隨機對照研究進一步證實。

