紫萼組織培養技術
高燕,奉樹成
(上海植物園 上海城市植物資源開發應用工程技術研究中心,上海 200231)
紫萼(Hostaventricosa)是百合科玉簪屬植物,為我國原產玉簪屬4個品種之一[1]。紫萼葉叢生有光澤,卵形至卵圓形。花葶高60~100 cm,花紫色,花期6—7月,觀賞期長,耐寒、耐旱,對土壤要求不高,適應性強,管理粗放,是一種優異的耐陰宿根草本。園林中常用于林下地被,或與周邊建筑山石搭配成景,也可用于盆栽、切花、切葉等[2-5]。除了園林觀賞應用價值外,紫萼還具有藥用價值,紫萼的嫩葉和嫩芽可食用。因此,紫萼極具開發價值。由于紫萼玉簪野生種較少,童齡期長,從播種到開花需3年以上時間[3]。紫萼是玉簪屬中唯一的天然4倍體,存在不完全無配生殖現象,母本不能產生雜種后代,種子不育[6]。研究紫萼的組織培養快繁技術,可以保證紫萼性狀的穩定性,也為紫萼的推廣提供技術支撐。
1 材料與方法
1.1 材料
試驗于2018—2020年在上海植物園實施,材料取自上海植物園玉簪資源圃。試驗以紫萼幼嫩花序部分為材料。取材后,將材料截取為2~4 cm的小段待用。
1.2 方法
取紫萼幼嫩花序部位,用洗潔精浸泡30 min,流水沖洗30 min。前期準備75%酒精和2%次氯酸鈉溶液,滅菌ddH2O、三角瓶、鑷子、手術刀和濾紙待用。
1.2.1 滅菌
試驗工作均在滅菌后的超凈工作臺上實施。外植體放置于無菌三角瓶中,先用無菌水震蕩清洗1次,再用75%酒精震蕩清洗30 s,無菌水沖洗2次。隨后用2%次氯酸鈉溶液消毒外植體,消毒時間設置情況如表1所示。外植體消毒后用無菌水沖洗5次,再用濾紙吸干水分后接種于培養基上。根據污染情況和芽的誘導情況選擇最佳滅菌方法。
1.2.2 誘導
以MS為基本培養基,設置激素梯度。激素采用6-BA和NAA兩種激素組合促進不定芽誘導,激素組合方式如表2所示。根據誘導狀態和誘導率決定最佳誘導方法。
1.2.3 增殖
以MS為基本培養基,添加不同濃度的細胞分裂素6-BA、生長素2,4-D和NAA,組合情況如表3所示,形成增殖培養基。經過25 d的生長,比較生長狀態和增殖率,確定最佳增殖培養基。
1.2.4 生根
以1/2 MS為基本培養基添加不同激素,激素采用IBA和ABT兩種,濃度情況如表4所示。經過30 d生根培養,對比根的發育狀態、生根率、根長等情況,確定最佳生根培養基。
1.2.5 煉苗
室溫下打開瓶蓋放置3 d后,用流水清洗組培苗附著的培養基,整理根并種植于營養缽中,觀察苗的生長狀態。
2 結果與分析
2.1 滅菌
本試驗采用2%次氯酸鈉溶液進行滅菌,滅菌時間如表1所示,分別為7、14和21 min,對應的污染率和出芽率呈現不同的變化。從污染率看出A1污染率較高,A2和A3之間沒有顯著差異,相比較A2可以達到比較好的滅菌效果。從出芽率看,A2出芽率最高為44.4%,與其他2組有顯著差異。綜合考慮,以2%次氯酸鈉溶液滅菌14 min為最優的紫萼滅菌時間。

表1 不同滅菌時間對紫萼污染率和出芽率的影響
2.2 誘導
以MS為基本培養基添加不同濃度細胞分裂素6-BA和生長素NAA,細胞分裂素6-BA濃度在2~6 mg·L-1,生長素NAA濃度在0~0.5 mg·L-1,如表2所示。6-BA為2 mg·L-1時,誘導率較低,且芽生長停滯或緩慢;6-BA為4 mg·L-1時,誘導率相比較有增長,其中NAA為0.2 mg·L-1時,誘導率達到最高為46.3%,誘導出芽生長迅速,芽生長正常,展葉健康;6-BA濃度再增加后,起始材料與培養基接觸部位開始出現綠色愈傷,極個別芽小而畸形,誘導率也隨之下降。因此,最優誘導配方為B5。
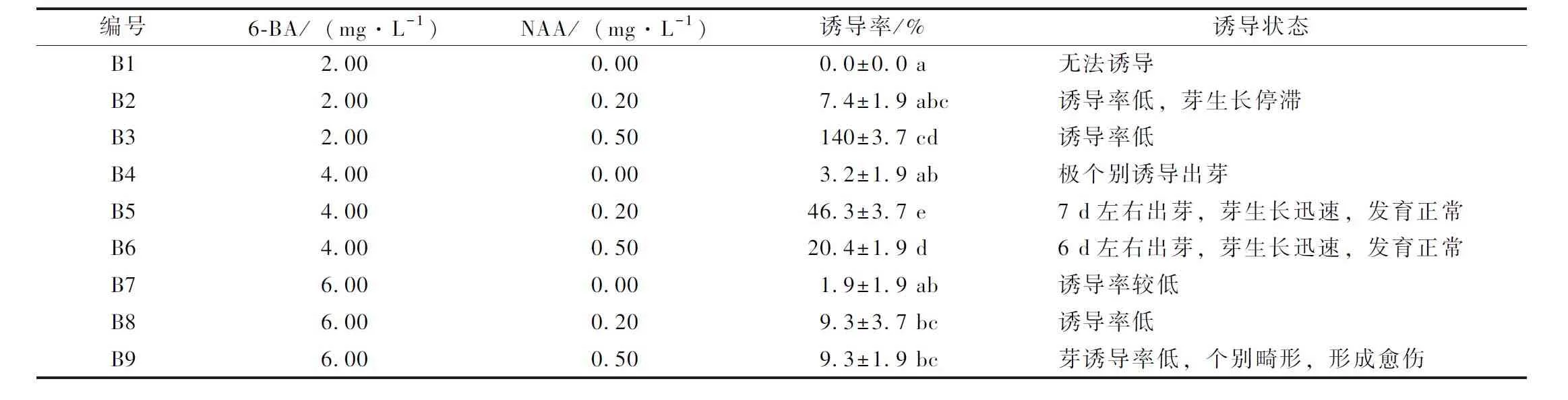
表2 不同激素含量對紫萼誘導的影響
2.3 增殖
誘導30 d后,將誘導出的健康芽轉至增殖培養基。增殖培養基采用MS培養基添加6-BA 0.5~4 mg·L-1,生長素NAA 0~0.5 mg·L-1,2,4-D 0~0.5 mg·L-1。采用L9(34)正交試驗,試驗結果如表3所示。

表3 不同激素含量對紫萼芽增殖的影響
從伸長倍率來看,C4和C9的伸長倍率值最高,均為3.5,沒有顯著差異。從增殖倍率考慮,C6增殖倍率最高為6.0,其次為C9,增殖倍率為3.9。結合生長狀況觀察,C4植株生長正常,葉片寬大,無畸形,但增殖速度很慢。C6增殖速度快,但植株幾乎不伸長,葉片細弱,展葉不明顯,部分基部開始出現玻璃化情況。C9葉片增殖速度較快,伸長倍速較高,生長正常,葉片寬大,無畸形(圖1)。因此,C9為增殖最優培養基。

圖1 C9培養基上增殖22 d情況
2.4 生根
將健康植株從增殖培養基轉移至生根培養基。生根培養以1/2 MS為基本培養基添加ABT或IBA,觀察生根情況(圖2)。

圖2 D6培養基上生根20 d情況
生根情況如表4所示,添加IBA或ABT均可誘導生根,但生根率有較大差異。與ABT相比較,ABT生根率明顯低,且根粗短,葉片略黃,相比而言ABT更適合紫萼生根。ABT濃度為0.5 mg·L-1時紫萼狀態為佳,經過30 d的培養,葉片濃綠,生根數量4~6根,長度2~9 cm,根粗壯,整體植株形態正常。

表4 不同激素含量對紫萼生根的影響
2.5 煉苗
組培苗經過1個月的生根培養形成健壯根后,可進行煉苗(圖3)。穴盤中裝入適量基質,基質采用園土∶泥炭∶珍珠巖為1∶3∶1(體積比)。

圖3 紫萼煉苗20 d生長情況
打開瓶蓋,將紫萼放在培養間3 d,取出后用流水沖洗干凈培養基,種植于基質中,用多菌靈澆透,放置于大棚,溫度20~30 ℃,濕度85%左右。每15 d左右用多菌靈澆透一次。生長2個月,成活率可達到97%以上。
2.6 育苗技術培養
紫萼作為典型的陰生植物,要求土壤排水良好,土層深厚。種植地點宜選擇涼爽通風的陰濕環境,例如樹下、建筑物背陰處[4]。紫萼經過2個月的煉苗,形成根系優良、展葉完全的完整植株后,可移入林下或背陰處排水良好的土壤中露地種植。挖穴深度4~10 cm,保證根不外露、深不埋心,覆土與地面平齊即可,栽植后澆透水使土壤與根系充分接觸。地栽時可按薄肥勤施的原則添加有機肥或者少量磷肥,促進生長。
3 小結與討論
1976年已經有關于玉簪屬種和品種的離體培養研究。至今對不同的玉簪屬種和品種分別從外植體、再生方式等方面進行組織培養的研究,外植體包括莖尖、花序、花器、花序切片、花瓣、子房、花葶組織等,再生方式包括不定苗、多芽苗等[7-9]。李玲等[1]以野生紫萼玉簪葉片為外植體,通過愈傷組織誘導不定芽形成完整植株。蔣素華等[4]以紫萼幼苗為外植體,通過愈傷組織誘導不定芽建立再生體系。陳必勝等[10]以玉簪基部幼芽為外植體進行組織培養研究,發現冬芽優于春芽。Lubomski[11]的研究成果表明,再生能力最強的是莖尖、花蕾和葉柄較低部位。本試驗取紫萼幼嫩花序為起始材料。
植物組織培養中使用較多的滅菌消毒劑包括乙醇、升汞、次氯酸鈉等溶液,有時候適量添加吐溫增加滲透性提高滅菌效率[12]。本試驗采用75%乙醇滅菌30 s和2%次氯酸鈉溶液滅菌14 min相結合的方法,污染率降為2.73%,出芽率為44.44%。次氯酸鈉溶液滅菌時間再延長后,出芽率大幅度降低,可能對外植體產生毒害作用從而導致誘導率下降。滅菌后多次用滅菌水對外植體反復漂洗,可以減少殘留次氯酸鈉溶液對外植體的傷害。
MS是植物組織培養中最常用的基本培養基之一,玉簪的組織培養方法中最常用的即MS培養基,MS培養基中的大量元素和微量元素提供了植物生長所必需的無機鹽,有機元素和蔗糖提供植物生長所需的碳源、氮源、礦質營養和維生素,對植物細胞和組織增殖和分化起促進作用。本試驗以MS為基本培養基,可誘導、增殖并生根,形成完整植株。
激素在植物組織培養中起到至關重要的作用,在不同的步驟以基本培養基添加不同激素可達到培養目的。紫萼誘導過程中,添加6-BA 4 mg·L-1和NAA 0.2 mg·L-1可以達到較好的誘導效果,誘導率為46.3%,芽發育正常,沒有畸形或玻璃化等現象,且能夠在后期持續發育和分化。在獲得健康的不定芽后,通過MS基本培養基添加6-BA 4 mg·L-1、NAA 0.5 mg·L-1和2,4-D 0.25 mg·L-1激素共同作用,可以達到較好的增殖效果,在該激素配比下,紫萼伸長率為3.5,增殖率為3.9,芽體保持正常發育,未出現畸形或玻璃化等現象,并在隨后的1年多的繼代周期保持高速的增殖效率,為較適合的增殖培養基。生根培養中,以1/2 MS為基本培養基添加ABT更有利于生根和植株生長,平均每株形成4~6根,根長2~9 cm,生根率可達到98.0%,是適合紫萼生根的培養基。
紫萼經過1個月的生根培養后形成完整植株,可以用于煉苗。在適合的溫度和濕度條件下,基質采用園土、泥炭和珍珠巖混合,成活率在97%以上。園土黏重,添加泥炭后,增加土壤通氣性,改善酸堿度,提高土壤肥力。添加珍珠巖可以增加土壤透氣性,改善土壤保水能力和通氣條件[13],減少土壤板結,降低紫萼在生長過程中出現爛根現象。珍珠巖有利于移栽成活,但不利于后期葉片和根系生長,泥炭促進移栽成活和葉片生長,園土不利于初期生根和葉片生長,但有利于后期植物生長[14]。因此,采用3種基質的混合可促進移栽成活和后期生長。培養2個月后,可移栽至陰涼的地方露地栽培。在玉簪生長過程中可以施加葉面肥促進葉片生長,也可以在露地栽植前添加基肥,一般是腐熟有機肥6~7 kg·m-2。生長過程中以薄肥勤施、少量多次、營養齊全為原則[15]。

