姜黃在理血方劑中的配伍規律及系統藥理機制分析
劉志強,楊尚玉,王博龍
1鶴壁職業技術學院 鶴壁市天然藥物研究與開發重點實驗室,鶴壁 458030;2宜春學院化學與生物工程學院,宜春 336000
中藥姜黃為姜科植物姜黃CurcumalongaL.的干燥根莖,其氣香特異,味苦、辛,歸脾、肝經,有破血行氣,通經止痛之功效[1]。姜黃以中藥配伍于方劑,始自《太平惠民和劑局方》的五痹湯,以其理血止痛等效用,治療風寒濕邪、客留肌膚等證[2]。后代醫家多以姜黃為理血藥用治于內科痹痛、婦科、骨傷、雜癥等領域。此外,姜黃在伊朗、印度、泰國等地也常做為民族藥材或保健食品,用以治療皮膚病、感染、精神疾病等[3]。鑒于姜黃能對多種疾病產生治療作用,近年來,國內外不少學者為研究姜黃的分子藥理機制做出了不懈努力。Eleonora等[4]綜述了姜黃的現代藥理機制,發現其具有改善代謝紊亂、改善慢性疾病、調節機能、抗氧化、保健等作用。Deguchi等[5]發現姜黃及其主要功效成分姜黃素安全性高,能介導多個靶點與多條通路發揮抗炎、抗腫瘤等作用。中國對姜黃的藥理作用研究多集中在其抗腫瘤、抗炎、降血糖及對心血管系統的影響[6]。
盡管當前研究揭示了姜黃的許多藥理機制,但多局限于對姜黃單一藥材或其成分的研究,鮮有對其配伍規律、復方協同藥理機制進行研究者。姜黃做為中醫方劑組份治療疾病,其功效作用必然受到配伍藥物的相互影響。中醫藥理論認為“藥有個性之長,方有合群之妙”,方劑組份君、臣、佐、使功能作用各不相同,《神農本草經》中有“相須、相使者良,相惡、相反者勿用”等論述[7]。因此,探索姜黃的藥理作用不能僅局限于對其自身的研究,還應對其組方配伍進行整體分析。數據挖掘技術的進步為研究中醫藥配伍關聯規律提供了新的方法,其中Apriori關聯算法、廣義規則歸納(generalized rule induction,GRI)算法為常用的簡單關聯規則算法,能有效地挖掘出方劑中關聯度強的核心藥對、藥方,既簡化了方劑成分數量,又不失中醫配伍之妙,在中藥配伍規律、核心組方的發現中應用最為廣泛。例如,唐啟盛[8]等利用廣義規則歸納(GRI)關聯規則算法進行數據分析,發現了治療焦慮的傳統中藥核心配方,即柴胡-郁金、酸棗仁-生龍骨等。本研究基于數據庫挖掘技術原理,利用GRI算法、Arrowsmith知識發現工具、生物信息學數據庫等手段,研究中藥姜黃在理血方劑中配伍規律及其藥理機制,以期為開發新一代姜黃產品提供理論支持和技術線索。
1 材料與方法
1.1 數據來源與處理
本研究將《中醫方劑大詞典》[9]中所有方劑資料構建數據庫。按照納入標準,檢索收集符合要求的姜黃方劑。(一)納入標準:①方劑中含有姜黃,且符合理血方劑的概念。理血劑應符合《方劑學》(第九版)[10]標準且由兩位副高職稱以上中醫師或中西醫結合醫師認定。②為體現姜黃在方劑中的規律性,應排除藥味數>15的大方或姜黃在方中分量較輕的方劑。③排除外用的方劑。④同方異名者,以首現的古籍為準。(二)數據規范:按照2015年版《中華人民共和國藥典》[11]對檢索的方劑進行藥物名稱規范統一。如“玄胡索”、“元胡索”統一為“延胡索”,“芎”、“芎窮”統一為“川芎”等。
1.2 關聯規律分析
采用GRI廣義規則歸納算法進行關聯規律的挖掘,以SPSS Clementine 12.0軟件中的GRI建模模板進行計算。參數包括頻次、支持度、置信度、提升。X中藥支持度為含有X中藥方劑數量與納入方劑總數的比值;中藥X→中藥Y的置信度為含有中藥X的方劑中包含中藥Y的概率;中藥X→中藥Y的提升為“中藥X→中藥Y置信度”與“中藥Y支持度”的比值。置信度反應藥物組合同時出現的概率,置信度用于表示藥物間聯系的緊密性,提升度體現了中藥X對中藥Y在方劑中出現概率的提升能力,三者應綜合考量以反應姜黃在理血劑中的用藥規律。
1.3 核心配伍靶標的數據挖掘
利用Arrowsmith知識發現工具挖掘探索姜黃核心配伍的協同藥理機制。在Arrowsmith檢索界面輸入A集合檢索詞為姜黃的拉丁名與中文拼音名(“Curcumalonga” or “Jianghuang”),輸入C集合檢索詞為姜黃核心配伍中其他藥物名,例如,當歸為(“Angelicasinensis”or“Danggui”),川芎為(“Ligusticumchuanxiong” or “Chuanxiong”)等。然后使用Arrowsmith工具將A集合和C集合關聯,設置檢索語義為“Genes & Molecular Sequences,and Gene & Protein Names”得到A集合與C集合相關的集合B,從而發現姜黃與其配伍藥物的共同相關靶點、靶蛋白,以此為兩者協同藥理機制的基礎靶標。
1.4 藥理機制預測
利用STRING蛋白質相互作用數據庫(https://string-db.org/)和KOBAS 3.0數據庫(http://kobas.cbi.pku.edu.cn/kobas3/?t=1),對數據挖掘得到的姜黃核心組方靶標進行藥理分子機制分析。并利用Uniprot、Protein atlas和FunRich3.1.3數據庫預測靶基因的組織分布、細胞分布。綜合以上信息歸納姜黃核心組分的潛在藥理機制。STRING數據庫參數設置:物種為“Homo sapiens(智人)”,相互作用數據來源為文本挖掘(textmining)、實驗(experiments)、數據庫(databases),閾值設為高“high confidence = 0.7”。KOBAS 3.0數據庫設置:物種為“Homo sapiens(智人)”、通路為“KEGG Pathway、KEGG Disease”。
1.5 體外抗腫瘤機制的藥理測定
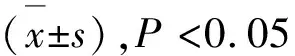
2 結果
2.1 姜黃方劑的配伍關聯規律
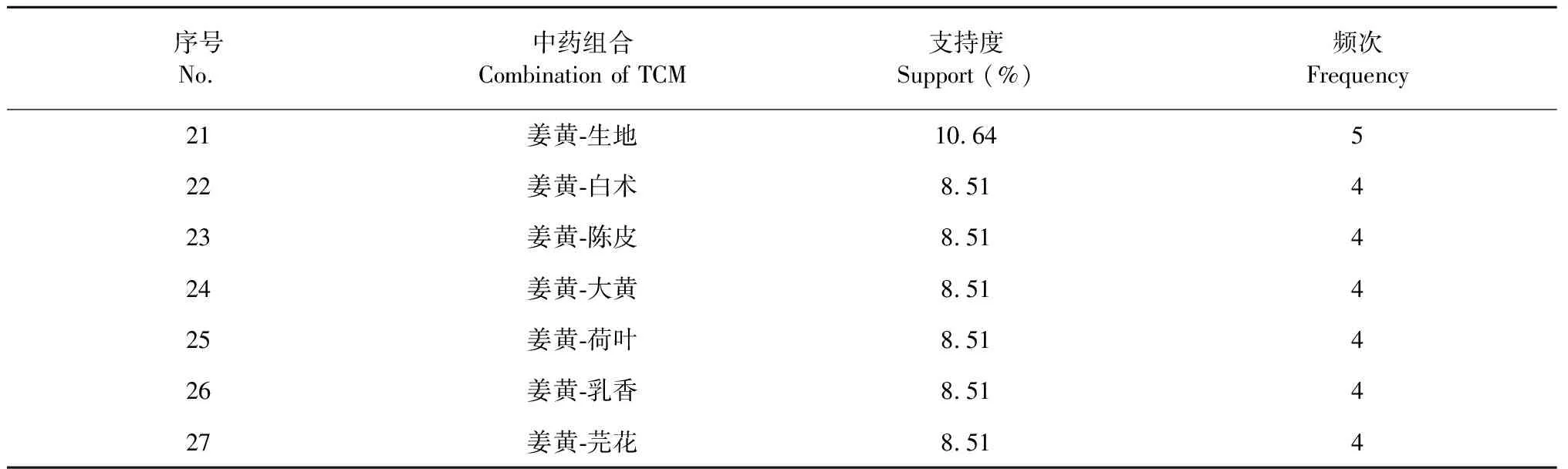
按照納入標準,在《中醫方劑大詞典》數據庫共挖掘到姜黃理血方劑47首,包含中藥126味。兩味藥組合最常見配伍如表1所示,“姜黃-當歸”頻次29、“姜黃-川芎”頻次15、“姜黃-赤芍”頻次14,為排名前三的組合。根據關聯規則GRI算法,姜黃配伍3味藥關聯規律如表2、圖1所示,其中“姜黃、川芎→當歸”(置信度93.33%、支持度31.91%、提升1.51)組合的關聯性最強。表示“姜黃、川芎”配伍頻率為31.91%,“姜黃、川芎”出現時,當歸有93.33%概率同時出現,比當歸單獨出現的概率61.70%(見表1)提升了1.51。說明“姜黃-當歸-川芎”組方頻次最高,川芎還能提升“姜黃-當歸”的出現頻率,該組方很可能是姜黃理血方劑的核心配伍。“姜黃、赤芍→當歸”和“姜黃、蒲黃→赤芍”組合的頻次、關聯性位居第二、第三,也是姜黃理血方劑的較好配伍形式。
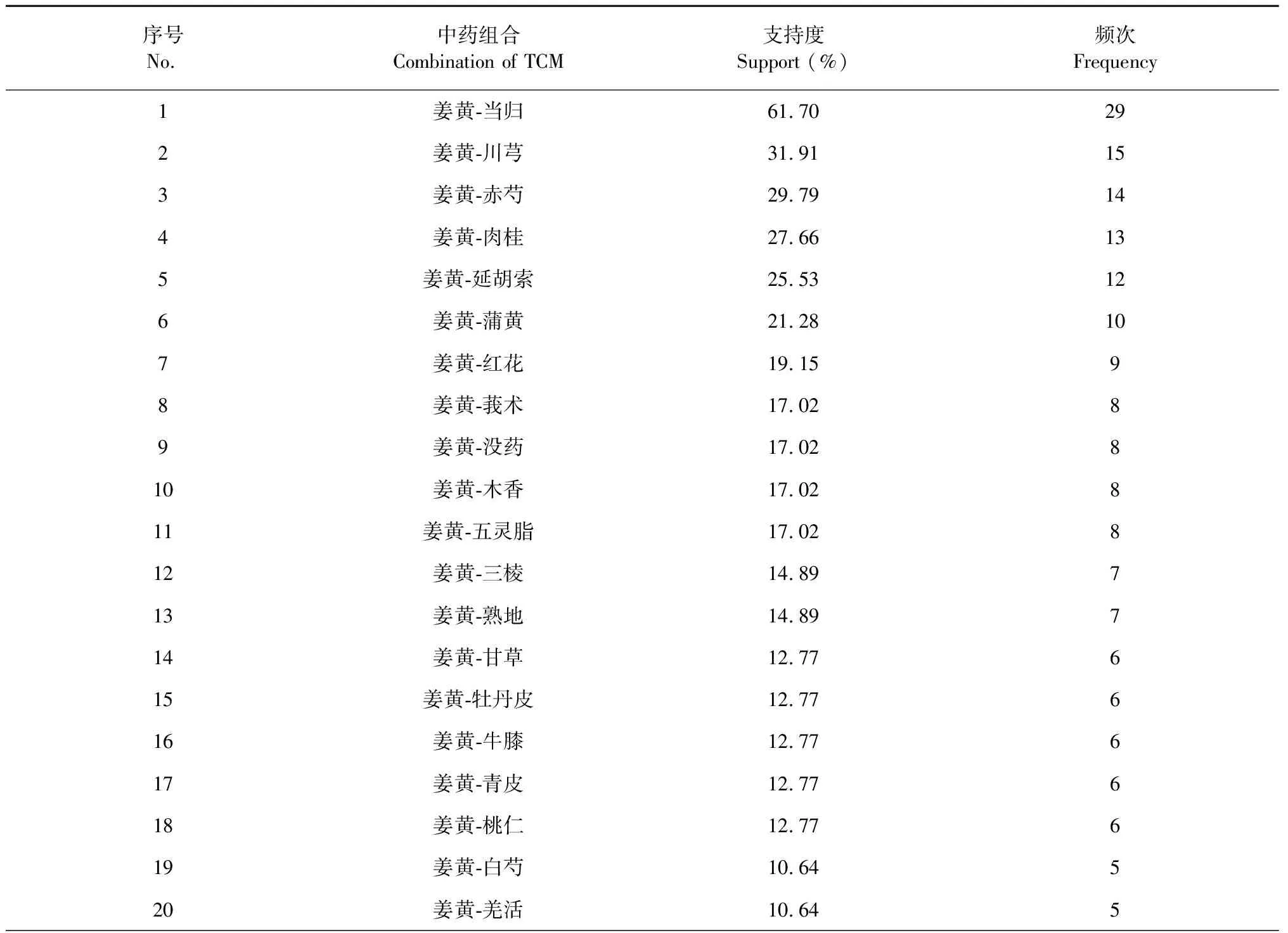
表1 姜黃配伍2味藥組合頻次表
續表1(Cotinued Tab.2)
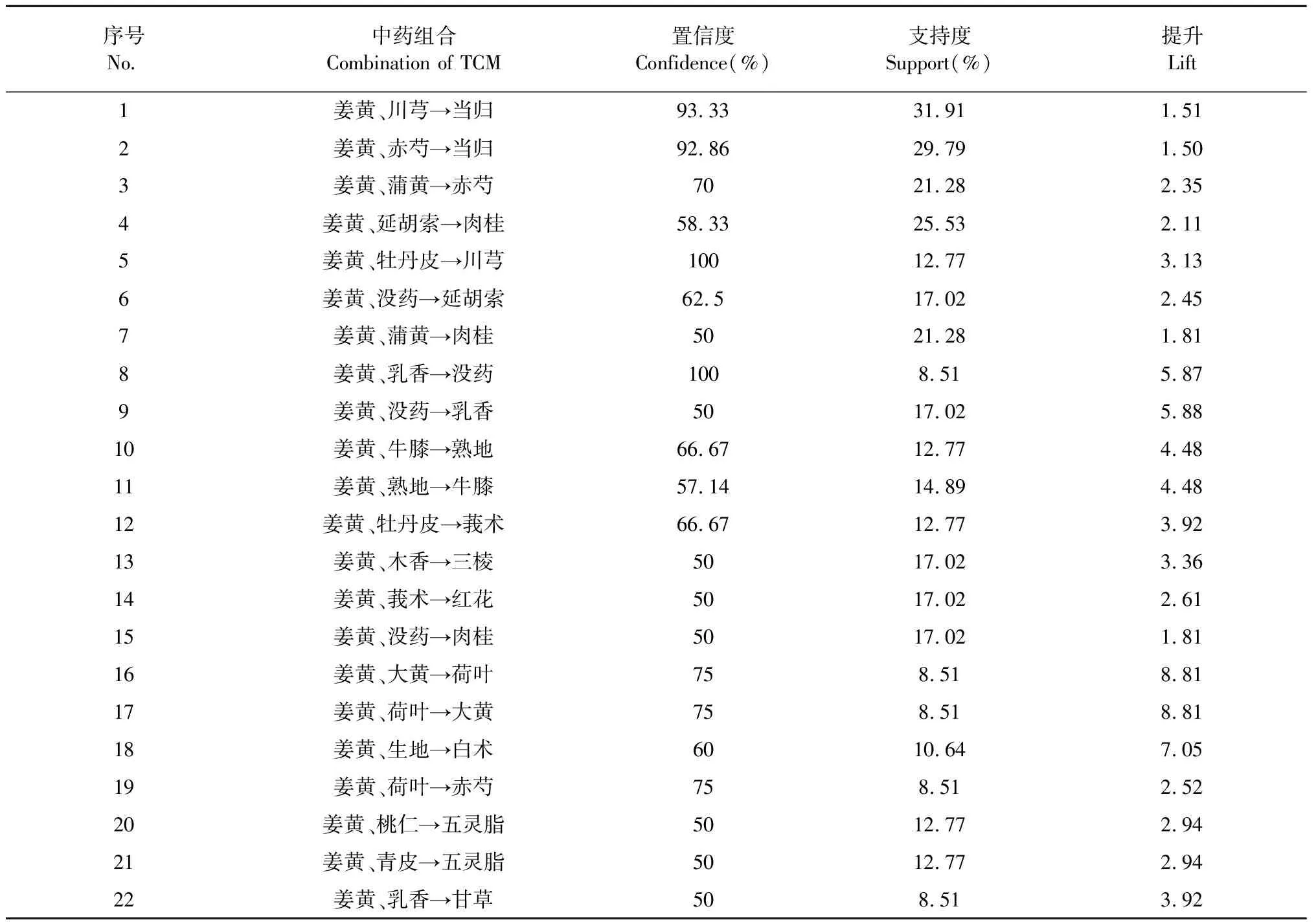
表2 姜黃配伍3味藥關聯規律
2.2 “姜黃-當歸-川芎”配伍的靶蛋白預測
通過GRI關聯算法分析,發現“姜黃-當歸-川芎”是姜黃理血方劑的核心配伍。下一步運用Arrowsmith工具將姜黃(“Curcumalonga” or “Jianghuang”)文獻集合與當歸(“Angelicasinensis”or“Danggui”)文獻集合關聯,發現“姜黃-當歸”靶點條目227個,關聯分數0.95以上條目33個。姜黃(“Curcumalonga” or “Jianghuang”)文獻集合與川芎(“Ligusticumchuanxiong”or“Chuanxiong” )文獻集合關聯,發現“姜黃-當歸”靶點條目175個,關聯分數0.95以上條目22個。如圖2、表3所示,“姜黃-當歸-川芎”關聯分數大于0.95共同靶點13個。13個靶點涉及相關家族基因27個。
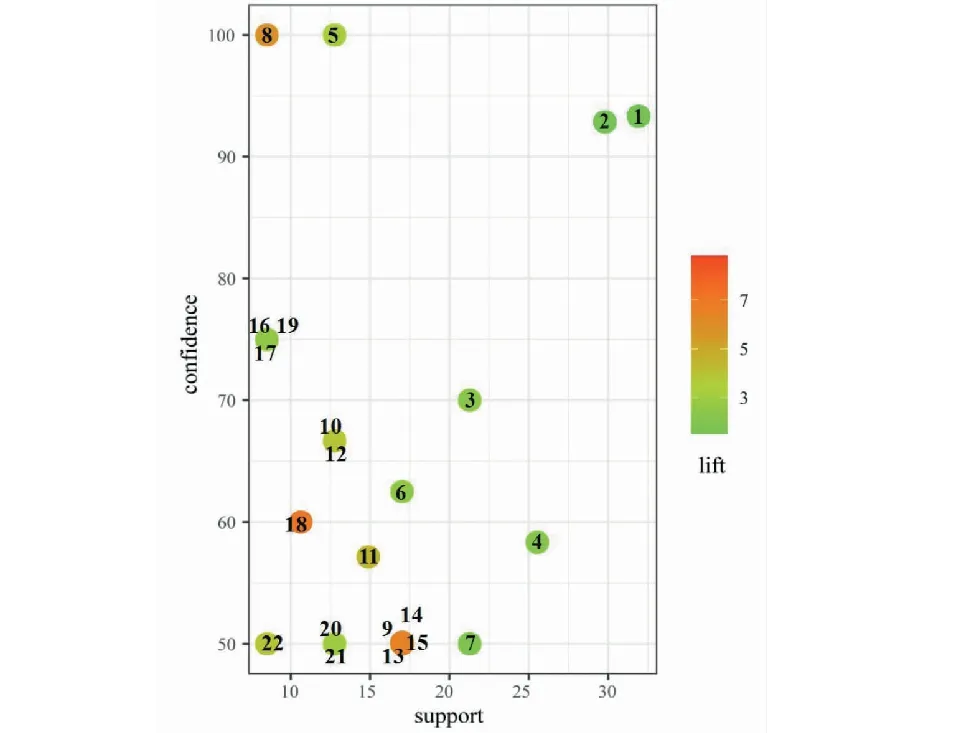
圖1 散點圖Fig.1 Scatter diagram
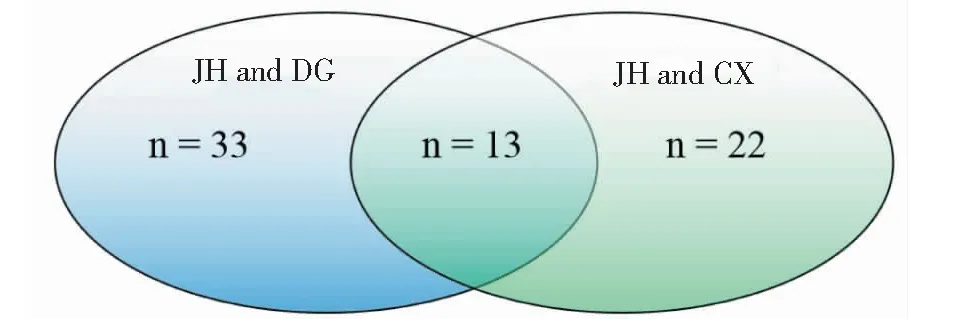
圖2 靶點數量韋恩圖 (score ≥ 0.95)Fig.2 Venn diagram of number of targets (score ≥ 0.95)
2.3 靶點的PPI網絡與組織分布
如圖3所示,將13個潛在靶點(27個基因)進行PPI(Protein-protein interaction network)網絡分析,構建了27個基因、88條相互作用的PPI網絡。利用Cytoscape軟件cytoHubba插件預測網絡Hub基因,發現網絡節點的平均度值為6.52,平均最短距離為51.03×10-2,平均介數4.09×10-2,其中AKT1、PIK3CA、RELA、NFKB1、MAPK14、VEGFA的三個網絡參數超過了平均值,是PPI網絡的樞紐節點,可能是“姜黃-當歸-川芎”靶點網絡的Hub基因。

表3 “姜黃-當歸-川芎”的共同靶點(關聯分數大于0.95)
利用Uniprot、Protein atlas和FunRich3.1.3數據庫分析靶基因的細胞分布、組織分布情況,結果如圖4、表4所示,靶基因在組織的分布大多表達于單核/巨噬細胞、NK細胞、B細胞、血小板等免疫細胞,而在其他器官的表達并不均勻。在細胞分布則有質膜、細胞質、細胞核、外泌等各種形式。
2.5 KEGG通路分析
利用KOBAS 3.0數據庫,將“姜黃-當歸-川芎”的13個潛在靶點(27個基因)進行KEGG通路富集,其中P-value<0.01的前四十條通路結果如圖5所示:8條通路與癌癥相關;12條通路與感染和炎癥相關;8條通路為信號轉導通路;5條通路與神經內分泌相關;5條通路參與了一般生物過程;還有2條通路與其他疾病相關。
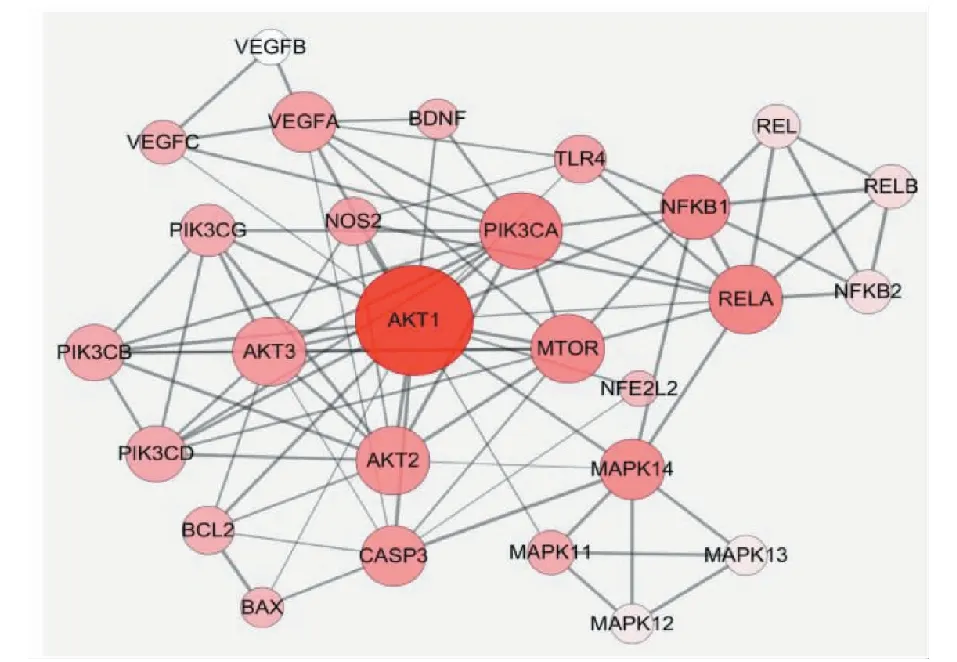
圖3 PPI網絡Fig.3 PPI network
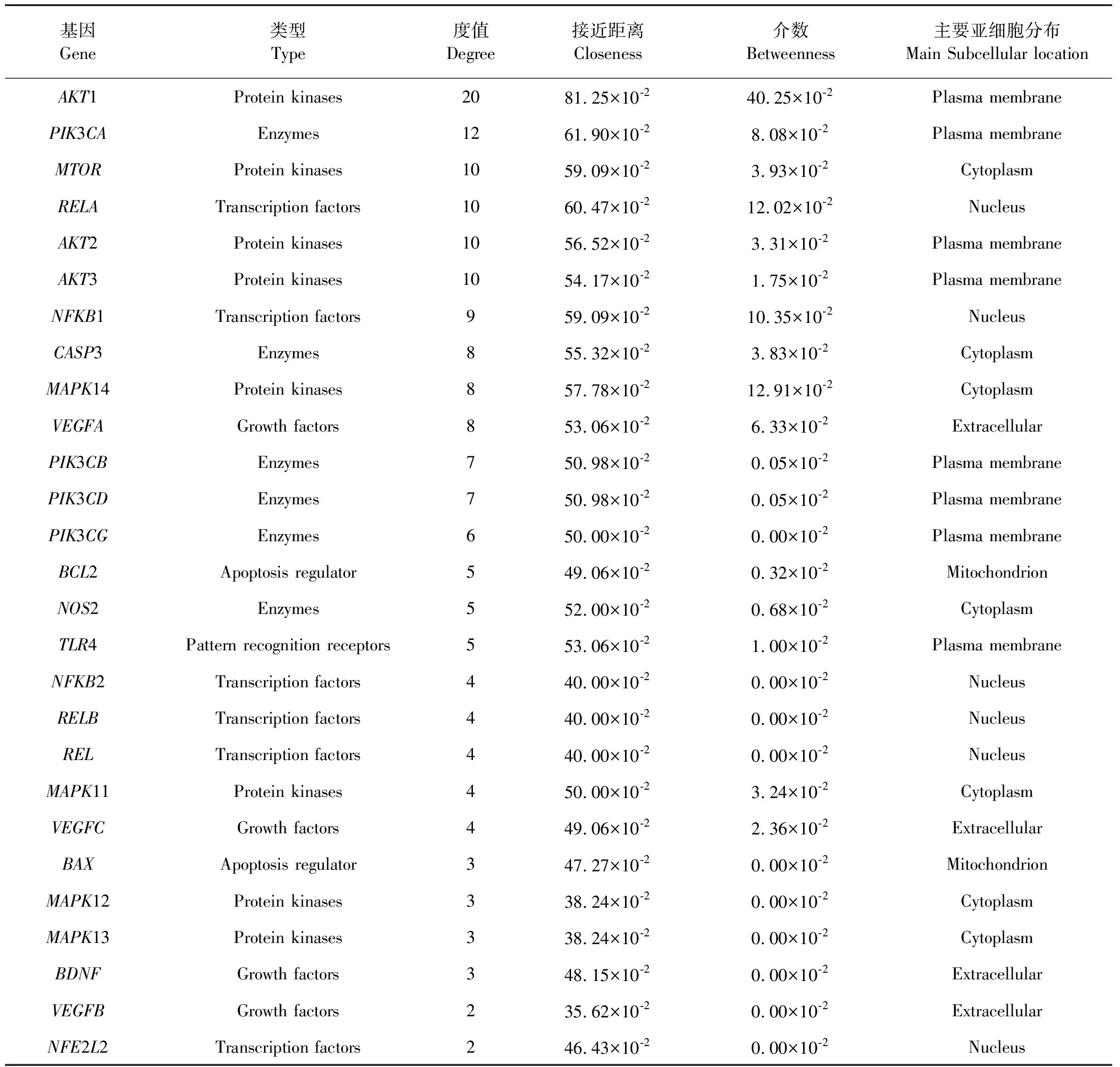
表4 PPI網絡的節點參數
綜上,四十條通路可簡要歸納為圖6~8所示,推測“姜黃-當歸-川芎”可能具有通過調控PI3K/Akt、MAPK、Toll-like receptor、T cell receptor、EGFR、VEGFR、Apoptosis、HIF-1等信號通路,發揮增強免疫力、抗炎、改善微循環、保護腦神經以及抗腫瘤、抗腫瘤血管生成等潛在藥理作用。
2.6 組方A549細胞的抑制率
利用5 g姜黃,5 g川芎和5 g當歸制成粉末,將300 mL水煎至150 mL,過濾除去殘留物,然后加入300mL水中,最后濃縮至150 mL(相當于中藥100 mg/mL)。我們使用MTT測定法定量了A549細胞的抑制率和增殖。對數生長期的A549細胞分為六組(每組3孔)。第1組至第5組中分別添加100、50、25、12.5、6.25 mg/mL的草藥提取物100 μL,對照組則添加100 μL DMSO。在二氧化碳培養箱中孵育24、48、72 h后,我們通過每孔添加20 μL MTT(5 mg/L)除去。溫育4 h后,用DMSO終止反應。最后,通過酶標儀在570 nm下測量每孔的吸光度。抑制率=(1-OD實驗/ OD對照)×100%。結果顯示在表5和圖9中。“姜黃-川芎-當歸”配方可以劑量和時間依賴性抑制腫瘤細胞的增殖。
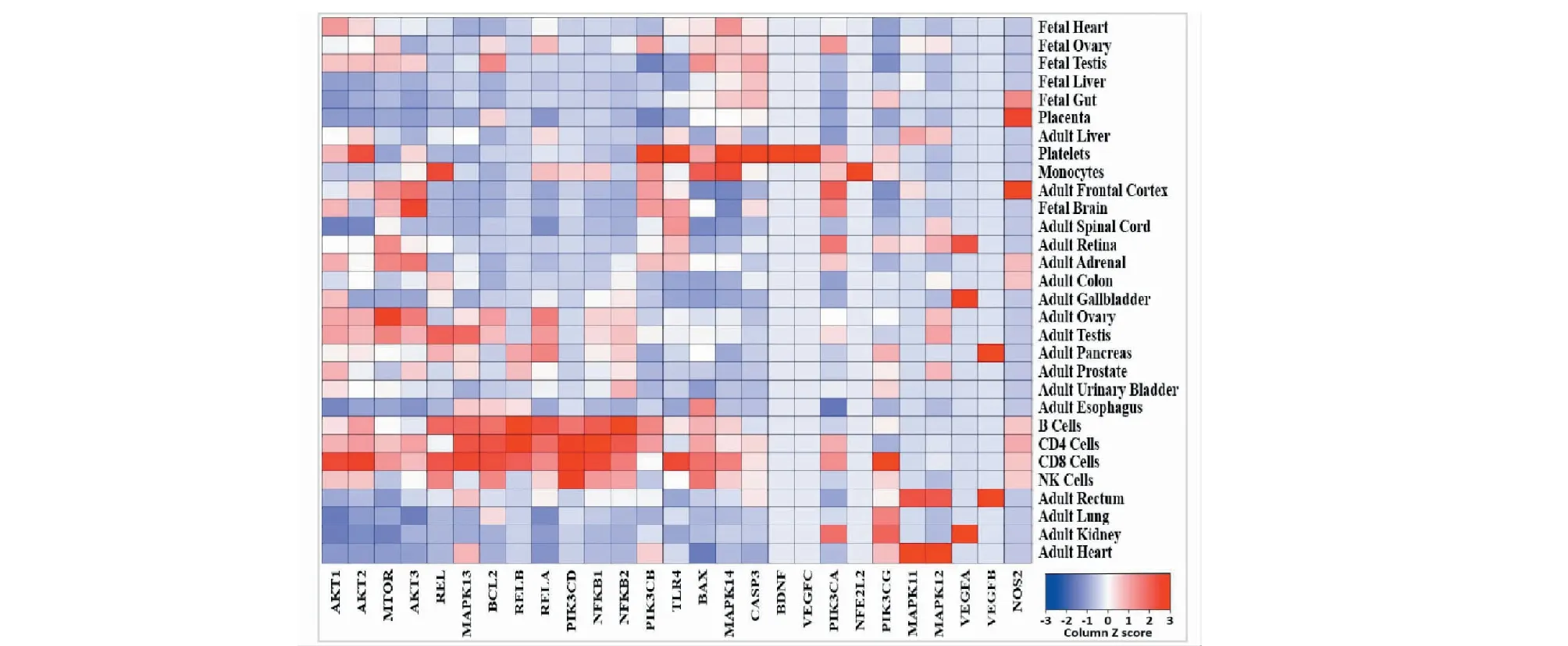
圖4 組織分布Fig.4 Tissue organ location
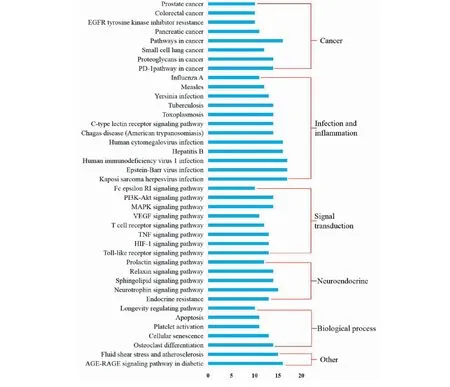
圖5 通路富集Fig.5 Pathway enrichment
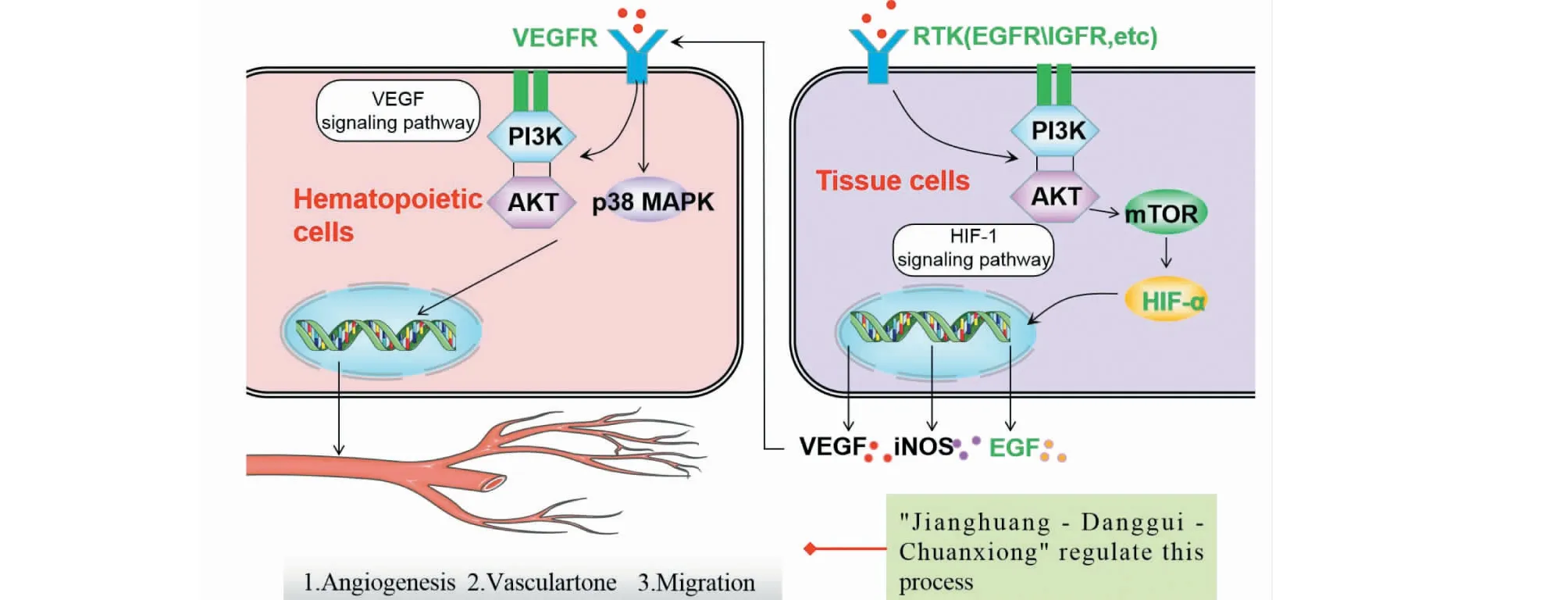
圖6 調控血管生成Fig.6 Regulating angiogenesis
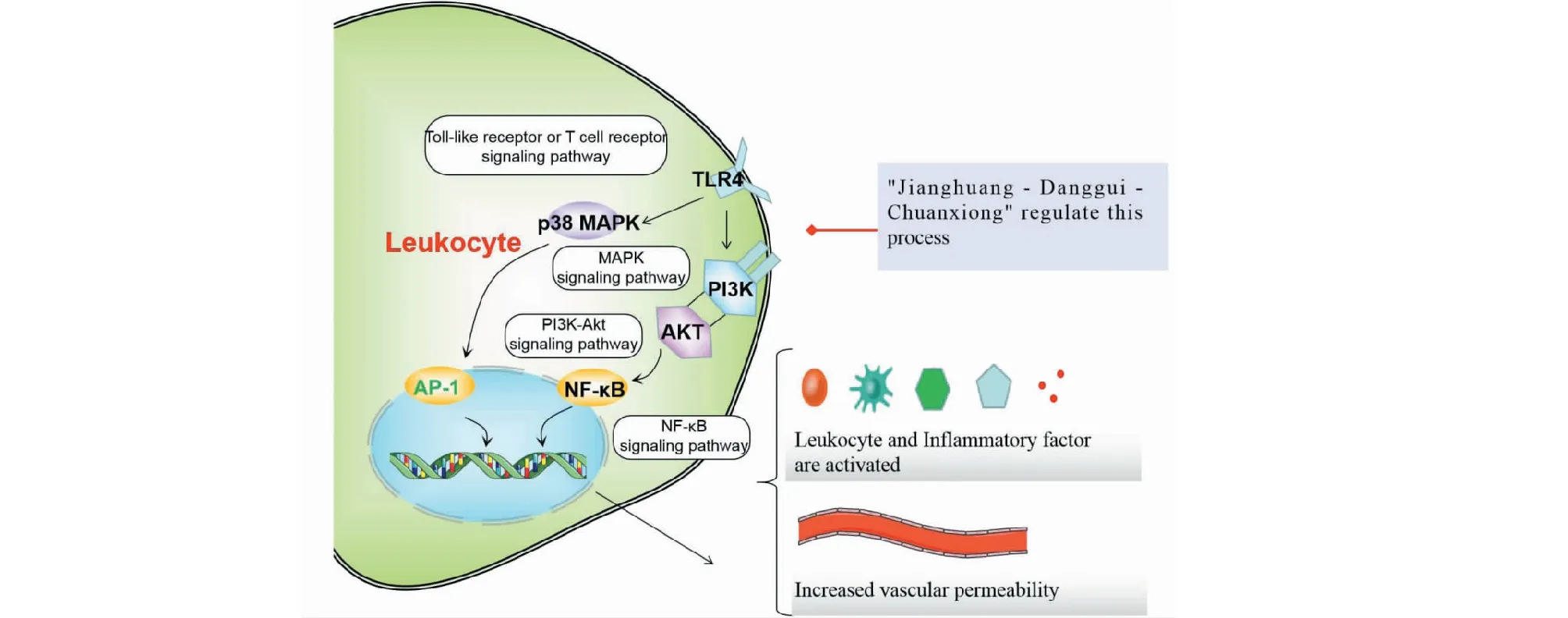
圖7 調節免疫反應Fig.7 Regulate immune response
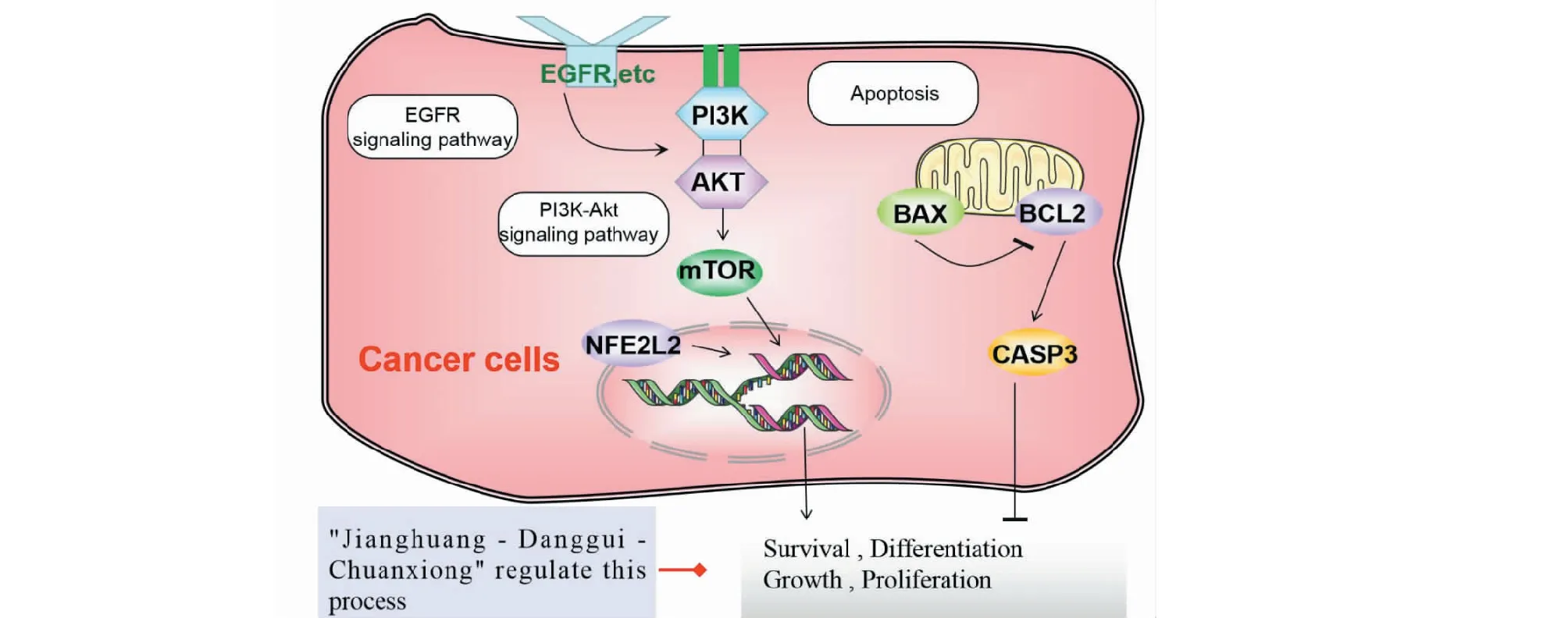
圖8 抗腫瘤Fig.8 Antitumor
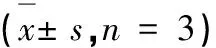
表5 不同濃度組方對A549細胞的抑制率
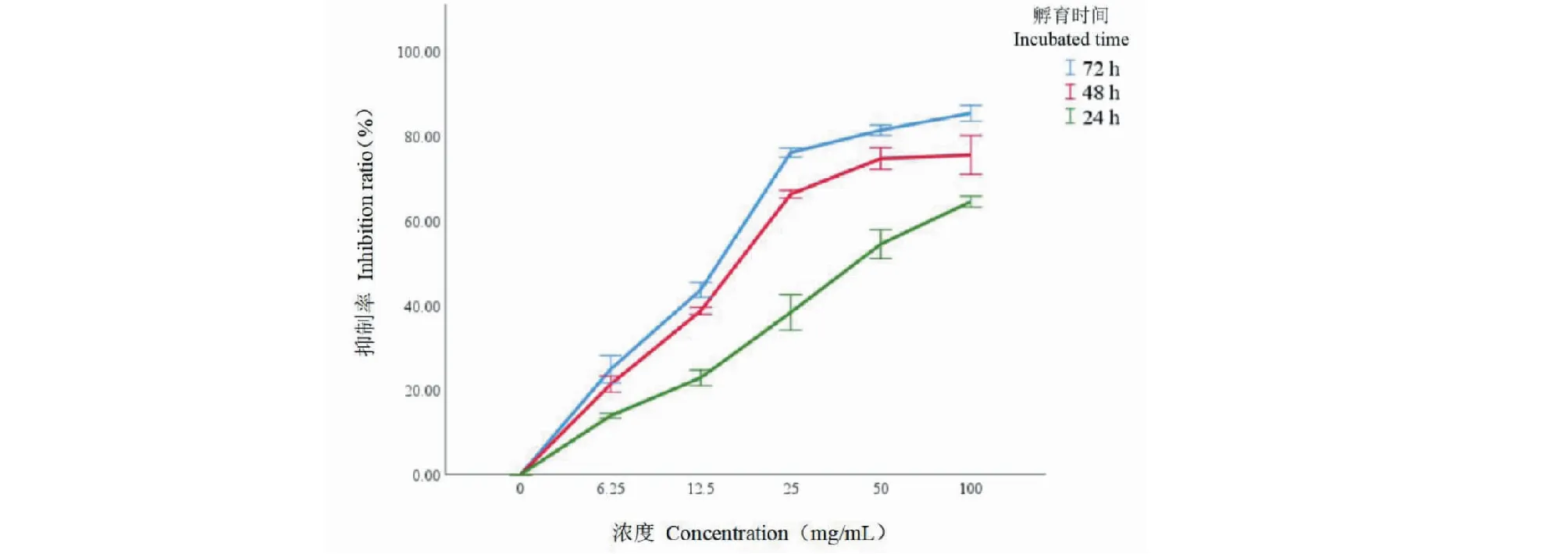
圖9 不同濃度組方對A549細胞抑制率的影響Fig.9 Effect of formula with different concentrations on the inhibition ratio of A549 cells
2.7 靶蛋白p-EGFR、p-PI3K、p-Akt、VEGF和HIF-1α體外測定的體外表達
通過Human Protein Atlas數據庫進行的生物信息學免疫組織化學分析表明,在正常肺組織中PI3K、EGFR未表達,AKT低表達,但在肺癌組織樣品中PI3K、EGFR、AKT明顯表達(見圖10)。基于Western blotting檢測了p-EGFR、p-PI3K和p-Akt在A549肺癌細胞的表達(見圖11)。將人類A549細胞分為四組(每組3孔):對照,小劑量(6.25 mg/mL)、中等劑量(12.5 mg/mL)、高劑量(25 mg/mL)。證明“姜黃-川芎-當歸”配方可以明顯抑制培養基中p-EGFR、p-PI3K和p-Akt的表達。孵育24 h后,我們通過Elisa分析檢測了VEGF、HIF-1α的表達。“姜黃-川芎-當歸”配方可顯著抑制各劑量組的VEGF、HIF-1α的表達(見表6)。
3 討論
理血劑是一類具有調暢血行、散除瘀血、涼血止痛等效果的中醫方劑,現代醫學常用以治療外傷腫痛、婦科炎癥、心腦血管疾病、腫瘤癌癥等。本研究發現的姜黃核心配伍“姜黃-當歸-川芎”中川芎屬于活血化瘀藥,而當歸屬于活血補血藥。姜黃與川芎、當歸配伍具有較好的中醫配伍理論依據。川芎為血中氣藥,兼有行氣止痛之效,氣行則血暢,故能增強姜黃、當歸活血化瘀之力[12]。當歸為補血圣藥,能祛瘀生新,與姜黃、川芎配伍祛邪扶正、攻補兼施[13]。古代經典名方“四物湯”便有當歸配伍川芎的用法。Li等[14]研究發現當歸與川芎配伍后治療血瘀大鼠比單獨當歸、單獨川芎療效更佳。Deng等[15]總結通過數據挖掘古今名方,發現姜黃具有治療腦病的作用,并且最善與活血化瘀藥當歸、川芎等配伍,于本研究數據挖掘結論基本一致。綜上,說明當歸、川芎與姜黃具有協同增效的配伍依據,但后續仍需進一步實驗分析姜黃與當歸、川芎增效機制。
本研究首先通過Arrowsmith知識發現工具,發現了“姜黃-當歸-川芎”能聯合作用于AKT、TLR4、caspase-3、PI3K、mTOR、p38 MAPK、VEGF、iNOS、Nrf2、BDNF、NF-κB、Bcl-2、Bax等13個靶點,涉及相關基因27個。PPI與通路富集顯示“姜黃-當歸-川芎”能通過AKT1、PIK3CA、RELA、NFKB1、MAPK14、VEGFA等Hub基因,參與調控PI3K/Akt、MAPK、Toll-like receptor、T cell receptor、EGFR、VEGF、Apoptosis、HIF-1等信號通路,預測其可能具有增強免疫力、抗炎、改善微循環、保護腦神經以及抗腫瘤、抗腫瘤血管生成等潛在藥理作用。

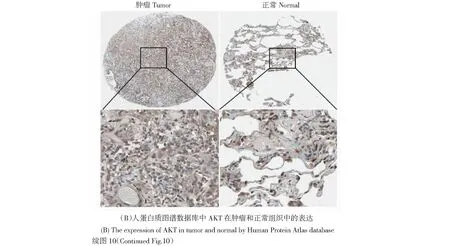
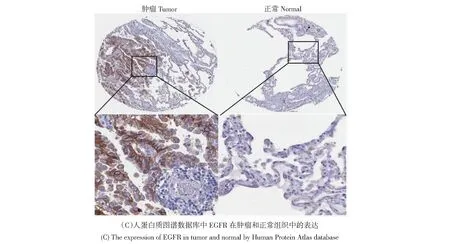
圖10 PI3K、Akt、EGFR在肺癌組織中過表達Fig.10 PI3K, Akt, EGFR is overexpressed in lung cancer tissues
表6 組方對A549細胞VEGF和HIF-1α表達的影響
Liu等[16]發現姜黃能抑制AKT/mTOR途徑而導致卵巢癌細胞SK-OV-3細胞凋亡。Ashrafizadeh等[17]發現姜黃通過靶向Nrf2信號通路具有多種作用,包括抗氧化劑,抗菌,抗腫瘤和抗炎作用。此外,有研究表明川芎和當歸也可以發揮抗腫瘤作用,Shen等[18]使用RT-qPCR和Western blotting分析表明,川芎能顯著降低Akt的表達和活性,增加caspase-3的活性,并且還顯示出對多種類型的癌癥具有抗腫瘤作用。當歸可以通過抑制mTOR蛋白誘導胃癌細胞死亡,并可以顯著延長癌癥患者的生存率[19]。當歸還影響多種凋亡因子Bcl-2相關X蛋白(Bax)、Bcl-2和caspase-3的表達并促進人乳腺癌細胞的凋亡,因此已被證明是一種有前途的乳腺癌治療劑[20]。另外,“姜黃-當歸-川芎”配方可能具有抗腫瘤血管生成作用。有ELISA分析表明,姜黃能抑制腫瘤細胞中VEGF的分泌,進一步抑制了腫瘤血管生成[21]。Chen等[22]發現當歸可以通過抑制PI3K/AKT/mTOR信號通路并下調HIF-1α和VEGF的表達來預防癌細胞的增殖和血管生成。這些研究表明“姜黃-當歸-川芎”配方可發揮抗腫瘤作用。我們的結果與上述研究基本一致。
此外,本研究推測“姜黃-當歸-川芎”配方還可以顯示抗炎,保護腦神經的作用以及改善微循環的作用。Zhu等[23]使用免疫組織化學,酶聯免疫吸附測定和蛋白質印跡,證明姜黃能通過抑制TLR4/MyD88/NF-κB信號通路減輕實驗性顱腦損傷的急性炎癥損傷。有研究表明當歸可以上調TLR4蛋白的表達,具有抗炎和鎮痛的藥理作用[24]。川芎能通過抑制p38 MAPK和NF-κB信號通路,使炎癥性細胞因子和粘附分子在血管內皮細胞上的表達降低。這些研究證實了“姜黃-當歸-川芎”配方抗炎作用的假設。Wu等[25]發現姜黃可以通過上調caspase 3和Bcl-2的表達,下調Bax的表達并促進PI3K/AKT途徑的活化而對缺血性腦損傷發揮有益作用。Hurley等[26]研究表明姜黃能導致海馬BDNF劑量依賴性增加,具有保護腦神經作用。Cheng等[27]發現當歸可通過下調caspase 3和上調p-p38 MAPK,缺氧誘導因子(HIF-1),血管內皮生長因子-A(VEGF-A)來保護患者免受腦梗塞并改善神經系統損害。Chen等[28]發現當歸四逆湯可以有效地通過PI3K/Akt/iNOS途徑保護胰島微血管的微血管內皮細胞。我們的結果與以上研究一致,證明了“姜黃-當歸-川芎”配方保護腦神經和改善微循環的藥理作用。
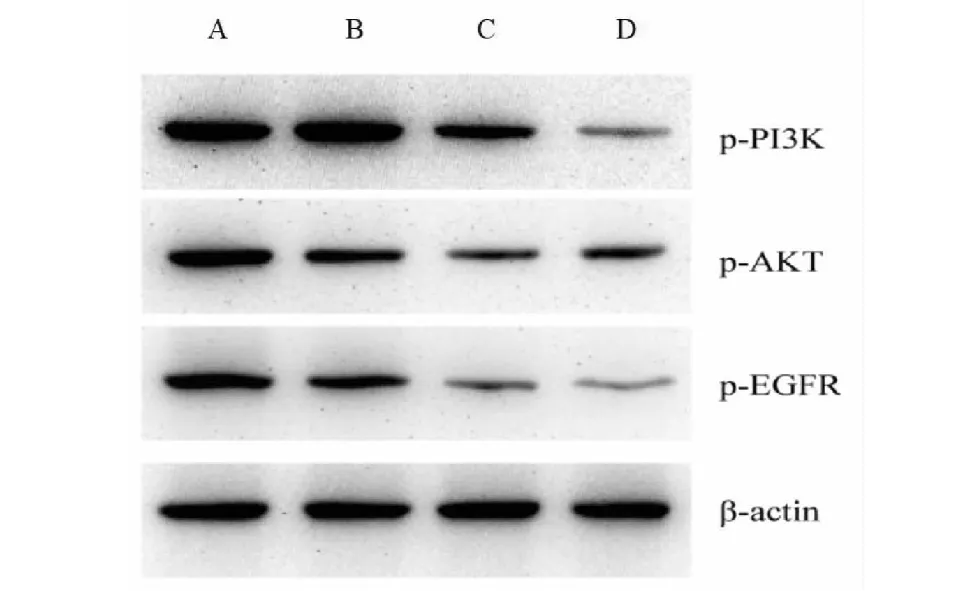
圖11 通過Western blotting在A549細胞中p-EGFR、p-PI3K和p-Akt的表達Fig.11 The expression of p-EGFR, p-PI3K and p-Akt in A549 cells by Western blotting注:A:對照組:B:小劑量;C:中劑量;D:高劑量Note: A: Control; B:Small-dose; C: Medium-dose; D: High-dose
最后,本研究使用MTT、Elisa和Western blotting實驗,發現“姜黃-當歸-川芎”配方可以抑制人肺癌A549細胞增殖并下調A549細胞中p-EGFR、p-PI3K、p-Akt、VEGF和HIF-1α的表達。這些實驗表明“姜黃-當歸-川芎”配方在體外確實具有抗癌和抗腫瘤血管生成作用,證明數據挖掘信息可靠有效、可以預測中藥的某些藥理機制。本研究結果為中醫藥的發展和藥理作用機理研究提供了方法參考。

