從高考題看辯證思維的運用——以“外界條件對可逆反應的影響”相關問題為例
湖北
催化劑、溫度、壓強、濃度等外界條件對可逆反應的影響是化學反應速率和化學平衡章節的重要內容,可結合實際的生產、生活和科學研究情境,討論外界條件對可逆反應的影響問題,可以考查考生進行四個層次的能力,是新高考的熱點問題。
此類問題的難點主要有兩個方面:一是可逆反應可受多種外界條件影響,其中溫度、濃度、壓強和催化劑是主要的影響因素,而催化劑的影響又與溫度有關;二是外界條件可以從多個角度影響可逆反應,如反應速率、反應限度、反應能耗以及反應設備要求等。筆者發現,運用辯證思維能有效解決與外界條件對可逆反應的影響有關的問題。
一、辯證思維的運用基礎
辯證思維是認識事物的科學思維方式,其特點是從影響事物的各個相互聯系的方面進行分析,以便從整體上、本質上全面地認識事物。溫度、壓強、濃度和催化劑是影響可逆反應的關鍵因素,從這些方面進行綜合分析能更加完整地認識外界條件對可逆反應的影響。對立統一規律是辯證思維的基本規律之一,揭示了事物發展變化的根本原因是具有矛盾性。例如對于合成氨反應來說,高溫有利于加快反應速率,卻不利于提高反應限度,那么合成氨的條件是選擇低溫還是高溫就需要在對立中把握反應速率與反應限度的平衡,即根據催化劑活性選擇反應溫度。分析綜合是辯證思維的體現,分析是把可逆反應分解為反應速率、反應限度、生產能耗等不同的方面,分別研究外界條件對這些方面的影響,而綜合是按照實際生產條件的要求、結合化學反應速率和化學平衡移動原理進行綜合調控,以形成更加深刻的認識。
二、辯證思維的運用模型
在高考題中,外界條件對可逆反應的影響涉及多個方面,如溫度、催化劑、濃度、壓強等,所以在分析題目時首先要確定研究對象,再分析對象的各個影響因素,研究單個因素對其產生的影響,最后按照實際生產的需要在對立中把握統一,辨別主要因素和次要因素,綜合分析結果,進而得出結論。運用辯證思維解答此類問題的思維模型如圖1所示:

圖1
三、辯證思維的運用實例
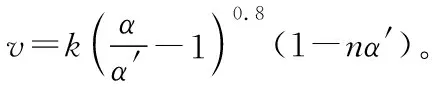
式中:k為反應速率常數,隨溫度t升高而增大;α為SO2平衡轉化率,α′為某時刻SO2轉化率,n為常數。在α′=0.90時,將一系列溫度下的k、α值代入上述速率方程,得到v-t曲線,如圖2所示。
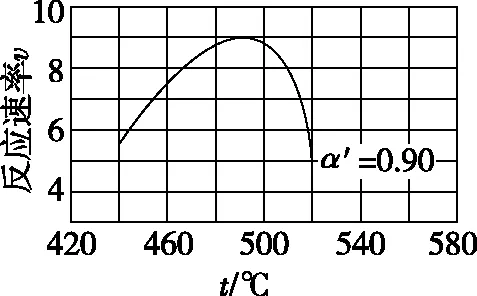
圖2
曲線上v最大值所對應溫度稱為該α′下反應的最適宜溫度tm。t
【答案】溫度升高,k增大使v逐漸提高,但α降低使v逐漸下降。當t
【解析】該圖為速率—溫度曲線,研究對象是速率,根據速率方程,在α′一定的情況下,影響速率大小的因素有兩個:k和α。運用辯證思維的分析模型如圖3:
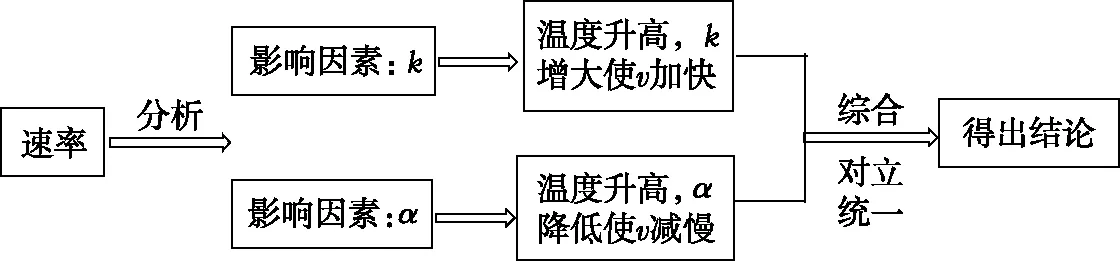
圖3
【點撥】在本題中,分析對象是速率,圖像信息只涉及了溫度對反應速率的影響,但是結合速率方程可知溫度是通過影響k和α兩個方面最終影響反應速率,再分析溫度變化對這兩個因素的影響,最后進行綜合分析得出結論。分析過程體現了辯證思維的特點,從對象在各個方面的相互聯系中進行考查,以便從整體和本質上認識對象。


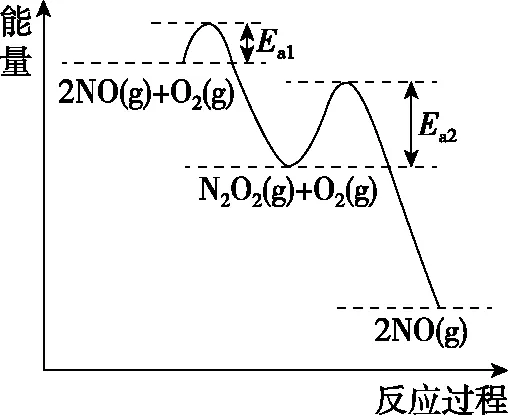
圖4
②在恒容的密閉容器中充入一定量的NO和O2氣體,保持其他條件不變,控制反應溫度分別為T3和T4(T4>T3),測得c(NO)隨t(時間)的變化曲線如圖5。轉化相同量的NO,在溫度________(填“T3”或“T4”)下消耗的時間較長,試結合反應過程能量圖(圖4)分析其原因:。
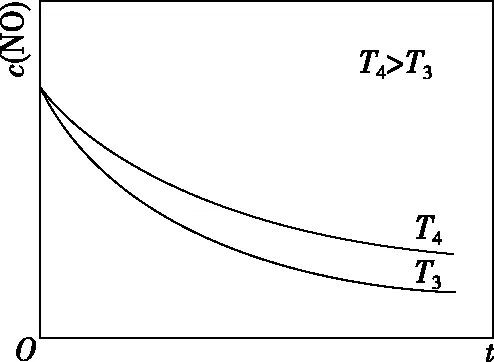
圖5
【答案】T4溫度升高,反應Ⅱ的速率加快;ΔH1<0,溫度升高,反應Ⅰ平衡逆向移動,c(N2O2)減小,反應速率減慢。濃度降低的影響大于溫度對反應Ⅱ速率的影響
【解析】分析曲線可知,轉化相同量的NO在溫度為T4時消耗的時間較長,說明溫度為T4時反應速率較慢,為什么溫度越高反應速率越慢呢?當影響反應速率的變量只有溫度時,則溫度升高,反應速率加快。故一旦出現溫度升高反應速率卻減慢的情況,則可判斷影響反應速率的因素除了溫度外,還可能有反應物濃度或催化劑的活性等其他因素。
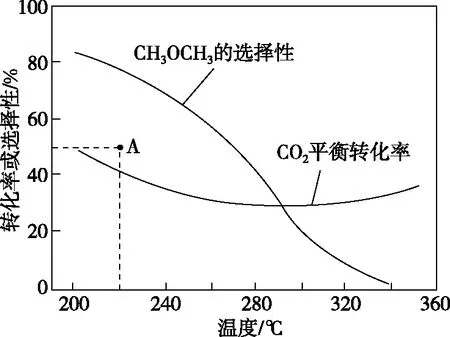
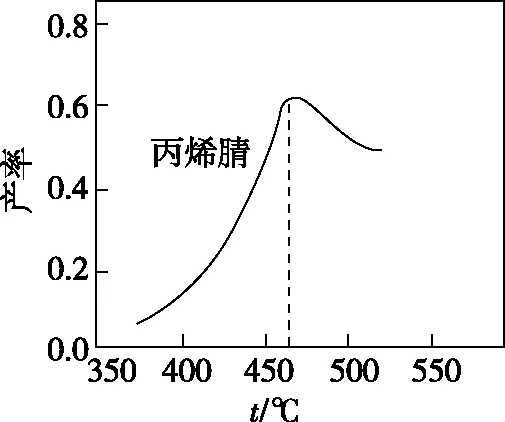
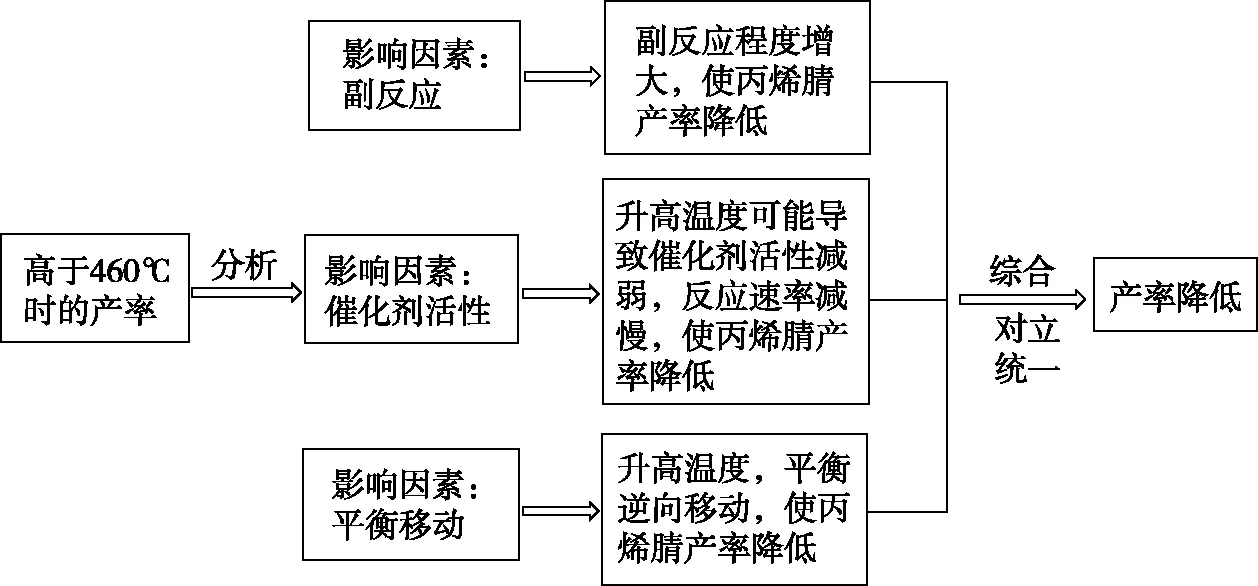
結合圖4所示反應歷程可知Ea1 圖6 【點撥】本題綜合性較強,問題層次較深,分析影響反應速率的因素難度較大。其一是考查了化學反應歷程的相關知識,即活化能越小反應速率越快,總反應速率由慢反應過程的速率決定;其二是影響反應Ⅱ速率的因素有溫度和反應物的濃度,反應Ⅰ快速平衡后在溫度的影響下平衡發生移動,導致N2O2濃度減小,間接造成了對反應Ⅱ速率的影響。慢反應即反應Ⅱ是決定總反應速率的步驟,但在溫度變化時反應Ⅰ也通過平衡移動所產生的影響證明了自己的重要性,所以反應歷程中的兩步反應過程彼此聯系、相互影響,體現了認識事物就要認識事物的各個方面,認識事物本質的辯證思維。 【例3】(2019·江蘇卷·20節選)CO2的資源化利用能有效減少CO2排放,充分利用碳資源。 (3)CO2催化加氫合成二甲醚是一種CO2轉化方法,其過程中主要發生下列反應: ΔH=-122.5 kJ·mol-1 在恒壓、CO2和H2的起始量一定的條件下,CO2平衡轉化率和平衡時CH3OCH3的選擇性隨溫度的變化如圖7。其中: 圖7 ①溫度高于300℃,CO2平衡轉化率隨溫度升高而上升的原因是。 【答案】反應Ⅰ為吸熱反應,升高溫度,平衡向正反應方向移動,CO2的平衡轉化率增大,反應Ⅱ為放熱反應,升高溫度,平衡向逆反應方向移動,CO2的平衡轉化率降低。根據圖像可知上升幅度超過下降幅度 【解析】題目分析的對象是CO2的平衡轉化率,由反應Ⅰ和反應Ⅱ共同決定,運用辯證思維的分析模型如圖8: 圖8 【點撥】本題的分析對象是CO2的平衡轉化率,反應對象涉及相互關聯且相互競爭的兩個反應,而兩個反應中一個是吸熱反應,一個是放熱反應,反應特點不同,升高溫度對兩個可逆反應的影響結果相互矛盾,最終的結論表現了矛盾雙方的對立統一。 解答此類題時一定要辨析清楚題目所給出的轉化率、產率、體積分數或含量是否為平衡狀態的量,若不是平衡量,問題的分析角度就會發生變化。 以丙烯、氨、氧氣為原料,在催化劑存在下生成丙烯腈(C3H3N)和副產物丙烯醛(C3H4O)的熱化學方程式如下: (2)圖9為丙烯腈產率與反應溫度的關系曲線,最高產率對應的溫度為460℃。低于460℃時,丙烯腈的產率________(填“是”或者“不是”)對應溫度下的平衡產率,判斷理由是 ; 高于460℃時,丙烯腈產率降低的可能原因是________(雙選,填標號)。 A.催化劑活性降低 B.平衡常數變大 C.副反應增多 D.反應活化能增大 圖9 【答案】不是 該反應為放熱反應,平衡產率應隨溫度升高而降低 AC 【解析】本題曲線中的產率未指明是否為平衡產率。當溫度低于460℃時,產率隨溫度的升高而增大,變化結果與平衡產率的變化趨勢不一致,所以此時為非平衡產率。溫度高于460℃時的產率是否一定為平衡產率呢?通過分析題干信息可知,反應除了生成丙烯腈外還有副產物丙烯醛生成,所以影響產率的因素可能還存在副反應;反應條件有催化劑,而催化劑的活性會受到溫度的影響;當然,如果反應達到平衡狀態,則升高溫度平衡逆向移動也可能導致產率降低。運用辯證思維的分析模型如圖10: 圖10 【點撥】溫度低于460℃時,產率隨溫度的變化結果與平衡產率隨溫度的變化趨勢不一致,所以此時為非平衡產率,這個結論相對容易得出。但溫度高于460℃時的產率是否一定為平衡產率呢?圖10是產率—溫度曲線,隨溫度的變化曲線出現了拐點,按照學生的習慣性思維,容易誤判為最高點和最高點之后是平衡狀態,最高點之前是非平衡狀態,所以培養學生的辯證思維能有效解決思維定式的問題。從辯證思維的角度全面分析影響產率的因素,并且認識到這些因素之間是彼此聯系的,如加入催化劑能加快反應的速率,升高溫度也能加快反應的速率,但兩個因素同時作用時,對速率的影響結果就不能確定了,因為催化劑的催化活性受到溫度的影響。 本題影響產率的因素除平衡移動因素外,還有速率因素和副反應因素,所以溫度高于460℃時的產率不一定是平衡產率。但如果影響因素只有平衡移動,則該產率為平衡產率。故在遇到此類問題時,若判斷影響因素有多個時,則應先分析單一因素的影響,再進行綜合分析。 “外界條件對可逆反應的影響”的相關問題包含外界條件對濃度、速率、轉化率、含量等多個方面的影響,這些因素之間又相互聯系,試題中所討論的可逆反應狀態一般涉及非平衡和平衡兩種狀態,非平衡狀態下的影響主要是從速率的角度討論,平衡狀態下的影響主要從平衡移動的角度討論。縱觀此類高考題的設問,大都情況復雜、綜合性較強、難度較大,辯證思維是解決此類高考題的有效方法,運用辯證思維模型,先確定研究對象,判斷可逆反應所處狀態,依據事物之間的普遍聯系找出影響對象的不同因素,再依據反應速率理論和化學平衡原理分析影響對象的結果,最后按照對立統一的規律從整體上、本質上進行綜合以得出結論。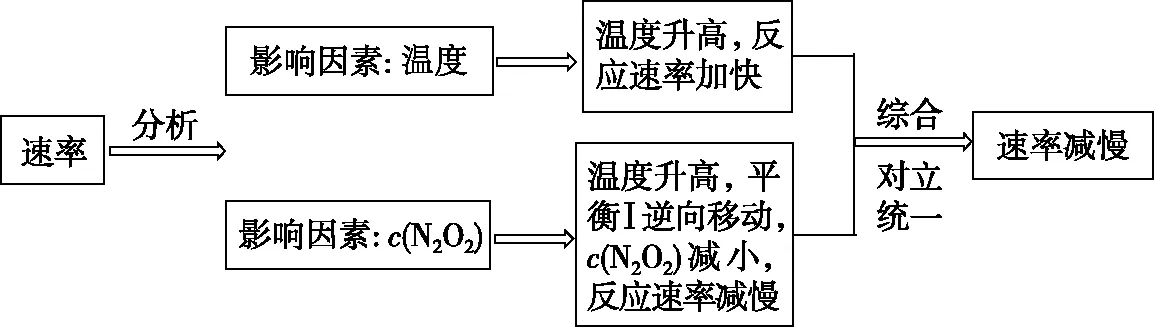





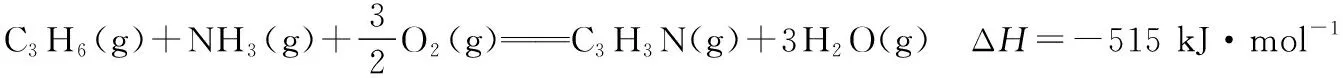

四、啟發


