伴微乳頭結構肺腺癌中c-Met、VEGF的表達及意義*
邱 靜,戴曉麗,王 琪,王婷婷,梁曉東
(1.江蘇省鹽城市第三人民醫院病理科 224000;2.江蘇醫藥職業學院,江蘇鹽城 224000)
肺癌是全球發病率和病死率最高的惡性腫瘤之一,5年生存率僅有14%[1]。近年來,肺腺癌所占比率有明顯增長趨勢,目前已成為多數國家最常見的肺癌組織學亞型。肺腺癌又分為眾多亞型,其中,伴微乳頭狀結構肺腺癌(pulmonary adenocarcinoma with a micropapillary pattern,MPPAC)由AMIN等[2]在2002年首次報道,2011版肺腺癌組織學分類新標準首次將含有微乳頭結構(micropapillary pattern,MPP)≥5%遞增量的浸潤性肺腺癌單獨劃分為一個新的組織學亞型,常與肺癌的其他亞型(如貼壁生長型、腺泡型、乳頭型、實體型等)混合存在,純型罕見。與普通型肺腺癌比較,MPPAC整體預后較差,易發生淋巴結轉移及遠處轉移[3]。目前,有關MPPAC潛在分子機制尚不完全清楚。而肝細胞生長因子受體c(c-Met)為酪氨酸蛋白激酶家族成員,許多惡性腫瘤都伴有c-Met基因的擴增和過度表達[4],c-Met信號通路有可能成為MPPAC的潛在治療靶點。此外,血管內皮細胞生長因子(vascular endothelial growth factor,VEGF)作為重要的促血管生成因子[5],其表達與MPPAC的關系也受到關注。目前國內對于c-Met、VEGF與MPPAC關系的研究尚少,本研究對116例肺腺癌根治標本分組進行免疫組織化學染色,比較c-Met、VEGF在MPPAC組及MPP陰性組中的表達,探討兩者表達的相關性,以及其與MPPAC患者臨床病理因素的關系,分析其在腫瘤的發生發展及侵襲轉移中的作用,為探尋有效的靶向藥物治療提供一定的理論依據。
1 資料與方法
1.1 一般資料
收集2016年5月至2019年5月在江蘇省鹽城市第三人民醫院行肺癌手術切除標本116例(排除術前行放/化療及合并其他腫瘤患者)及50例癌旁正常肺組織,所有標本均經病理證實為腺癌,根據2011年發表的肺腺癌新分類診斷標準:以MPP是否大于5%將116例肺腺癌病例分為56例MPPAC組和60例MPP陰性組,50例癌旁正常肺組織為對照組。入選標本的組織學類型、分化程度及分期等均經高年資病理醫師確診。MMPAC組中男32例,女24例;年齡51~79歲,中位年齡66歲;占主要成分的腫瘤組織學分型,貼壁型2例、腺泡/乳頭型31例、實體型9例,微乳頭型14例;根據IASLC第八版國際肺癌TNM分期,Ⅰ期23例、Ⅱ期19例、Ⅲ期9例、Ⅳ期5例;無淋巴結轉移者27例,有淋巴結轉移者29例。MPP陰性組中男23例,女37例;年齡28~82歲,中位年齡63歲;占主要成分的腫瘤組織學分型,貼壁型13例、腺泡/乳頭型36例、實體型11例;根據IASLC第八版國際肺癌TNM分期,Ⅰ期29例、Ⅱ期21例、Ⅲ期7例、Ⅳ期3例;無淋巴結轉移者31例,有淋巴結轉移者29例。
1.2 方法
采用免疫組織化學SP法檢測c-Met及VEGF在各組的表達。兔抗人c-Met多克隆抗體、兔抗人VEGF單克隆抗體購自美國Santa Cruz公司,SP系列免疫組織化學檢測試劑盒及DAB試劑盒均購自北京中杉金橋生物技術有限公司。石蠟標本4 μm切片,脫蠟至水、3% H2O2封閉、高溫高壓法修復抗原、自然冷卻,滴加封閉用正常山羊血清,30 min后去山羊血清,滴加稀釋的一抗,4 ℃孵育過夜,次日復溫,滴加二抗,DAB顯,蘇木素染核,脫水,封片。結果判定:相應部位出現棕黃色或棕褐色顆粒,c-Met主要表達于細胞膜和細胞質;VEGF主要表達于細胞質。評分標準:采用半定量積分法[6]。按著色強度:未著色記0分,淺黃色為弱陽性記1分;棕黃色為陽性記2分;棕褐色為強陽性記3分;每張切片選取10個高倍視野(×400),計數陽性細胞百分比,陽性細胞所占比例小于或等于5%為0分,>5%~25%為1分,>25%~50%為2分,>50%為3分;上述兩種評分相加,≥3分為陽性,<3分為陰性。結果由2名高年資病理醫師進行盲法判讀。
1.3 統計學處理
采用SPSS22.0軟件對數據進行分析。采用χ2比較c-Met、VEGF表達各組組織中的差異。采用Spearman等級相關分析檢驗c-Met與VEGF的表達在56例MPPAC患者中的相關性。以P<0.05為差異有統計學意義。
2 結 果
2.1 MPPAC組、MPP陰性組和對照組肺組織中c-Met、VEGF的表達
c-Met陽性表達定位于細胞膜和胞質內,為棕黃色或棕褐色顆粒,其在各組中的表達情況見圖1,MPPAC組中c-Met陽性表達率為69.64%(39/56),明顯高于MPP陰性組51.67%(31/60)和對照組6.00%(3/50),差異有統計學意義(均P<0.05);VEGF表達定位于細胞質內,為棕黃色或棕褐色顆粒,其在各組中的表達情況見圖2,MPPAC組中c-Met陽性表達率為66.07%(37/56),明顯高于MPP陰性組50.00%(30/60)和對照組8.00%(4/50),差異有統計學意義(均P<0.05)。
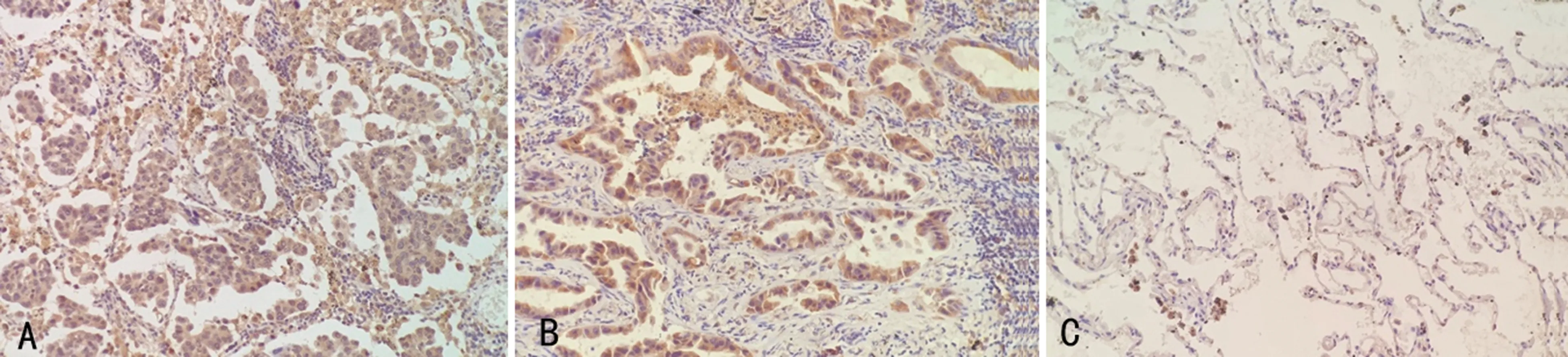
A:MPPAC組;B:MPP陰性組;C:對照組。
2.2 MPPAC組肺腺癌組織c-Met表達與VEGF的關系
本研究中,c-Met與VEGF在MPPAC組中共陽性表達36例,共陰性表達16例,經Spearman等級相關分析證明c-Met表達與VEGF表達呈正相關(r=0.783,P<0.01),見表1。
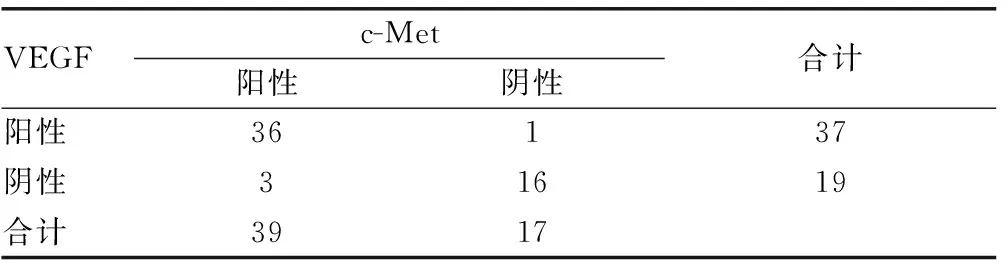
表1 MPP陽性組中c-Met與VEGF蛋白表達的關系
2.3 MPPAC組肺腺癌組織中c-Met、VEGF表達與臨床病理因素的關系
MPPAC組患者組織c-Met、VEGF的表達與腫瘤的分期及有無淋巴結轉移有關(P<0.05),而與患者性別、年齡、有無吸煙史、腫瘤大小及組織學分型無關(P>0.05),見表2。c-Met、VEGF在MPPAC組各組織學分型中的表達見圖3、4。
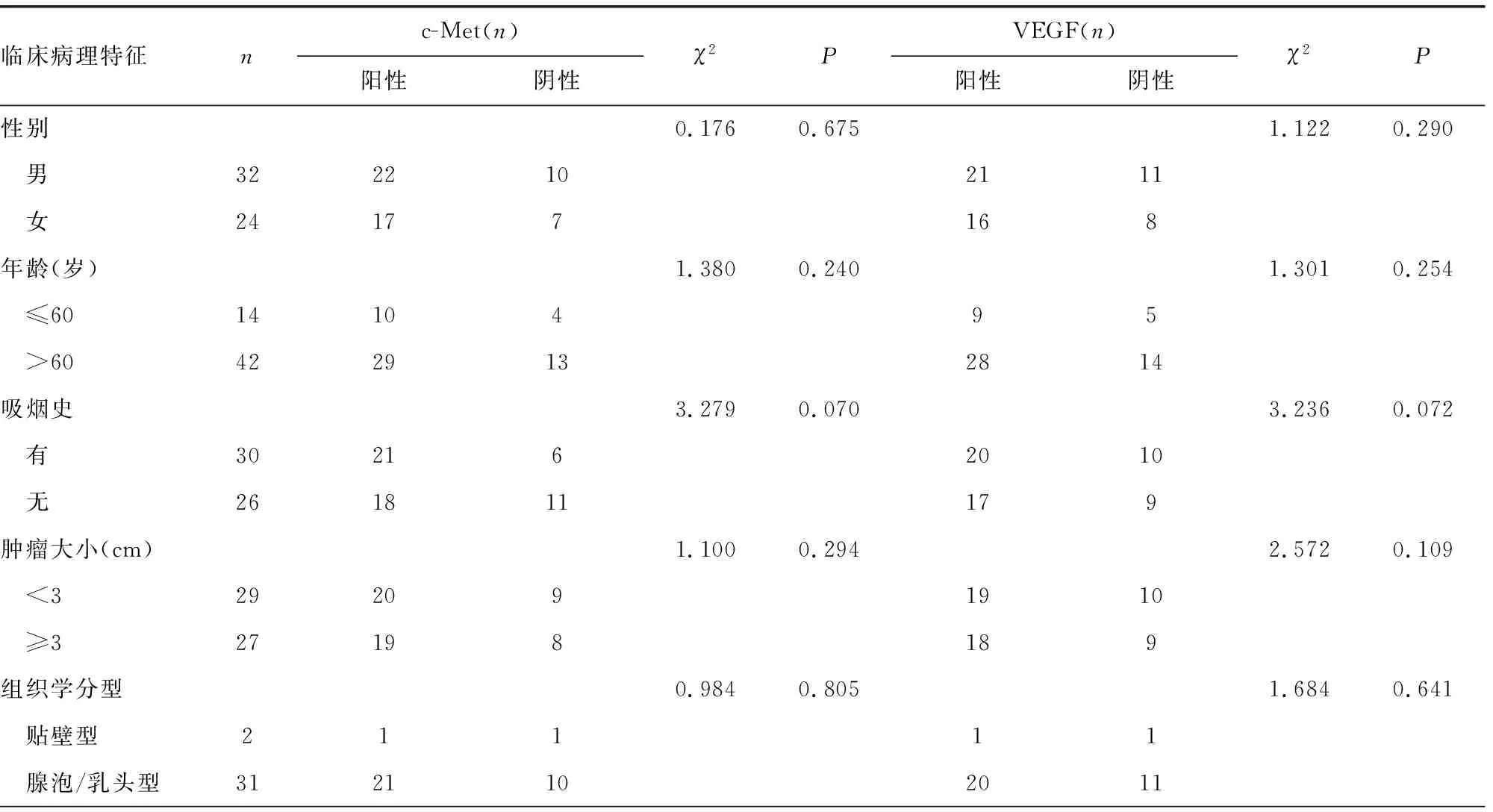
表2 MPPAC組c-Met、VEGF的表達與臨床病理因素的關系
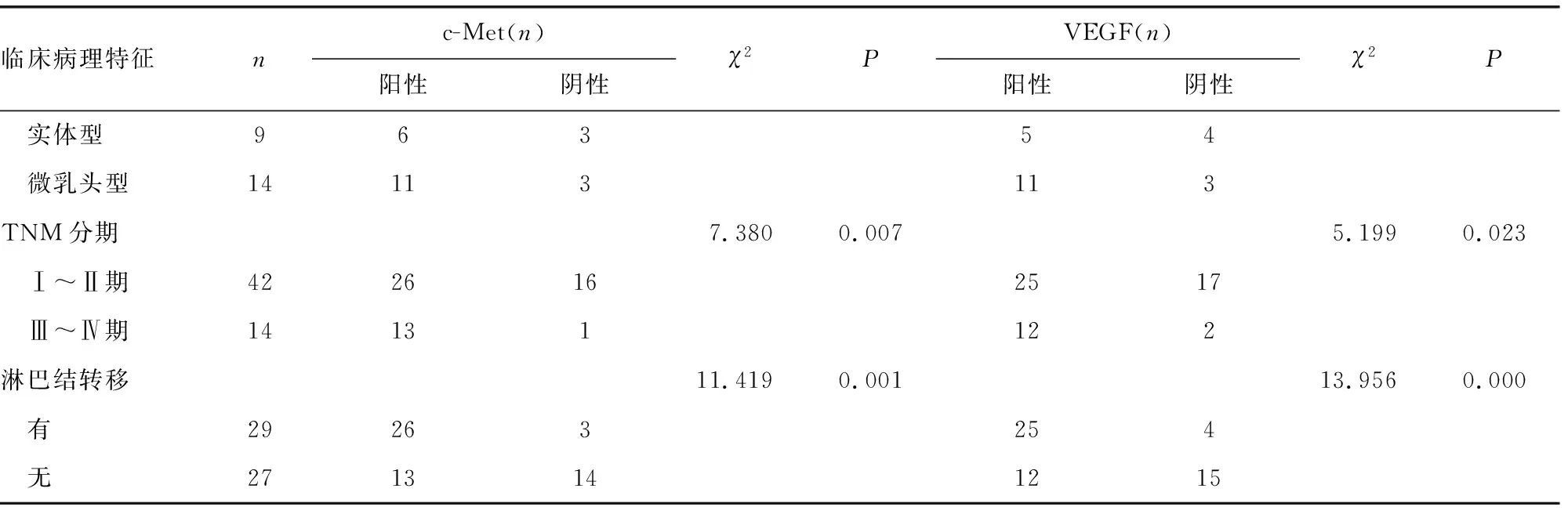
續表2 MPPAC組c-Met、VEGF的表達與臨床病理因素的關系
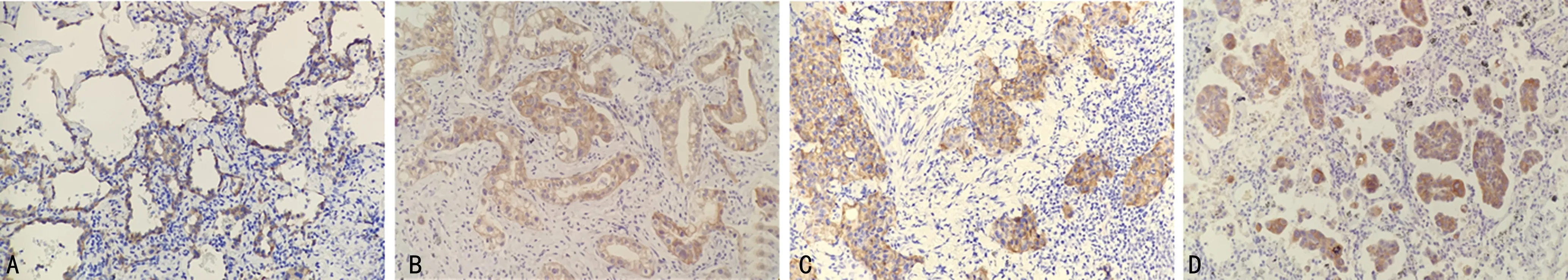
A:貼壁型;B:腺泡/乳頭型;C:實體型;D:微乳頭型。
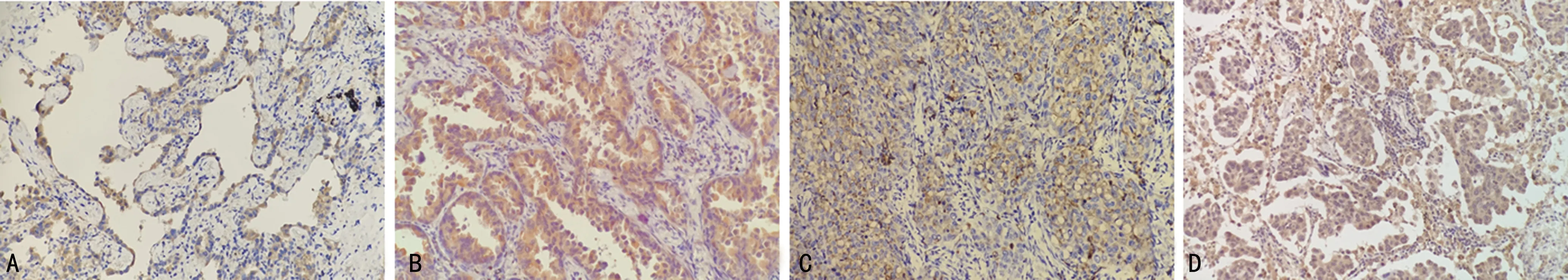
A:貼壁型;B:腺泡/乳頭型;C:實體型;D:微乳頭型。
3 討 論
肺癌是目前全球第一大癌癥,在我國肺癌的發病率和病死率居于惡性腫瘤的首位。近年來,肺腺癌發病率逐年提高。MPP作為惡性腫瘤的一種特殊的病理學形態,首先在乳腺癌中被描述,含有MPP的乳腺癌發現時臨床分期較晚,預后較差[7]。MPPAC是一類浸潤程度較強、易轉移、預后差的惡性腫瘤。MPPAC可與任何一種肺腺癌組織學亞型混合存在,至今未發現單純MPPAC報道。目前對于MPPAC的研究較少,其潛在的分子機制尚不完全明確,尋找以MPPAC為主的肺腺癌發生發展和預后相關的生物學標志物,檢測癌基因與抑癌基因產物對腫瘤的影響,以尋求有效的靶向治療成為近年來研究的熱點。
c-Met基因為一種原癌基因,為肝細胞生長因子(hepatocyte growth factor,HGF)的唯一受體,其編碼的蛋白屬于酪氨酸激酶家族成員。活化后可激活多個下游信號通路,促進細胞的增殖、分化、抑制細胞凋亡,促進腫瘤血管生成等[8]。許多腫瘤中都伴有c-Met基因的擴增和過表達,如胃癌、結腸癌[9-10]等,c-Met陽性表達的癌細胞更具有侵襲性和遠處轉移的能力[11],且有研究表明肺癌中Met基因擴增與分子靶向藥物的耐藥性相關[12]。
血管生成在腫瘤的生長、增殖及侵襲轉移過程中至關重要。VEGF是目前發現的作用最強的促血管內皮細胞增殖與生成因子之一,可較好地誘導血管新生。它與腫瘤血管內皮細胞相應受體結合后,可刺激腫瘤血管內皮增生,誘導血管生成,增加血管通透性等,為腫瘤的生長、浸潤和轉移提供物質基礎[5]。研究表明[13]具有MPP結構的腫瘤發生淋巴結轉移可能與腫瘤組織中的VEGF表達明顯升高有關。
本研究發現,c-Met、VEGF在MPPAC組肺腺癌中的表達明顯高于MPP陰性組肺腺癌及對照組肺組織,差異有統計學意義(P<0.05),且在TNM分期Ⅲ~Ⅳ期、有淋巴結轉移的肺腺癌組織中均呈高表達,差異有統計學意義(P<0.05),提示c-Met及VEGF的過表達與MPPAC的發生發展及侵襲轉移有關。且結果顯示c-Met、VEGF表達與患者的性別、年齡、吸煙史、腫瘤大小及組織學分型無明顯相關性。Spearman等級相關分析表明,c-Met表達與VEGF表達在MPPAC組肺腺癌組織中關系密切(r=0.783,P<0.01)。且c-Met表達與VEGF表達呈正相關,與文獻報道一致[14],表明在MPPAC中c-Met 與VEGF均對腫瘤的發生發展存在協同作用,兩者共同參與促進腫瘤生長、增殖及調控腫瘤血管生成。研究表明[15],c-Met活化后可促進VEGF的表達,而VEGF可促進血管內皮細胞分裂,刺激腫瘤的血管生成,故推測MPPAC易發生浸潤、淋巴結轉移及預后差可能與c-Met和VEGF在促進腫瘤血管生成方面的協同作用有關。因此,MPPAC患者中c-Met 與VEGF聯合檢測對判斷病情、指導治療、評價預后有一定價值。
綜上所述,MPPAC中c-Met、VEGF均高表達,且在有淋巴結轉移、TNM分期Ⅲ~Ⅳ期患者組織中表達更高,說明c-Met、VEGF在MPPAC的發生發展中可能起重要作用,其高表達可能增加MPPAC患者侵襲、轉移的風險,與患者生存率降低和預后差相關。c-Met表達與VEGF表達的相關性說明在MPPAC中c-Met 與VEGF均對腫瘤的發生發展起協同作用,c-Met可能通過促進VEGF的表達,從而促進腫瘤的增殖、遷移、侵襲及血管再生等。提示c-Met、VEGF的測定可以作為MPPAC發生發展的潛在生物標志物,對MPPAC的惡性程度及預后情況作出更加準確的判斷,為臨床診斷與治療提供依據。c-Met、VEGF信號通路可成為MPPAC治療中很有前途的靶點,抑制c-Met、VEGF的表達或許能夠延長MPPAC患者復發時間,提升總體生存期。

