雙膦酸鹽治療原發(fā)性骨質(zhì)疏松癥的研究進展
李奕玉 關(guān)雅心 吳斌
昆明醫(yī)科大學第一附屬醫(yī)院內(nèi)分泌一科(昆明650032)
骨質(zhì)疏松癥(osteoporosis,OP)是一種因低骨量、骨組織微結(jié)構(gòu)損壞導致骨脆性增加,以易發(fā)生骨折為特征的全身性疾病。骨質(zhì)疏松性骨折又稱脆性骨折,好發(fā)于椎骨、髖部和橈骨遠端,髖部骨折是最嚴重的骨折[1]。研究表明,我國60 歲以上人口達2.1億,OP患病率為36%,其中男性23%,女性49%,截止2010年,我國骨質(zhì)疏松性骨折數(shù)量達233 萬,其中髖部骨折36 萬,椎體骨折111 萬[2]。骨質(zhì)疏松性骨折是老年患者致死和致殘的主要原因,給家庭及社會帶來沉重的生活壓力和經(jīng)濟負擔,OP 已然成為日益關(guān)注的公共健康問題。
骨組織是由骨細胞、成骨細胞、破骨細胞等細胞組成的一類具有高度代謝活性的組織,處于成骨細胞介導的骨形成和破骨細胞介導的骨吸收的動態(tài)平衡過程,稱為骨重建[3]。骨重建過程受骨細胞調(diào)節(jié)作用,其機制十分復雜,其中包括cbfα?1、Wnt/β?catenin、RANKL/RANK/OPG 等信號通路[4]。當骨吸收作用大于骨形成作用時則發(fā)生OP,目前根據(jù)對骨細胞的作用機制可將抗OP 藥物大致分為骨吸收抑制劑、骨形成促進劑和骨代謝調(diào)節(jié)劑。近年來越來越多的作用于信號通路的抗OP藥物相繼問世,如RANKL 抑制劑、硬化蛋白抗體等。除以上分子調(diào)節(jié)水平機制外,越來越多的研究證明miRNA 也通過調(diào)節(jié)骨細胞、促進骨分化參與骨重建過程,miRNA 作用機制的發(fā)現(xiàn)為OP 的診斷及新型抗OP 藥物的研制提供了依據(jù)[5-6]。
盡管新型抗OP 藥物不斷問世,但雙膦酸鹽(bisphosphonates,BPs)仍是目前臨床上使用最廣泛的骨吸收抑制劑,在抗骨折治療上有不可忽視的作用,最近BPs 再次被各國權(quán)威指南推薦作為部分骨折患者的初始治療方案[7]。本文將對幾種常見的BPs 的作用機制、藥代動力學、臨床療效及安全性進行總結(jié)分析,為醫(yī)務(wù)工作者正確合理使用BPs 提供參考。
1 雙膦酸鹽分子結(jié)構(gòu)及作用機制
1.1 雙膦酸鹽分子結(jié)構(gòu)無機焦磷酸鹽是一種天然存在于血清和尿液中的生物合成反應產(chǎn)物,它的氧原子(P?O?P)被碳原子取代(P?C?P)后形成BPs(圖1)。P?C?P 與骨礦物羥基磷灰石(HAP)結(jié)合,是BPs 抑制骨吸收的必要條件,R1 側(cè)鏈取代基主要參與BPs 與HAP 的結(jié)合,R2 側(cè)鏈取代基對BPs 抗骨吸收活性有重要的作用。第一代BPs 抗骨吸收作用較弱,通過不斷地研究發(fā)現(xiàn)進一步延長R2 側(cè)鏈長度或引入環(huán)狀結(jié)構(gòu)時可增強藥物活性,從而研制出第二、三代雙膦酸鹽(表1)[8]。
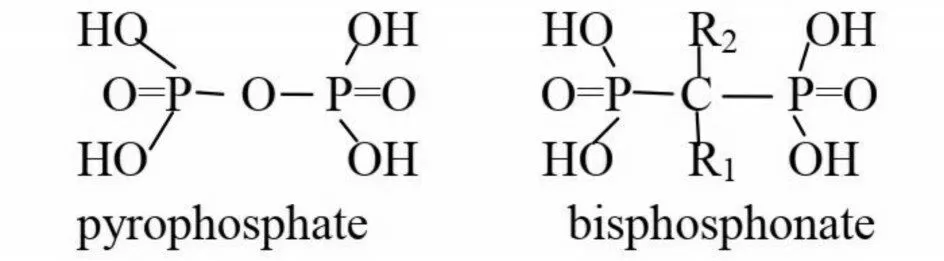
圖1 無機焦磷酸鹽(左)和雙膦酸鹽(右)分子結(jié)構(gòu)Fig.1 The molecular structure of pyrophosphate(left)and bisphosphonate(right)
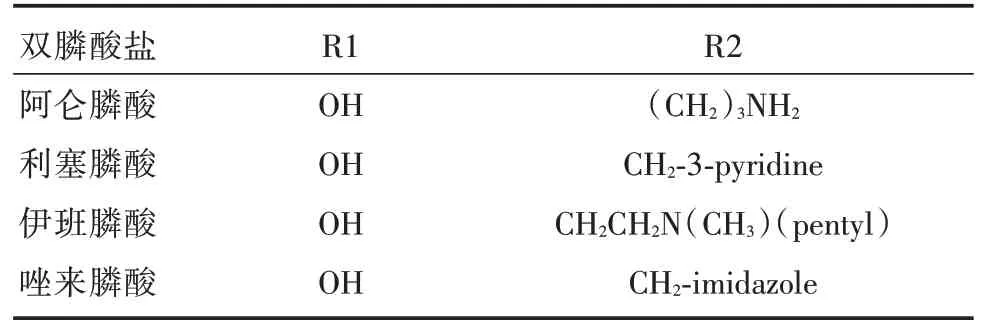
表1 常見雙膦酸鹽分子結(jié)構(gòu)式[8]Tab.1 The molecular structure of some bisphosphonates
1.2 雙膦酸鹽分子作用機制常見的幾種BPs,如阿侖膦酸(alendronate,ALN)、伊班膦酸(ibandro?nate,IBN)、利塞膦酸(risedronato ,RIS)、唑來膦酸(zoledronic acid,ZOL)均屬于含氮BPs(nitrogen?containing bisphosphonate,N?BPs)。N?BPs 通過抑制破骨細胞功能,從而抑制骨吸收,作用機制為:(1)抑制甲羥戊酸?膽固醇合成途徑中的法尼基二磷酸合成酶(farnesyl pyrophosphate synthase,F(xiàn)PPS)活性;(2)破壞破骨細胞功能必不可少的蛋白質(zhì)的異戊烯酸酯化(脂化作用);(3)干擾骨微絨毛襯界面上吸收所需的GTPase 信號蛋白;(4)ZOL 還被代謝為ATP 類似物三磷酸1?腺苷50?基酯3?(3?甲基丁?3?烯基)酯,該酯抑制腺嘌呤核苷酸的轉(zhuǎn)移酶(調(diào)節(jié)線粒體中的ADP/ATP 交換)[9]。N?BPs 抑制FPPS 活性是其抗骨吸收最主要的機制,研究表明各N?BPs 效價排序依次為ZOL>RIS>IBN>ALN[10]。
2 藥代動力學
BPs 藥代動力學參數(shù)見表2。
2.1 吸收目前臨床上可通過口服或靜脈給予BPs。口服BPs 通過兩種途徑從胃腸道吸收進入血液:(1)細胞外運輸,通過上皮細胞進入血液;(2)細胞間運輸,通過上皮細胞間的緊密連接進入血液。BPs 的口服生物利用度很低,靜脈給藥直接進入血液,生物利用度明顯較口服利用度高[11]。
2.2 分布BPs 進入血液后,40%~60%的劑量被骨組織吸收,也有一部分被軟組織吸收(如肝臟、脾臟)[12]。
2.3 代謝BPs 由于其P?C?P 主鏈的穩(wěn)定性和水溶性性質(zhì),在體內(nèi)穩(wěn)定,不發(fā)生水解,最終以原形從腎臟排出。
2.4 清除進入機體附著于骨礦物質(zhì)表面的BPs,在骨吸收過程中可被破骨細胞攝取或繼續(xù)附著于骨礦物質(zhì)表面,且在骨形成過程中可嵌入骨骼中,因此骨骼中的BPs 清除非常緩慢。而未被骨組織吸收的BPs 在24 h 內(nèi)幾乎完全通過腎臟排出,僅有約0.5%的劑量會保留在腎組織中[12]。
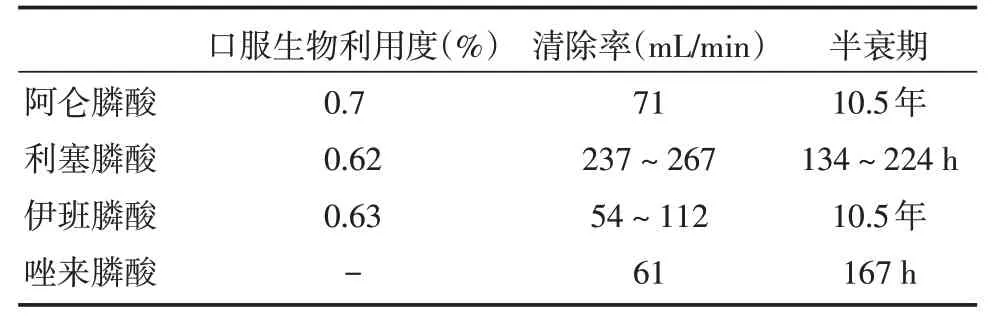
表2 BPs 藥代動力學參數(shù)[13-15]Tab.2 The pharmacokinetic parameters of some bisphosphonates
3 臨床療效
3.1 ALNBLACK 等[16]研究中納入了2 027 例絕經(jīng)后婦女,隨機分配為安慰劑組和ALN 組(開始時每天5 mg,24 個月后每天10 mg),3年研究結(jié)束后ALN 組股骨頸、全髖關(guān)節(jié)、后腰椎、全身骨密度分別增加了4.1%、4.7%、6.5%、1.8%;椎體骨折風險降低47%。FLEX 研究中ALN 組和安慰劑組腰椎骨密度分別增加了5.26%、1.52%,全髖關(guān)節(jié)骨密度分別下降了1.02%、3.38%;椎體骨折在安慰劑組中更常見,但差異無統(tǒng)計學意義[17]。
3.2 IBNCHESNUT 等[18]研究中納入了296 例絕經(jīng)后婦女,隨機分配為安慰劑組或IBN 組(每天2.5 mg 或每次20 mg,隔天1 次,3 個月共12 次)。3年研究結(jié)束后,IBN 組椎體骨折風險分別降低了62%和50%,腰椎骨密度分別增加了6.5%和5.7%。對降低非椎體骨折以及髖部骨折風險,尚無明確證據(jù)。REGINSTER 等[19]研究納入了1 609例絕經(jīng)后婦女,隨機分配為安慰劑組或IBN 組(每日2.5 mg、每月50 mg、每月100 mg、每月150 mg)。2年研究結(jié)束后,IBN組腰椎骨密度分別增加了5.0%、5.3%、5.6%、6.6%,股骨近端骨密度也明顯增加。EIS?MAN 等[20]研究中將1 395 例受試對象隨機分配為IBN 組(每兩個月2 mg 或每3 個月3 mg 靜脈注射)和安慰劑組(每日口服2.5 mg),2年研究結(jié)束后各治療方案腰椎骨密度分別增加了6.4%、6.3%、4.8%。HAGION 等[21]的研究亦證明了靜脈注射方案較口服治療方案效果顯著。
3.3 RISHARRIS 等[22]研究中將受試者隨機分配為RIS 組(每日5 mg)和安慰劑組。3年研究結(jié)束后RIS 組腰椎、股骨頸、股骨粗隆骨密度分別增加了5.4%、3.3%、1.6%;椎體、非椎體骨折風險分別降低了49%、39%。SORENSEN 等[23]研究(VERT?MN)中,RIS 組股骨轉(zhuǎn)子骨密度分別增加了9.3%、2.2%、5.7%,髖部骨密度維持穩(wěn)定;椎體、非椎體骨折風險分別降低了59%、41%,未觀察到髖部、腰椎、股骨頸骨折。MELLSTR?M 等[24]研究(VERT?MN)中,RIS 組腰椎、全髖、股骨頸、股骨粗隆骨密度分別增加了11.5%、3.9%、3.2%、6.1%;新椎體骨折年發(fā)生率與安慰劑組相似(3.8%)。
3.4 ZOLBLACK 等[25]在HORIZON?PFT 試驗中,ZOL 組(Z3)和安慰劑組隨訪3年后,Z3 組腰椎、髖部、股骨頸骨密度分別增加了6.71%、6.02%、5.06%;椎體、髖部、非椎體、臨床椎體、臨床骨折風險分別降低了70%、41%、25%、77%、33%。第1 次擴展研究中,ZOL 組(Z6)和安慰劑組(Z3P3)腰椎、股骨頸骨密度分別增加了12.1%、4.5%和10.1%、3.1%,椎體骨折風險分別降低了6.2%、3.0%,非椎體骨折、髖部骨折、臨床椎體骨折、臨床骨折發(fā)生率無顯著差異[26]。第2 次擴展研究中,ZOL 組(Z9)和安慰劑組(Z6P3)椎體形態(tài)骨折、臨床骨折發(fā)生率無顯著差異[17,27]。XU 等[28]對絕經(jīng)后OP 患者的研究亦證明ZOL 能顯著能提高骨密度、降低骨折風險。通過以上各項研究分析發(fā)現(xiàn)各BPs 均可有效地預防骨折,但效價存在一定的差異。根據(jù)上述及其他研究可對各BPs 給藥方案進行歸納總結(jié),并推論出各種BPs 最有效的給藥方案(表3)。

表3 幾種BPs 類的給藥方案[29-30]Tab.3 Dosing regimens of several bisphosphonates
4 不良反應
4.1 急性期反應(acute phase reaction,APR)APR 是指靜脈注射BPs 后出現(xiàn)的短暫的類似輕至中度的流感樣癥狀,通常在72 h 內(nèi)消失,一般不超過1 周。APR 發(fā)生機制主要為:FPPS 活性抑制后導致外周血單核細胞中異戊烯基二磷酸(IPP)蓄積,并大量激活γδT 細胞,導致促炎性細胞因子(腫瘤壞死因子?a、白細胞介素?6、干擾素?c)的釋放[33]。非甾體類抗炎藥可顯著降低APR 的發(fā)生率和嚴重程度,因此建議首次接受BPs 治療的患者可提前使用該類藥物[34]。
4.2 胃腸道副作用胃腸道副作用主要是由藥物刺激上消化道黏膜所致,癥狀包括食道刺激、吞咽困難和胃灼熱。一項隨機對照試驗結(jié)果顯示對照組與試驗組的上消化道事件發(fā)生率相似[35]。當已存在食管狹窄、嚴重的胃食管反流、失弛緩癥等胃腸道疾病時,應謹慎使用口服BPs。
4.3 腎毒性腎毒性主要發(fā)生于靜脈給藥。研究表明ZOL 對FPPS 的抑制使異戊二烯化蛋白水平降低,導致Na+?K+?ATP 酶功能降低,最終導致細胞凋亡;CHENG 等[36]研究亦證實ZOL 可激活HK?2細胞中TGFβ介導的多種信號通路導致腎毒性。因此美國FDA 提出若GFR <30 mL/min,禁用IBN;若GFR <35 mL/min,禁用ZOL。
4.4 BPs 相關(guān)頜骨骨壞死(bisphosphonate?indu?ced osteonecrosis of the jaws,BIONJ)BIONJ 是指無顱面輻射史的患者,且使用過BPs 后頜骨暴露持續(xù)超過8 周未愈合[37]。ZIRK 等[38]的研究表明BIONJ 的發(fā)病機制與BPs 抑制破骨細胞功能、頜骨血供減少及口腔放線菌定植有關(guān)。流行病學數(shù)據(jù)表明,口服或靜脈注射BPs 患者中頜骨骨壞死的發(fā)病率在1∶10 000 到1∶100 000 之間[39]。MARA?KA 等[35]研究顯示,使用與未使用BPs 的OP 患者發(fā)生頜骨骨壞死的風險相似。
4.5 非典型骨折(atypical femoral fractures,AFF)AFF 是指發(fā)生在轉(zhuǎn)子下或股骨干區(qū)的創(chuàng)傷性骨折,其影像學特征為存在橫向骨折和皮質(zhì)增厚[39]。近期研究表明長期使用BPs可嚴重抑制骨轉(zhuǎn)換,阻止微損傷修復,引起AFF[40]。一項研究發(fā)現(xiàn)美國患者在使用BPs 0.1 ~1.9年時AFF發(fā)生率為1.78/10 萬,8~9.9年時AFF 發(fā)生率為131.1/10 萬,表明BPs 使用時間越長,風險越大[41]。也有報道顯示在現(xiàn)有BPs中,口服ALN時AFF發(fā)生率更高[42]。
4.6 心房顫動(atrial fibrillation,AF)OP 患者接受BPs 治療比未接受BPs 治療的AF 發(fā)生率高,在HORIZON?PFT 中Z3 組(1.3%)的嚴重AF 事件風險顯著高于安慰劑組(0.5%)[35]。其機制主要是BPs 誘導炎癥因子釋放,導致心房重構(gòu)和心肌纖維化,增加AF 風險[43]。然而最近研究表明,BPs 可能通過抑制纖維化心肌重構(gòu)而具有抗心律失常作用,因此BPs 與AF 之間的關(guān)系存在爭議[44]。由上述分析來看APR、腎毒性主要發(fā)生在IBN、ZOL 靜脈注射時,胃腸道不良反應主要發(fā)生在口服RIS、IBN、ALN 時,BIONJ、AFF、AF 在四種藥物靜脈注射或口服時均可發(fā)生。
由于胃腸道不良反應,口服BPs 時要求空腹服用,用200 ~300 mL 白水送服,服藥后30 min 內(nèi)避免平臥,應保持直立體位(站立或坐立),還應避免進食牛奶、果汁等任何食品和藥品[1]。鑒于用藥方案較為復雜,部分患者依從性明顯降低,經(jīng)對比靜脈給藥方案不僅可以避免胃腸道不良反應,還可以提高患者依從性。
5 藥物假期
藥物假期是指在連續(xù)使用BPs 治療一段時間后暫停使用,觀察一段時間,再考慮是否繼續(xù)接受治療。它的目的主要基于兩點:(1)BPs 骨骼半衰期長;(2)停止治療可減少罕見嚴重不良事件的發(fā)生率。美國骨骼和礦物質(zhì)研究協(xié)會(ASBMR)推薦若患者骨折風險較低(T ≥-2.5),在口服BPs 治療5年后或靜脈注射BPs 治療3年后,無新發(fā)骨折、新的骨折危險因素、明顯的骨密度下降,可考慮進入藥物假期;若患者骨折風險高(T <-2.5),在口服BPs 治療10年后或靜脈注射BPs 治療6年后,無新發(fā)骨折、新的骨折危險因素、明顯的骨密度下降,可考慮進入藥物假期[17]。
美國臨床內(nèi)分泌學家協(xié)會和美國內(nèi)分泌學院(AACE/ACE)建議如果患者發(fā)生脆性骨折或骨密度顯著下降,可恢復治療。據(jù)統(tǒng)計,15%的患者進入藥物假期后在第4年和第5年骨質(zhì)疏松性骨折的發(fā)生率再次明顯升高,因此停藥一定時間后應重新評估骨折風險,以確定是否需要繼續(xù)抗OP治療[45]。
6 總結(jié)與展望
BPs 抗骨折效果顯著、不良反應發(fā)生率低,是目前臨床上使用的最廣泛的抗OP 藥物之一。然而對于BPs 的治療周期、何時進入藥物假期以及再次啟動治療的時機,我國尚無明確的指南予以推薦,因此今后需要進行大量臨床研究探索上述問題。此外隨著新型抗OP 藥物的不斷問世,BPs與新型抗OP 藥物的聯(lián)合應用、序貫治療等方面值得進一步關(guān)注探索。

