阿帕替尼聯合XELOX 方案化療一線治療晚期結直腸癌的臨床經驗分析
李綺云,李太東,勞逸,吳興煥,梁發,陳俊彥,張邇瓊
(廣東省農墾中心醫院,廣東 湛江 524002)
0 引言
隨著人們飲食結構的不斷變化,我國結直腸癌的發病率逐步提升,嚴重危害了人類的生活質量、加重了社會負擔[1]。外科根治手術為治療本病的最佳方案,但大量臨床文獻論證,晚期結腸癌患者的術后復發率較高,無法達到理想狀態,在術后6 個月復發率可達50%-60%,且生存期限常在12 月內[2]。以XELOX 為主導的化療方案在針對體內殘余癌細胞外,對正常細胞也存在不同程度的損害,同時易引發骨髓抑制等副作用,對患者的免疫功能,身體機能,生活質量造成不可避免的傷害,甚至導致治療的終止,且晚期治療效果差,化療已達瓶頸,故如何提高結直腸癌治療療效是目前重要問題[3]。近年來血管內皮生長因子VEGF 的發現,使較多的研究者認識到VEGF 是刺激血管形成的重要生長因子,而新生血管的生成則導致腫瘤的生長和轉移[4,5]。阿帕替尼是一種小分子血管內皮生長因子受體-酪氨酸激酶抑制劑,其作用于細胞內VEGFR-2 的 ATP 結合位點,通過抑制腫瘤新血管生成而達到抑制腫瘤作用[6]。目前廣泛用于胃癌晚期治療,且取得較好療效,而阿帕替尼在腸癌治療中少有報道。故本研究通過3 組病例報告分析總結阿帕替尼聯合化療治療晚期結直腸癌的效果,現做如下報道。
1 病例報告1
患者為54 歲女性,既往史:于2015 年7 月28 日“因反復解粘液血便2 月”在外院確診為直腸癌而行直腸癌根治術,術后病理示直腸中分化腺癌,侵犯漿膜下,淋巴結轉移(3/15),術后予以化療2 程,以后拒絕繼續化療,自服中藥治療。2018 年11 月始出現咳嗽、氣促,現于2019 年2 月13 日在我院全腹部CT 示:直腸癌術后改變;胸部CT 平掃+增強:①左鎖骨上區、縱隔及雙肺門淋巴結轉移;②雙肺多發類結節影,最大者約2cm×2.1cm,考慮為轉移;③左肺上葉及下葉內前基底段約5.3cm×5.1cm,考慮為轉移、周圍阻塞性炎癥并節段性肺不張。纖維支纖鏡活檢病理提示腺癌,符合腸道來源。2019 年2 月13 日至2019 年6 月29 日予以XELOX 方案(奧沙利鉑160mg d1+卡培他濱1.5mg Bid d1-14 口服)化療+口服阿帕替尼靶向治療(500mg qd)6 程,2 程治療后癥狀消失。治療后復查結果:2019 年4 月9 日胸部CT:①左鎖骨上區、縱隔及雙肺門淋巴結轉移,較前明顯縮小。②雙肺多發轉移瘤,較前縮小、部分消失。③左肺上葉及下葉內前基底段考慮為轉移、周圍阻塞性炎癥并節段性肺不張,4.7cm×4.2cm,較前明顯縮小、減少,左上肺病灶部分見空洞。2019 年7 月18 日胸部CT 復查原轉移瘤進一步縮小、減少。以后不同意繼續治療。2020 年1 月下旬出現咳嗽、氣促,2 月12 日胸部CT 雙肺見多發病灶,較前明顯增大、增多,其最大者位于左肺下葉,范圍約9.2cm×7.1cm,左肺組織不張。予以對癥治療,患者及家屬不同意進一步治療,2 月27 日自動出院。隨訪13 個月。
病程期間CEA、CA125、CA199 結果如下:2019 年2 月患者 檢 測CEA 水 平 為7.11ng/mL,CA125 水 平 為67.291U/mL,CA19-9 水平為115.612U/mL,經XELOX 方案+阿帕替尼治療后,腫瘤縮小或部分消失,其中左上肺轉移灶部分形成空洞,CEA、CA125、CA19-9 逐漸下降;2019 年7 月20 日患者檢測CEA 水平為3.6ng/mL,CA125 水平為15.27U/mL,CA19-9 水平為22.34U/mL;2020 年2 月9 日 復 查CEA 水 平 為69.2ng/mL,CA125 水平為105.5U/mL,CA19-9 為700.16U/mL,較前明顯升高,尤以CA19-9 升高為著,2020 年2 月12 日胸部CT 雙肺見多發病灶,較前明顯增大、增多,其最大者位于左肺下葉,范圍約9.2cm×7.1cm,左肺組織不張。詳見圖1。
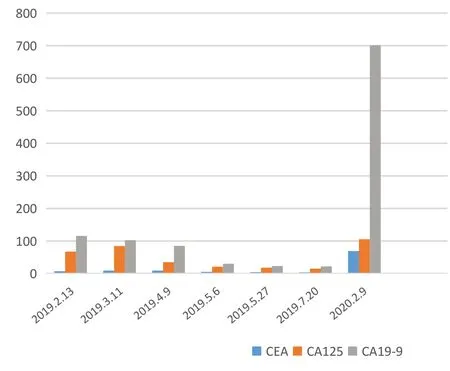
圖1 病例一患者治療期間血清CEA、CA125、CA19-9 變化情況
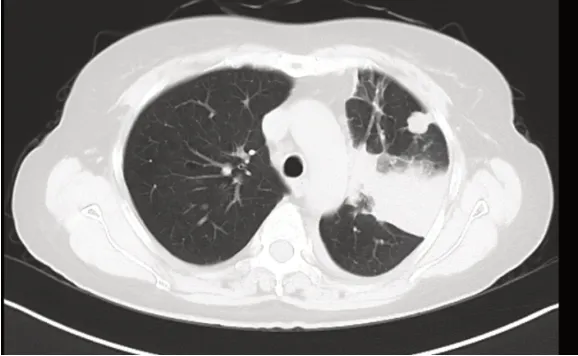
圖2 病例一治療前CT 影像
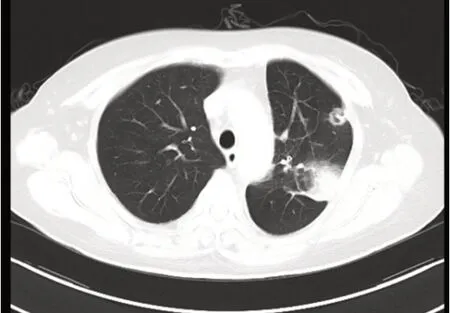
圖3 病例一2 療程治療后CT 影像

圖4 病例二患者治療期間血清CEA 變化情況
2 病例報告2
患者為46 歲男性。既往史:患者因“排粘液血便1 月”于2015 年4 月上旬行電子腸鏡檢查示:直腸中分化腺癌。2015 年4 月18 日在我院外科行腹腔鏡下直腸癌根治術,術后病理示:直腸管狀腺癌Ⅱ級,浸潤淺肌層,上、下切緣及中間淋巴結(0/6)、中央淋巴結(0/5)、直腸旁淋巴結(0/5) 未見癌轉移。術后診斷直腸管狀腺癌PT2N0MO( Ⅰ期),術后予以對癥治療,定期復查。2018 年3 月28 日查胸部CT 示:左肺上葉多發小結節影( 最大者大小約6mm×7mm),考慮為轉移瘤。建議行胸腔鏡左上肺葉切除術,患者及家屬不同意手術。診斷為rT0N0M1a( Ⅳa 期)。2018 年5 月7 日接受系統治療,開始給予XELOX 方案( 奧沙利鉑 mg 靜滴+ 卡培他濱1.5mg bid 口服) 化療+ 阿帕替尼(500mg /d 口服) 靶向抗腫瘤治療,至8 月13 日共6 程。治療后于2018年6 月21 日復查,CT 示左肺上葉轉移瘤較前縮小,最大者大小約3mm×5mm。2018 年8 月10 日CT 示左肺上葉多發小結節影,考慮為轉移瘤,較前未見變化。2018 年9 月8日開始口服卡培他濱1.5mg bid d1-14+ 阿帕替尼250mg/d 維持治療11 程,過程順利。以后復查評估為均為SD。2019 年8 月開始改予阿帕替尼250mg/d 單藥維持治療。2020 年4 月14 日復查,CT 示左肺上葉多發小結節影,較前未見變化。患者自復發轉移治療至今總生存期24 個月,生活質量較好。
病程期間患者血清CEA 變化情況詳見圖4。
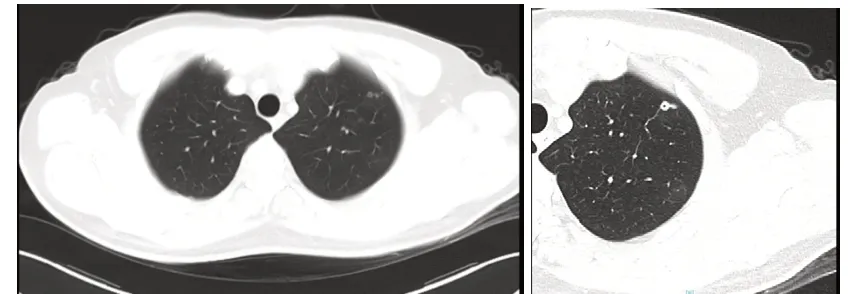
圖5 病例二治療前CT 影像
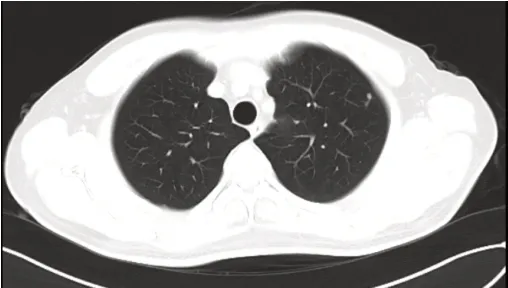
圖6 病例二 2 程治療后CT 影像
3 病例報告3
患者為50 歲男性。既往史:患者訴于2019 年2 月13 日因“中腹痛、排便異常半年”來我院行電子腸鏡示回盲部癌。于2019 年2 月21 日接受腹腔鏡下行回盲部癌姑息切除+腸粘連松解+腹壁腫物切除+腹腔引流術。術中見回盲部癌外侵漿肌層并梗阻,腫物外侵右側輸尿管,大網膜并腹腔內臟器、腹壁多發種植轉移瘤,予姑息切除回盲部腫物,解除腸梗阻,行遠端回腸-橫結腸側側吻合。術后病理示:回盲部粘液腺癌,浸潤全層;大網膜、腹膜、闌尾見粘液腺癌浸潤。免疫組化:CEA(+),CK20(+),MLH1(+),MSH2(+),MSH6(+),PMS2(+),HER2(-)。診斷回盲部粘液腺癌姑息術后PT4N2M1c(Ⅳc 期)。2019 年3 月15 日復查,腹部CT 示:①回盲部粘液腺癌術后復查,回盲部吻合口區腸管增厚,相鄰腸管粘連,考慮為術后瘢痕伴周圍腸系膜粘連可能,右中下腹膜及后腹膜增厚,腹腔腸系膜、大網膜見多發大小不等淋巴結,均考慮為轉移。②膀胱直腸陷凹團塊狀軟組織影,考慮為轉移瘤,并侵犯右側輸尿管下段、直腸、前列腺及雙側精囊腺,右側輸尿管及右腎盂腎盞輕度積水。2019 年03 月29 日在局麻下行經尿道右側輸尿管支架管置入術,不同意化療。2019 年6 月復查CT 評估為病灶穩定。2019 年6 月始至2019 年11 月予以XELOX 方案(奧沙利鉑160mg d1+卡培他濱1.5mg Bid d1-14 口服)+阿帕替尼治療8 程。2019 年12 月18 日復查MR 評價為SD,于2019-12-20 至2020-1-10 予卡培他濱+阿帕替尼維持治療2 程。2020 年2 月出現下腹部疼痛,2020 年2 月17 日復查,全腹部MRI 示:①肝包膜、腹腔腸系膜、大網膜多發結節異常信號較前增多、增大,均考慮為轉移。②膀胱直腸凹不規則軟組織,考慮轉移瘤,累及右側輸尿管下段,直腸前壁及雙側精囊腺,較前增大。于2020-02-25 至2020-04-15 改用CapIRI方案(伊立替康+5-氟尿嘧啶)姑息化療+貝伐珠單抗治療3周期。現下腹部疼痛不明顯。從第一次治療開始至疾病進展期(PFS)為6 個月。期間患者出現手足綜合征Ⅰ度,阿帕替尼劑量無需調整。

圖7 病例三患者治療期間血清血清CA125、CA19-9 變化情況
病程期間患者血清CA125、CA19-9 變化情況詳見圖3。

圖8 治療前CT 影像

圖9 2 程治療后CT 影像
4 病例分析與討論
結直腸癌在起病初期常無顯著臨床表現,故患者常在出現特征性臨床表現后才發現,但多數已發展至晚期,此時患者體內存留大量腫瘤細胞,故化療是中晚期結腸癌患者推薦的常用治療方案,其中以XELOX 化療方案的臨床應用率最高[7]。病例中應用XELOX 方案主要由奧沙利鉑、卡培他濱聯合治療而成。奧沙利鉑是順鉑及卡鉑藥物的升級版,其優勢是抗癌作用更強,更容易在體內溶解,毒副作用更少,其機制可能與控制癌細胞DNA 復制及轉錄有關。卡倍他濱是一種口服的細胞毒類藥物,口服后完整地通過胃腸壁,經肝臟羧酸酯酶催化代謝為5’-脫氧-5-氟胞苷(5’-DFCR),經肝臟和腫瘤細胞中的胞苷脫氨酶催化轉化為5’-脫氧一氟尿 嘧啶(5’-DFUR),經胸苷酸磷酸酶(TP,在腫瘤組織中濃度較高)催化為5-Fu。XELOX方案藥物在其殺滅腫瘤細胞的同時會對正常細胞造成不可避免的傷害,從而引起胃腸道反應、骨髓功能異常等不良反應,增加患者的痛苦。阿帕替尼是一種小分子血管內皮生長因子受體-酪氨酸激酶抑制劑,其作用于細胞內 VEGFR-2 的 ATP 結合位點,通過抑制腫瘤新血管生成而達到抑制腫瘤作用[9]。
阿帕替尼可切斷VEGF 傳輸信號,對腫瘤細胞的血管生成起抑制作用。此外體外醫學實驗證實,阿帕替尼可對c-Kit、c-src 等酪氨酸激酶有一定的滅活效應,可抑制癌癥小鼠的細胞增值,控制細胞遷移,對形成小鼠主動脈環的擴張有抑制作用[10]。從病例報告1-3 中可發現,在經過阿帕替尼聯合化療的治療方案應用患者CEA、CA125、CA19-9 水平明顯降低,提示在化療基礎上加用阿帕替尼可明顯改善晚期結直腸癌臨床療效,患者癌癥指標下降更為明顯。在安全性方面,有研究證實,繼發性高血壓、手足綜合征為阿帕替尼常見副作用[11]。手足綜合征是該藥抑制腫瘤新生血管后皮膚血管重建減少所引發[12]。而繼發性高血壓的發生機制尚未清楚,可能是在正常細胞內VEGF 對人體正常血壓起維持作用[13]。在本研究中,病例1 采用阿帕替尼聯合XELOX 方案化療2 程后肺轉移灶縮小且出現空洞,以后出現肺內病灶吸收好轉,其原因可能與血管內皮抑制劑之作用使腫瘤周圍微環境暫時性正常化,抑制腫瘤轉移能力提升,此時藥物滲透入腫瘤的濃度增加以達到化療增效,使腫瘤血管減少致退縮形成空洞可能有關[14],病例2 和3 出現不良反應手足綜合征,提示患者可能加用阿帕替尼后可能出現類似于手足綜合征的一系列并發癥,故應針對此類并發癥進行預防與干預。
綜上,通過3 組病例提示阿帕替尼聯合化療治療晚期結直腸癌療效確切,患者血清CEA、C125、CA19-9 隨著治療好轉而出現不同程度的下降,且小分子血管內皮抑制劑易使化療藥物滲入腫瘤內而發揮抑癌作用,值得臨床應用與深入研究,阿帕替尼的應用仍有手足綜合征等不良反應存在,故在治療中應持續監測,做好預防及治療。

