飲用水中銅綠假單胞菌檢測結果的 不確定度評定
◎ 田 浩,李光耀,張 凡,王 杰,史笑娜,馬驍杰,楊少淼
(1.河北東淼檢測科技股份有限公司,河北 保定 071000;2.河北納微環境檢測有限公司,河北 保定 071000)
2015 年5 月實施的《食品安全國家標準 包裝飲用水》(GB 19298—2014)中增加了銅綠假單胞菌(Pseudomonas aeruginosa)限量,而不再使用傳統的菌落總數指標對包裝飲用水的衛生情況進行評價。根據國內外的研究情況,Nagaveni 等在匈牙利國內492 份成品水中的7 份檢出銅綠假單胞菌,該菌的污染率為1.4%[1];魏磊等在中國9 個省36 家水廠采集的108 個包裝飲用水樣品中銅綠假單胞菌的污染率達到了5.6%[2]。
銅綠假單胞菌分布廣泛,對有機營養要求較低,對不良環境抵抗力強,世界衛生組織(WHO)將其列為人類皮膚污染指示菌;HACCP(Hazard Analysis Critical Control Point)評估明確指出其是嬰兒瓶裝飲用水的危害指示菌,可造成嬰兒腹瀉[3]。由此可知,生活飲用水中的銅綠假單胞菌是一種污染率較高、危害較為嚴重的衛生指示菌。
《檢測和校準實驗室能力的通用要求》(ISO/IEC17025:2005)明確要求認可實驗室需評定和報告測量不確定度[4];《測量不確定度的要求》(CNAS-CL07:2011)中明確要求“實驗室應有能力對每一項有數值要求的測量結果進行測量不確定度評定”[5];CMA(China Metrology Accreditation)評審依據的《檢驗檢測機構資質認定評審準則》明確要求“檢驗檢測機構應根據需要建立和保持應用評定測量不確定度的程序”[6]。近年來,食品檢測領域的第三方實驗室發展加速,不確定度評定作為保證數據質量、規范檢測行為的重要手段逐漸受到各方的重視。在實踐中,微生物檢測數據出現臨界值、不符值等非正常值時,正確評定不確定度可以保證檢測結果的科學性和公正性[7]。但由于生物學科本身分散性較強和不易度量的特點,不確定度評定的應用仍主要存在于非生物類實驗中。
為探索有效、簡便、適用的微生物實驗不確定度評定方案,本研究針對包裝飲用水中銅綠假單胞菌檢測結果的不確定度進行評定。首先分析不確定度產生來源并分別計算不同分量產生的不確定度,而后得出合成不確定度和擴展不確定度,最后折算回檢測結果,得到報告范圍。
1 材料與方法
1.1 材料
參照《食品安全國家標準 食品微生物學檢驗 培養基和試劑的質量要求》(GB 4789.28—2013)附錄D 要求采用標準菌株ATCC 27853 銅綠假單胞菌,自中國工業微生物菌種保藏管理中心購買[8]。本研究采用三代生長期標準菌株。
包裝飲用水樣品(批號:20170325),自保定市場采購買。使用1.1 中的標準菌株對包裝飲用水樣品進行人工污染。
1.2 儀器與試劑
3M Petrifilm 致病菌測試紙(環凱微生物科技有限公司)、滅菌精密250 mL 玻璃量筒(易購安(北京)科技有限公司)、0.1 ℃ ZHSY恒溫培養箱(三洋電機(中國)有限公司)、ZF-20C 紫外燈(上海楚柏實驗室設備有限公司)、0.45 μm 無菌濾膜(杭州盈天科學儀器有限公司)、100×顯微鏡(株式會社日立制作所)、BCD-610W 冰箱(羅伯特·博世有限公司)以及BHC-1300IIA/B2生物安全柜(蘇州凈化設備有限公司)。
假單胞菌瓊脂基礎培養基/CN 瓊脂(編號:20170112F)、金氏B(King’s B)培養基(編號:20170112)、乙酰胺液體培養基(編號:20170119)、綠膿菌素測定用培養基(編號:160919)、營養瓊脂(編號:20160115)、氧化酶試劑(編號:20160824)以及鈉氏試劑(編號:20170112)。
1.3 方法
按照《食品安全國家標準 飲用天然礦泉水檢驗方法》(GB 8538—2016)中銅綠假單胞菌[9]的要求進行檢測,得到原始數據。量取250 mL 水樣,0.45 μm無菌濾膜過濾,將濾膜移至CN 瓊脂培養基上,于(36±1)℃恒溫培養箱中培養48 h;可疑菌落分別計數并進行確證性實驗,確證標準見表1。

表1 確證性實驗表
最后進行結果報告,計算每250 mL 水樣中的銅綠假單胞菌數量,結果以CFU/250 mL 計。結果按式(1)進行計算:

式(1)中,P-呈藍/綠色的菌落數;F-顯熒光的菌落數;cF-產氨陽性的顯熒光菌落數;nF-進行產氨測試的顯熒光菌落數;R-呈紅褐色的菌落數;cR-產氨、氧化酶、金氏B 培養基上顯熒光測試均呈陽性的紅褐色菌落數;nR-進行產氨、氧化酶、金氏B 培養基上顯熒光測試的紅褐色菌落數。
1.4 統計學處理
設水樣中銅綠假單胞菌檢測結果為T,檢測結果為X,則T=XCFU/250 mL。
1.4.1 不確定度的來源
和一般測量相比較,樣品中微生物測量的結果特點是發散性極大[10]。在微生物檢驗中,樣品重復測量帶來的不確定度是影響檢驗結果準確度的主要原因[11]。除此之外,微生物分布、環境條件、樣品稱量、成品培養基批次、樣品過濾和人員因素均能導致不確定度,其中能夠直接影響檢測準確度并可以進行不確定度評價的為樣品稱量方面和樣品重復測量方面,重復測量帶來的不確定度占主要部分。
1.4.2 不確定度的評定方法
根據對銅綠假單胞菌檢測過程中不確定度的來源進行的分析,同時結合微生物檢測的學科特點,本研究采用B 類不確定度的統計方法評定樣品稱量環節產生的不確定度,采用A 類不確定度的統計方法來評定樣品重復測量環節產生的不確定度。
本研究采用人工污染樣品的方式來模擬實際樣品的檢測,從而獲得足夠的檢測數據。實際的檢測結果呈現偏態分布、分散性強、不易評定的特點,故首先采用指數法對原始數據進行處理,使處理后的數值符合正態分布,從而評定銅綠假單胞菌檢測結果的不確定度。
2 結果與分析
2.1 樣品稱量過程中產生的不確定度
使用250 mL 無菌玻璃量筒,精度0.1 mL,根據《常用玻璃量器檢定規程》(JJG 196—2006)規定,量出式250 mL 量筒的容量允差為±2.0 mL,稱量誤差服從矩形分布,包含因子kp=[12]。
樣品稱量引入的不確定度ur為:
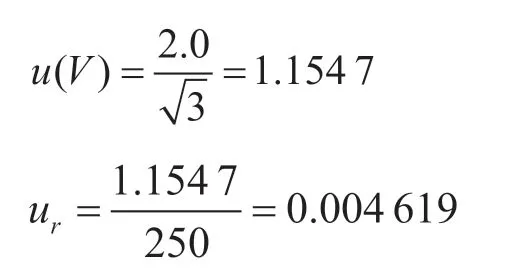
2.2 樣品重復檢測產生的不確定度
在相同條件下,同一名檢測人員對同一包裝飲用水樣品進行重復檢測30 次,得檢測結果Xi。檢測結果見表2。
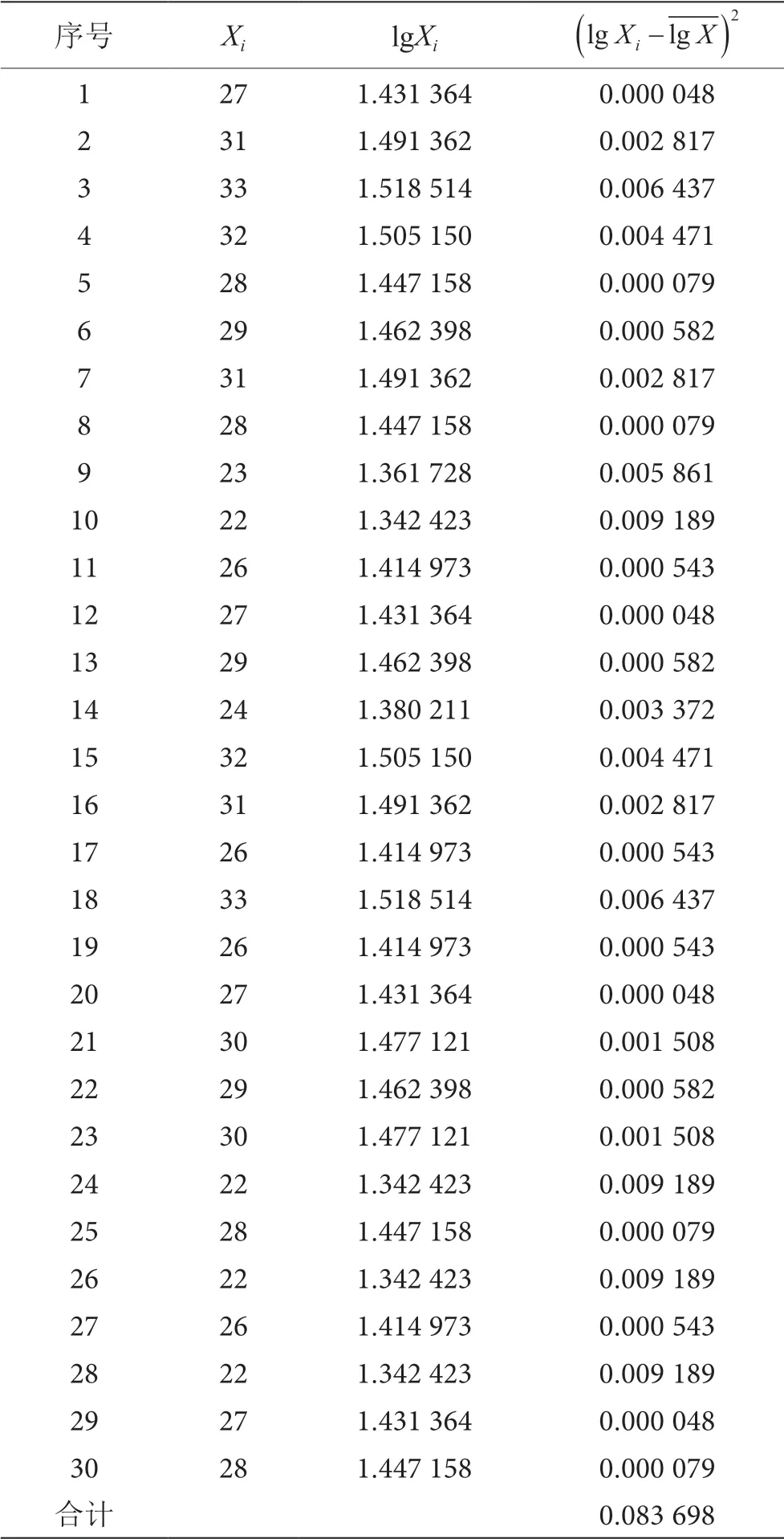
表2 檢測結果表
得到檢測結果的原始數據(Xi)后,將Xi取對數得lgXi,計算得對數值的平均值,再利用貝塞爾公式計算每組數據的標準偏差的平方得計算合并標準偏差得s,最后得樣品重復檢測合成標準不確定度uc。
合并樣本標準偏差:
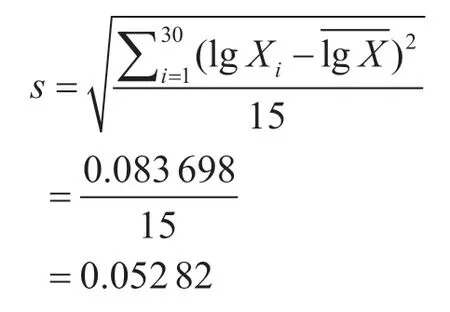
樣品重復檢測合成標準不確定度:
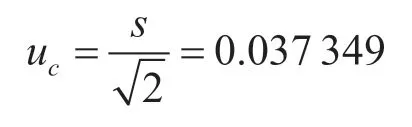
2.3 合成不確定度
將不同來源的不確定度進行合成,得包裝飲用水中銅綠假單胞菌檢測結果的合成不確定度u。

2.4 擴展不確定度
取置信區間P=95%,自由度v=30-1=29,查詢t分布表得包含因子k95(29)=2.05,可得包裝飲用水中銅綠假單胞菌檢測結果的擴展不確定度U。
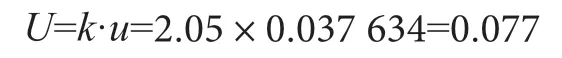
2.5 報告范圍
根據得到的擴展不確定度U,得到lgX的取值范圍;將lgX取反對數折算為檢測結果X,得到X的取值范圍,從而得到包裝飲用水中銅綠假單胞菌的檢測結果T的報告范圍:

該包裝飲用水中銅綠假單胞菌的檢測結果為T=23 ~33 CFU/250 mL。
3 結論與討論
2017 年6 月實施的《食品安全國家標準 食品微生物學檢驗 總則》(GB 4789.1—2016)明確要求“檢驗結果報告后,剩余樣品和同批產品不進行微生物項目的復檢”[13]。微生物項目不得復檢的特點決定了對其檢測數據的準確性有更嚴格的質量要求,也對其不確定度評價方案的建立提出了更高的要求。
不確定度評價可以定量反映檢測結果的質量好壞,本研究計算得到的報出范圍與樣品的實際檢測結果較為一致,但是不確定度的評定過程步驟仍然較為繁瑣和不便,中間過程采用了指數法等統計方法,主要原因在于微生物實驗的原始數據普遍呈現偏態分布,缺少固定規律、可變性強、重復性差;這也是微生物檢測項目不易建立規范的不確定度評價方案的難點所在。只有在檢測結果<10 CFU·mL-1的情況下,其才能接近于正態分布,不需要進行對數轉換[14]。本研究采用的為液體樣品且無需進行稀釋,如遇其他檢測項目需均質、稀釋等過程,不確定度也會隨之變化。
不確定度評價方案的建立首先要分析不確定度產生的來源,微生物實驗有自動化儀器少、人員參與多、檢測周期長和結果統計主觀性強的特點,由此導致不確定度產生的來源較多,主要有樣品重復檢測、樣品稱量或吸取、無菌室環境(風力、溫度、濕度等)、樣品種類變化、培養基批次變化、樣品均一性及微生物動態變化等,其中培養基批次變化、微生物動態變化等一些微生物實驗特有的不確定度產生來源尚未有完善的測量法或統計學的評定方法。這些因素造成的不確定度,需要依靠引進自動化儀器、嚴格質量控制(實驗室比對、能力驗證、質量考核等方式)手段來進行減少或評定。
在可評定的因素中,樣品重復檢測已經確定為微生物實驗中的首要不確定度來源,在本研究中其帶來的不確定度為樣品稱量來源的8.1 倍左右。如假設其他因素均可忽略的話,樣品重復檢測帶來的不確定度占到全部不確定度的89%左右。目前,我國食品微生物檢測項目逐漸開始使用2 級或3 級的高級別采樣方案(n≥5)進行樣品檢測,本文也為其提供了理論依據。而樣品稱量過程中帶來的不確定度,需要依靠使用優良計量器具、開展器具比對、開展人員比對等方式進行減少。
在實踐中,微生物實驗進行不確定度評定的意義主要在于當出現要求限值附近的檢測結果時,利用擴展不確定度對樣品進行符合性判定。在95%置信概率下,當檢驗結果延伸擴展不確定度半寬度后仍小于(大于)限量標準時。當檢驗結果低于(高于)限量標準的部分小于測量不確定度,則在95%置信概率上不能做出符合(不符合)限量標準的聲明[15]。

