超聲造影定量參數在乳腺BI-RADS 4a類病灶再分類中的應用價值*
韋立麗 ,梁子軒#,曾 琪,董德福,譚啟杏,韋長元,楊偉萍△
(廣西醫科大學附屬腫瘤醫院 1.超聲科;2.乳腺外科,南寧 530021)
乳腺影像報告和數據系統(breast imaging reporting and data system,BI-RADS)主要通過乳腺病灶超聲表現來對病灶進行分類[1],但很多病理不同的乳腺病灶,也可以有同樣的超聲表現[2],因而時常會出現誤差。BI-RADS 4a類病灶的惡性概率僅2%~10%[3],這導致了臨床上非常多不必要的穿刺活檢。超聲造影(CEUS)通過造影劑微泡在血管內產生的散射,來增強血管與組織間對比以觀察病灶形態,能有效提高乳腺惡性病灶的診斷效能,通常惡性病灶表現為高增強,而良性病灶表現為低增強[4],超聲造影定性特征存在一定的主觀性,而CEUS 定量參數可以量化造影劑增強的強度,它將主觀的定性特征量化為客觀的數值,擁有客觀、精確的優點,能更好地對病灶性質進行判斷[5],具有更高的研究價值。本研究旨在比較CEUS定量參數在乳腺良惡性病灶中的差異,根據CEUS 定量參數對BI-RADS 4a類病灶進行再分類,以期為減少不必要的穿刺活檢提供一定的理論依據。
1 資料與方法
1.1 研究對象
收集在廣西醫科大學附屬腫瘤醫院接受CEUS檢查的乳腺疾病患者,其中CEUS 定量參數截斷值的研究對象為2017年6月至2019年12月接受CEUS 檢查的乳腺疾病患者。乳腺BI-RADS 4a 類再分類的研究對象為2017年6月至2020年10月接受CEUS 檢查后乳腺疾病患者的BI-RADS 4a 類病灶。
1.2 儀器及方法
1.2.1 檢查儀器及試劑 采用日本東芝公司的Aplio500型彩色超聲診斷儀,14L5高頻線陣探頭,探頭頻率5~14MHz,機械指數為0.04,造影劑采用意大利Bracco公司生產的聲諾維(SonoVue)。
1.2.2 超聲檢查 患者仰臥位,充分暴露患側乳腺。全面探查目標病灶,記錄病灶常規超聲特征,以病灶血供較豐富的切面為造影觀察面。切換至造影模式,充分搖勻造影劑,于肘正中靜脈先后快速推注造影劑4.8 mL 及5 mL 0.9%NaCl 注射液,動態采集病灶增強圖像1 min并儲存。
1.3 圖像分析及分類標準
1.3.1 乳腺病灶分類標準 CEUS 修正常規超聲BI-RADS分類標準:無任何陽性特征者下降1類,具備1 項陽性特征者保持原分類不變,兩項者上升1類,3項者上升兩類,4項及4項以上者為BI-RADS 5 類。CEUS 惡性病灶陽性特征:(1)病灶高增強。(2)增強后病灶內部造影劑分布不均勻。(3)病灶邊界不清晰。(4)增強后病灶形態不規則。(5)增強后病灶范圍明顯擴大。(6)增強過程中可見迂曲粗大的血管由病灶周邊進入病灶內。
1.3.2 獲取CEUS定量參數及最佳截斷值 使用儀器自帶備軟件對CEUS數據進行后處理。ROI設置為直徑2 mm的圓形,通過移動ROI動態對比尋找,確定病灶內增強較明顯的區域并放置ROI,放置于病灶內增強最明顯的區域,繪制時間強度曲線并獲取定量參數,得到TIC及定量參數,定量參數包括峰值強度、達峰時間、平均渡越時間、曲線斜率、曲線下總面積、流入面積、流出面積。
選取良、惡性病灶間存在差異的定量參數構建受試者工作特征曲線(ROC曲線),獲得各定量參數診斷乳腺惡性病灶的最佳截斷值。
1.3.3 BI-RADS4a 病灶定量參數再分類標準 根據定量參數最佳截斷值,當病灶的定量參數均低于最佳截斷值時將病灶降為3 類,建議短期隨訪。相反,當病灶有1 個或超過1 個定量參數截斷值高于最佳截斷值時,則保持4a類,建議活檢。
1.4 統計學方法
采用SPSS 26.0 統計學軟件對數據進行分析。計量資料以中位數表示,組間比較采用Mann-WhitneyU檢驗。采用Graphpad Prism 8.0 繪制ROC 曲線,獲得曲線下面積值及最佳截斷值。計數資料以百分率(%)表示,組間比較采用卡方檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 一般資料
CEUS 定量參數截斷值研究納入乳腺病患364例,共373 個病灶,以手術病理為金標準,良性病灶83 個(22.25%),惡性病灶290 個(77.75%)。乳腺BI-RADS 4a 類病灶再分類研究共納入79 個病灶,良性病灶76個(96.20%),惡性病灶3個(3.79%),病理結果,見表1。
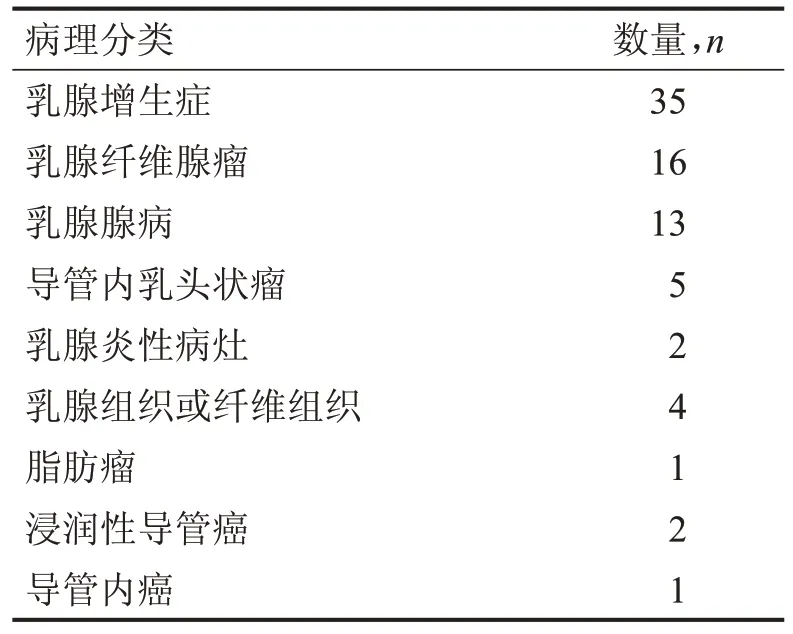
表1 CEUS檢查后79個乳腺BI-RADS4a類病灶病理分類情況
2.2 定量參數及ROC曲線結果
定量參數中峰值強度、曲線斜率、曲線下總面積、流入面積、流出面積在乳腺良、惡性病灶中比較,差異有統計學意義(P<0.05),達峰時間、平均渡越時間比較,差異無統計學意義(P>0.05)。ROC曲線結果顯示,峰值強度、曲線斜率、曲線下總面積、流入面積、流出面積的曲線下面積分別為0.732、0.731、0.736、0.717、0.732,最佳截斷值分別為1.55、0.35、110.5、5.65、108.9,見表2、圖1。
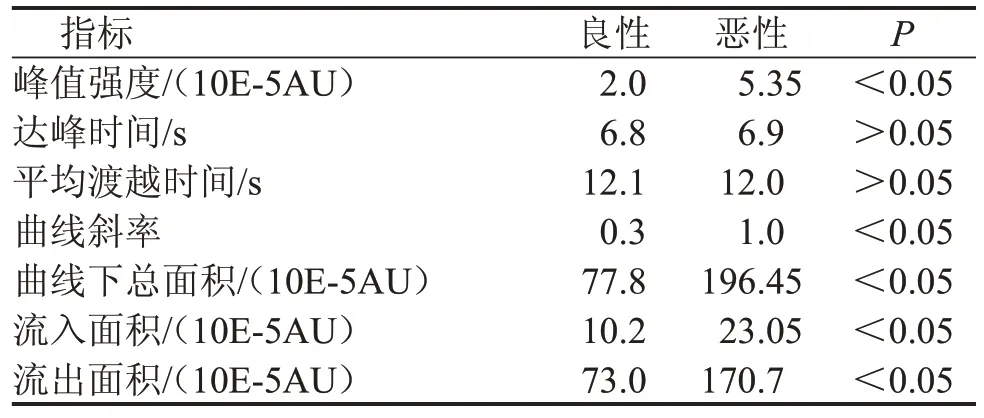
表2 373個乳腺病灶CEUS定量參數比較結果
2.3 BI-RADS 4a類病灶再分類結果
BI-RADS 4a 類病灶共79 個,共41 個(51.90%)病灶被調整為3 類。BI-RADS 4a 類病灶再分類后分類情況,見表3。調整分類前BI-RADS 4a類病灶活檢率為100%,調整分類后病灶活檢率下降至48.10%,調整前、后比較,差異有統計學意義(P<0.05);調整分類前BI-RADS 4a 類病灶惡性檢出率3.79%,調整分類后惡性檢出率升高至7.90%,調整前、后比較,差異無統計學意義(P>0.05),見圖2。
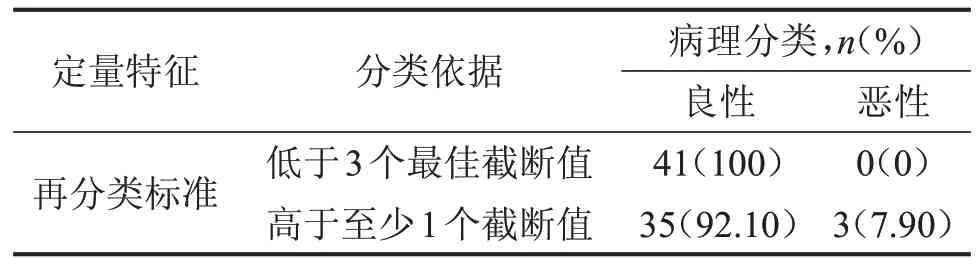
表3 調整分類后79個病灶病理分類分布情況
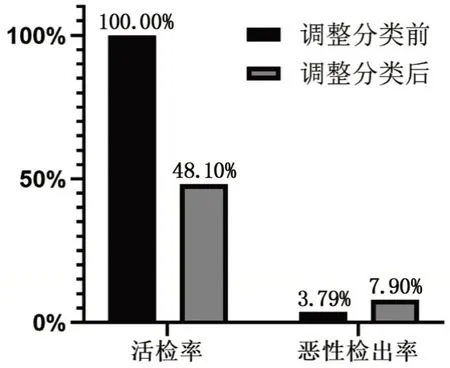
圖2 BI-RADS 4a類病灶再分類前后活檢率、惡性檢出率
3 討論
BI-RADS 在乳腺病灶的管理具有很高的應用價值,臨床醫生根據超聲診斷醫生提供的BI-RADS分類,對病灶采取不同的管理方法[6],當病灶的BIRADS 大于4 類時,建議進行穿刺活檢,但BIRADS 4a 類病灶的惡性概率僅為2%~10%,最終導致超過90%的良性病灶接受穿刺,造成過度治療,同時增加了患者的經濟負擔和心理負擔。
CEUS通過造影劑微泡在血管內產生的散射來增強血管與組織間對比以觀察病灶形態,能有效提高乳腺惡性病灶的診斷效能[7-8]。CEUS常用的定量參數峰值強度、曲線斜率、曲線下總面積、流入面積及流出面積等可以量化造影劑強度及灌注速率。峰值強度指進入病灶血管床的最高微泡量,反映病灶的最高瞬時血流量;曲線斜率指病灶造影劑濃聚過程中的灌注速率變化幅度,反映造影劑進入病灶的快慢;曲線下總面積為病灶增強過程中進入病灶血管床的造影劑微泡總量,反映造影全過程的總血流量;流入面積指造影劑微泡從開始進入病灶血管床至含量達到峰值的過程中的微泡總量,反映造影劑濃聚過程的總血流量;流出面積指造影劑微泡含量峰值至造影劑微泡完全消退過程中的血管床微泡總量,反映造影劑消退過程的總血流量。
乳腺是乏血供器官,其原生的良性病灶普遍血供不豐富,但乳腺癌能大量分泌內皮生長因子,誘導周邊正常動脈以芽生的形式向病灶發出滋養血管[9]。這些滋養血管由外周穿入內部,形成從血管主干到病灶各區域“交通網”,使病灶內部的瞬時血流量及總血流量升高,從而導致病灶的峰值強度及曲線下總面積升高[10-11]。除此之外,惡性病灶的血管壁可以出現結構缺失,舒縮功能異常,癌栓形成和動靜脈瘺[12],動靜脈瘺能增加病灶動脈期血流灌注量及血液轉換速率,使造影劑微泡迅速進入血管床,從而表現為惡性病灶的流入面積、曲線斜率及流出面積升高。反觀良性病灶,這類病灶的血管稀疏,血流量少,進入病灶的造影劑微泡數量也較少,灌注速率較慢,故其峰值強度、曲線斜率、曲線下總面積、流入面積及流出面積較惡性病灶更小。本研究通過對比373例病灶的CEUS 定量參數,發現峰值強度、曲線斜率、曲線下總面積、流入面積及流出面積在良、惡性病灶比較,差異有統計學意義(P<0.05),可以作為良、惡性病灶判斷的依據。研究證實,乳腺惡性病灶通常表現為高增強,而良性病灶通常表現為低增強,但是CEUS 的定性特征具有一定的主觀性,容易因為醫師的誤判而導致誤差。本研究通過對比后發現乳腺惡性病灶的病灶的峰值強度、曲線下總面積、流入面積的曲線下面積分別為0.732、0.731、0.736、0.717、0.732,最佳截斷值分別為1.55、0.35、110.5、5.65、108.9,最佳截斷值可以作為區分良、惡性病灶的超聲參數之一,調整乳腺病灶的分類,減少乳腺病灶的活檢。
本研究應用定量參數的最佳截斷值對BIRADS 4a類病灶進行調整分類,調整后共有41個病灶被調整為3類,原4a類病灶的活檢率從100%降至48.10%,再分類前、后活檢率變化比較,差異有統計學意義(P<0.05),同時所有惡性病灶均不在降低分類的組別中,并未導致漏診的增加。
綜述所示,CEUS定量參數中的峰值強度、曲線下總面積及流入面積在乳腺良、惡性病灶中存在差異,采用定量參數對BI-RADS 4a 類病灶再分類,可以減少不必要的病灶穿刺。

