藻源溶解性有機質對汞甲基化的影響
李雨桐,何鑫龍,彭一帆,胡勰克,王昱杭,趙 婷,吳勝春,2,梁 鵬,2
(1. 浙江農林大學 環境與資源學院,浙江 杭州 311300;2. 浙江農林大學 浙江省土壤污染生物修復重點實驗室,浙江 杭州 311300)
聯合國環境規劃署《2013年全球汞評估報告》指出:中國是全球汞(Hg)的主要排放國,總排放量為全球的1/3,亞洲的3/4。表明在中國開展汞的生物地球化學研究對人體健康和生態安全具有重要意義[1]。湖泊水庫等水體中的汞主要來自河流輸入和大氣沉降,甲基汞(MeHg)則來源于水體汞的甲基化或沉積物中MeHg的釋放[2],通過生物富集作用和食物鏈傳遞的生物放大作用,最終在人體內積累,對人類安全危害極大。丁之勇等[3]發現:中國31個湖泊沉積物中汞的平均質量分數為0.076 mg·kg-1;多個湖泊沉積物中汞的地累積指數達到中度或重度污染,潛在生態風險指數和平均污染程度僅次于鎘(Cd)。張杰等[4]發現:太湖流域河流表層沉積物中汞的平均質量分數為0.109 mg·kg-1,超過背景值的采樣點占47.87%,潛在生態風險評價處于中等或以上。近年來中國湖泊富營養化較為普遍,藻華時有發生,對湖泊水生生態系統造成極大威脅。溶解性有機質(DOM)是水生生態系統中水體天然有機質的主要成分(占97.1%)[5],通常指能通過0.10~0.70 μm濾膜,包含不同結構、分子量的碳基有機化合物,包括單糖、氨基酸等小分子化合物和蛋白質、腐殖質等大分子化合物。隨著藻類暴發性增長,大量初級生產力進入[6],水體中DOM成分隨之發生變化。如河流河口的硅藻Bacillariophyta藻華可顯著增加DOM中碳水化合物的相對含量[7],類蛋白質熒光組分的峰強變化規律與各浮游藻類密度呈顯著相關(r>0.80)[8]。一般認為,藻類正常生長的分泌物和降解的死亡藻體[9]都會造成沉積物中有機質的異常積累,從而改變水質參數,影響化合物形態的轉化。DOM的—CH3、—CH2、—OH、—COOH、—C=O、—NH2等多種活性官能團可作為天然的載體與配體,與汞離子(Hg2+)發生氧化還原、絡合、螯合、沉淀等一系列反應,從而影響水環境中汞元素的賦存形態、遷移性、溶解性以及最終歸趨[10]。此外,DOM還會改變沉積物的氧化還原電位(Eh)和pH[11]、微生物種群等[12]環境因子,間接影響汞的形態轉化。目前關于DOM影響汞甲基化的觀點仍存在著較大分歧。有學者認為:DOM所含的還原態硫官能團能對汞產生絡合作用,抑制其生物甲基化過程;也有研究者發現:較小的有機質會促進Hg的生物甲基化[13],DOM可以直接或在金屬離子催化作用下參與非生物甲基化過程[14]。有鑒于水體中DOM來源的復雜性及其化學結構與性質的差異性,在總量水平上研究其對汞的影響難以形成定論。因此,有必要從更微觀的角度闡明DOM對汞形態轉化影響的作用機制。根據極性和電荷特性,DOM可分為6個成分,即疏水性的堿性、酸性和中性DOM以及親水性的堿性、酸性和中性DOM[15]。水體富營養化和藻華使得藻體腐解過程產生的有機物成為水環境中DOM的重要來源。本研究通過室內模擬實驗,對不同腐解階段的藻類DOM進行逐步分離,取得6個親水和疏水性亞組分,系統研究這些亞組分對汞甲基化的影響,以期豐富淡水環境中汞的生物地球化學理論,為汞污染的控制和降低汞污染健康風險提供科學依據。
1 材料和方法
1.1 樣品采集與處理
供試藻體采自浙江省杭州市臨安區某小型淡水湖泊。選取富營養化嚴重的湖水區域,用撈網收集水中浮藻,做好標記后放置在收納箱內帶回實驗室。去除已腐爛的水藻及其他雜物后用水清洗干凈,并用去離子水淋洗3次,冷凍干燥后備用。
冷凍干燥的第0、5、10、20、30、60天各取浮藻樣品充分研磨,超純水浸提法提取DOM[2]。浸提條件為20 mL超純水與2.0 g浮藻樣品混合,黑暗、恒溫(25 ℃)下振蕩24 h后高速離心;取0.45 μm玻璃纖維濾膜過濾離心后的上清液作為DOM樣品,結晶,4 ℃保存備用。
1.2 藻體DOM的官能團組成及光譜學特征測定
取DOM結晶,與溴化鉀(KBr)固體混合后制成壓片。使用傅里葉變換紅外光譜儀(IR Prstige-21,日本島津)測定不同腐解時期DOM的紅外光譜。為減少干擾,在分析每個樣品前先測定光譜背景值,通過環境空氣、二氧化碳(CO2)和水(H2O)矯正光譜。調節掃描波數精度為0.01 cm-1,波數為400~4 000 cm-1。
1.3 DOM6 種不同亞組分的分離分析方法
1.3.1 樹脂柱的搭建 用蠕動泵將DOM樣品的原液通過填滿樹脂的樹脂柱,調節四氟丙烯活塞控制液體流動速率。為了防止樹脂層中出現氣泡,用可拆卸的玻璃砂芯片固定樹脂。
1.3.2 樹脂的預處理 用體積分數95%的甲醇過Amberlite XAD 4和Amberlite XAD 8樹脂柱,趕走柱中氣泡,用蒸餾水淋洗至流出液的溶解性有機碳(DOC)質量濃度接近于0。用60 ℃的熱水反復清洗陰離子交換樹脂和陽離子交換樹脂,直到陰離子交換樹脂的浸洗水不再褐色、陽離子交換樹脂的浸洗水幾乎無泡沫;水洗后的陰、陽離子交換樹脂用質量分數3%~5%的氫氧化鈉(NaOH)和鹽酸(HCl)溶液二次清洗,以堿-酸-堿的進液次序過陰離子交換樹脂柱,以酸-堿-酸的次序過陽離子交換樹脂柱。上述處理步驟完成后,將樹脂放置于密封罐中備用[2]。
1.3.3 DOM的富集分離 DOM分離參照LEENHEER等[16]和CHEFETZ等[17]方法。根據DOM在不同類型樹脂上吸附能力的差異,將其分為疏水堿性(HOB)、疏水中性(HON)、疏水酸性(HOA)、親水堿性(HIB)、親水中性(HIN)、親水酸性(HIA)6種有機組分[18]。其中HOB通過0.10 和0.01 mol·L-1鹽酸溶液反洗XAD-8樹脂后獲得,HOA由0.10 mol·L-1氫氧化鈉溶液反洗XAD-8樹脂后獲得,HON通過空氣干燥XAD-8樹脂并用甲醇索式提取后獲得;HIB由0.10 mol·L-1氨水(NH3·H2O)反洗BIO-RAD AGMP-50離子交換樹脂后獲得,HIA由3.00 mol·L-1氨水反洗DUOLITE A-7離子交換樹脂后獲得,HIN用純水淋洗DUOLITE A-7離子交換樹脂后獲得。得到的洗脫液置于40 ℃下旋轉蒸發,再經過脫鹽、冷凍干燥后獲得固體樣品得固體樣品[18]。
1.4 不同Hg2+質量濃度下DOM對汞甲基化的影響
配制6個質量濃度梯度(100.00、200.00、400.00、800.00、1 600.00、3 200.00 ng·L-1)的氯化汞(HgCl2)溶液,測定未腐解藻體DOM各組分在不同氧氣條件(好氧、厭氧)下對汞甲基化的影響。
將裝有6種DOM亞組分樣品的離心管分組,整齊地放入厭氧袋中,加入配套的厭氧產氣包,快速擠出原有空氣后密封,室溫下放置24 h。
反應皿中加入60 mL經氮吹去氧的超純水,分別加入DOM各組分,調節總有機碳(TOC)至10 mg·L-1,pH為7,靜置1 d后,加入不同質量濃度HgCl2溶液。采用蔣紅梅等[19]方法(蒸餾-乙基化結合氣相色譜-冷原子熒光,CVAFS法)在BROOKS RAND測汞儀上測定甲基汞質量濃度(最低檢出限為0.009 ng·L-1)。
1.5 不同腐解時期DOM對汞甲基化的影響
配制1 000.00 ng·L-1的Hg2+溶液,分別加入第0、5、10、20、30、60天DOM各亞組分,參照蔣紅梅等[19]方法測定甲基汞質量濃度。
1.6 數據處理和分析
數據處理和圖表制作采用Origin 8.5及Omnic 8.2軟件。MeHg測量按10%的平行操作,測定標樣和空白樣并做標準曲線。分析重復組數據時控制相對標準偏差低于12%。
2 結果與討論
2.1 不同氧氣條件下未腐解藻體DOM各亞組分對汞甲基化的影響
堿性疏水性有機物(HOB)對汞甲基化貢獻最高,其次為HON和HIA,其他成分的貢獻量都較小,且沒有顯著差異。3種疏水性有機亞組分的汞甲基化作用由強到弱依次為HOB、HON、HOA。由圖1可知:不同氧氣條件下,MeHg生成量均隨Hg2+質量濃度增加而增加,提示HOB具有明顯促進汞甲基化的能力。Hg2+低于1 600 ng·L-1時,好氧條件下MeHg轉化量隨Hg2+質量濃度的增加而增加,轉化率則降低(由13.0%降至1.7%);厭氧條件下MeHg的轉化量一直呈上升趨勢,轉化率則較為平穩;相比之下,厭氧條件更有利于MeHg的生成。HOA與HON一定程度上也能促進MeHg生成,但總體效果不如HOB。兩者均在Hg2+質量濃度最大時達最大轉化量,但MeHg轉化率均隨Hg2+質量濃度增加而下降。Hg2+質量濃度為3 200 ng·L-1時,3種組分的MeHg轉化量厭氧條件均高于好氧條件。
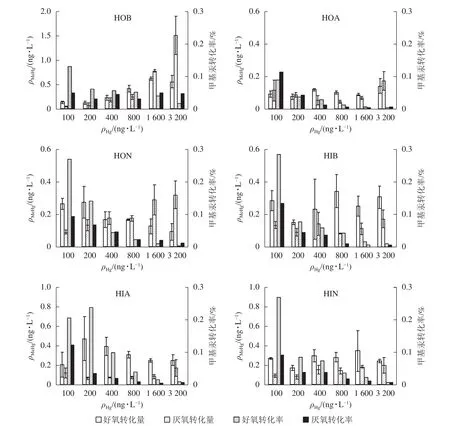
圖1 不同Hg2+質量濃度下DOM各亞組分對汞甲基化的影響Figure 1 Effect of DOM subcomponents on the production of MeHg at different initial Hg2+ concentrations
3種親水性有機亞組分中,HIB能略微促進Hg2+的甲基化;厭氧條件下甲基汞生成量較少(最大值0.17 ng·L-1);不同氧氣條件下轉化率均隨Hg2+質量濃度增加而降低,好氧時最高值為29.0%,厭氧時最高值為13.0%。HIA在好氧條件下的MeHg轉化量表現為先上升后下降(最大值為0.40 ng·L-1),厭氧條件下的轉化量很小(最大值0.15 ng·L-1),轉化率隨Hg2+質量濃度的升高而降低。HIN對汞形態轉化亦有一定的促進作用。好氧、厭氧條件下MeHg轉化量隨濃度變化的規律性不強,厭氧轉化量更低;2種條件下轉化率均大致隨Hg2+濃度的升高而降低,但厭氧條件下最高轉化率僅為好氧時的一半。
以上結果表明:藻體DOM總體上可促進水體中Hg2+的甲基化反應。分離出的6個亞組分中,3個疏水性有機物對甲基汞產生的影響要強于3個親水性有機物,以HOB的促進作用最為明顯。DOM影響重金屬在水體中形態變化過程的根本原因是其可以與重金屬離子形成絡合物,從而影響后者形態、生物有效性和毒性。有機分子的結構組成可以影響DOM對金屬的親合力。GUGGENBERGER等[20]發現:親水性酸性物質對金屬離子有較強的絡合能力,是疏水性酸性物質的2~8倍,與本研究中親水性DOM更易與溶液中的Hg2+結合、降低水體汞甲基化的結論一致。生物配體模型[21]認為:親水性DOM與自由金屬離子絡合后使得自由離子平衡濃度下降,進而降低金屬離子在有DOM存在時的有效性,與本研究結論也較為一致。研究發現:隨著Hg2+質量濃度升高,甲基汞轉化率逐漸降低,表明在較高的Hg2+質量濃度條件下,參與甲基化反應DOM的甲基供體數量不足,與LIANG等[22]結論一致。
自然環境下,汞的甲基化特別是生物甲基化主要發生在厭氧條件下。本研究發現,不同亞組分在好氧/厭氧條件下對甲基汞產生的影響不同。對于HOB來說,厭氧條件更利于汞的甲基化反應,厭氧條件下甲基汞產生量高于好氧條件,而其他成分在好氧、厭氧條件下的甲基汞產生量則無太大變化。
2.2 不同腐解時期藻體DOM的官能團組成及光譜學特征
對不同腐解時長下的藻體DOM作紅外光譜(圖2)分析可知:未腐解的DOM各官能團種類最為豐富,隨腐解時間的延長,基團簇度呈逐漸減少趨勢;腐解第60天時,1 364 cm-1處的叔丁基[—C(CH3)]、2 900 cm-1處的飽和C—H鍵(—CH3)的伸縮和亞甲基(—CH2—)的反對稱伸縮、3 400 cm-1處游離態和締合態的羥基(O—H伸縮振動)的峰已很不明顯。總體來看,腐解0~10 d的DOM官能團變化較小,較穩定。對比1 060 cm-1處的波動,可以看出不同腐解時長下C—O鍵的簇數明顯下降。綜上所述,不同腐解時長下,DOM官能團的數量和種類均發生變化,并影響各亞組分對汞的甲基化作用。
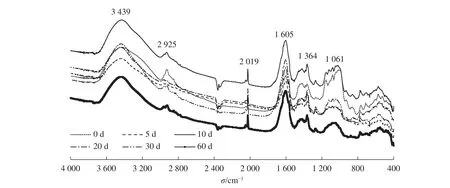
圖2 不同腐解時期DOM紅外光譜圖Figure 2 IR spectra of DOM at different decomposition intervals
2.3 不同腐解時期DOM各亞組分對汞甲基化的影響
HOB、HOA和HON為DOM的3個疏水性有機組分。由圖3可知:不同腐解時間產生的HOB,汞甲基化能力不盡相同。腐解初期(0~10 d)甲基化能力呈下降趨勢,第10天MeHg轉化量僅為0.20 ng·L-1,10~20 d轉化量大幅增加,增幅達61.9%,之后小幅波動,第60天時達最高值(0.71 ng·L-1)。腐解初期(0~10 d)HOA對汞的甲基化基本沒有影響,但隨腐解時間增長,HOA的汞甲基化能力逐漸加強。相比之下,HON促進汞甲基化能力總體較大;腐解初期略低,但最小值(第10天)也達到了1.20 ng·L-1,此后轉化量大幅增加,第60天達到最大轉化量(1.55 ng·L-1)。
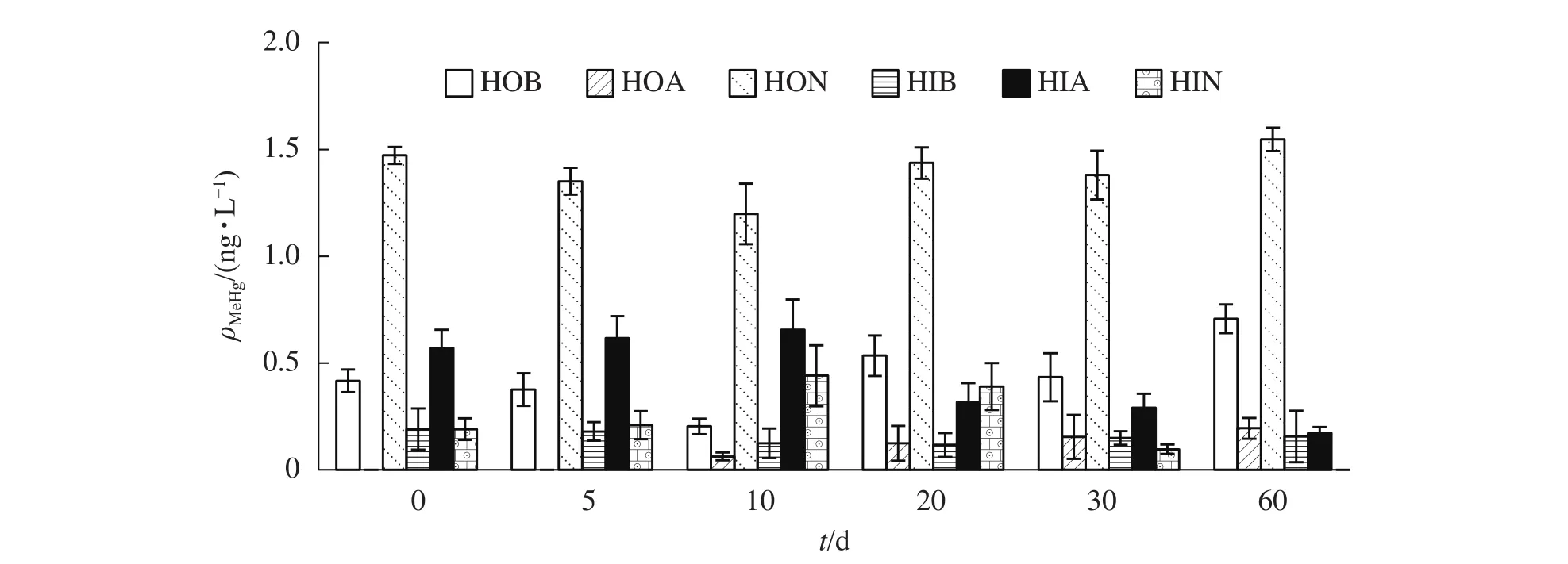
圖3 不同腐解時間DOM亞組分對MeHg生成量的影響Figure 3 Variation of MeHg concentrations of DOM subcomponents at different decomposition intervals
相比而言,3個親水性組分的汞甲基化能力略低。其中,HIB的甲基汞轉化量最小,HIA和HIN隨著腐解時間的增加,汞甲基化能力先增加后降低,在第60天時達到了最低,與疏水性有機組分的結果正好相反。
以上研究結果表明,隨著腐解的進行,親水性組分的促進汞甲基化能力表現為先升高再降低乃至消失;疏水性組分則表現為先降低再逐漸升高。3種疏水性亞組分對汞甲基化的影響效應均在60 d時達到極值。隨著藻類腐解進程,藻體逐漸釋放出大量DOM。馮勝等[23]發現:狐尾藻Myriophyllum verticillatum腐爛過程中釋放出大量類蛋白物質,DOM熒光組分和熒光峰呈先逐漸增強后逐漸降低趨勢;表明在腐解過程中,DOM先增加后減少。藻類DOM以類色氨酸成分為主,可以很快被微生物利用并降解轉變為類腐殖質物質[24]。本研究中,疏水性亞組分的汞甲基化能力高于親水性亞組分,由此推測:水體DOM的疏水性亞組分是汞甲基化的主導原因,即DOM對汞甲基化的影響主要為疏水性亞組分對汞甲基化的影響。SWIETLIK等[18]研究:HON富含碳氫化合物、多碳(>5)脂肪族醇、酯、酮和芳香結構,具有比其他亞組分更加豐富的官能團(如羥基、羰基和羧基等),因此作為甲基化電子供體更為有效,促進汞甲基化能力也更強。
3 結論
DOM的6種亞組分中,疏水性亞組分的汞甲基化能力高于親水性亞組分,其中以HOB為最,原因在于親水性亞組分易與游離態的Hg2+發生絡合,降低后者生物有效性;疏水性亞組分因表面官能團更為豐富,不易與Hg2+絡合,更有利于Hg2+甲基化。隨著游離Hg2+的增加,甲基供體數量逐漸減少,甲基汞轉化率逐漸降低。
富營養化藻類的DOM主要包含羥基、甲基、亞甲基、芳環C=C等官能團,隨腐解時間延長,這些基團的簇度逐漸減少,使得不同腐解時期DOM各組分對汞的形態轉化呈現較大差異。
藻體腐解過程中,DOM的疏水性有機組分汞甲基化能力高于親水性有機組分;不同腐解時長下釋放的相同亞組分,其汞甲基化效應亦有所差異。

