基于PI3K/AKT/mTOR信號通路的膠質母細胞瘤復發標記物的篩選
潘起晨,班允超,劉 源,王 剛
中國醫科大學附屬第一醫院神經外科 沈陽110001
膠質母細胞瘤(glioblastoma multiforme, GBM)是最常見的腦內原發腫瘤類型[1]。即使積極治療,GBM患者的預后仍較差,診斷后中位生存期僅為14~15個月,5 a生存率僅為5.3%,且易發生侵襲[2]。目前關于GBM患者不良預后的標記物包括在microRNA和外泌體等不同水平上的多種標記物。microRNA-21(miR-21)和miR-10b對GBM具有良好的預后預測價值[3-4]。 Sox2是miR-21的重要靶標,對預后具有重要意義[5]。但針對GBM復發的標記物卻很少見。本研究以GBM復發為結局,采用基因集富集分析(gene set enrichment analysis,GSEA)和基因集變異分析(gene set variation analysis,GSVA)兩種分析方法同步驗證了 PI3K/AKT/mTOR信號通路在GBM復發和未復發患者之間存在明顯差異,然后在該通路中篩選了5個基因 (MAP2K3、MAP2K6、MAPK1、PTEN和RAC1),建立了包含這5個基因mRNA表達水平的GBM復發風險評分模型,并對該模型對GBM復發的預測價值進行了評估。
1 資料與方法
1.1病例信息來源從癌癥基因組圖譜(The Cancer Genome Atlas, TCGA)數據庫中提取149例GBM患者的相關數據集。149例中,復發85例,無復發64例。
1.2目標mRNA的獲取從TCGA數據庫中提取和整理GBM患者的mRNA表達譜數據,經log2(基因表達量)標準化處理后,進行GSEA和GSVA分析(http://www.broadinstitute.org/gsea/index.jsp),以檢驗水準α=0.05為標準,篩選出復發和無復發患者之間存在顯著差異的細胞通路。
1.3GBM復發風險評分模型的建立及評價使用Cox回歸分析,從差異表達的細胞通路中篩選出與總生存(overall survival,OS)相關的基因。利用篩選出的基因表達水平的線性組合并經Cox回歸系數加權處理,構建GBM復發風險評分模型。風險評分=∑基因n表達水平×βn。使用Cox回歸分析,以復發為終點事件,以風險評分為自變量,評估兩者的關聯性。所有統計分析均使用SPSS 18.0和GraphPad Prism8完成。
2 結果
2.1患者基本信息149例GBM患者中,男96例(64.4%),女53例(35.6%);年齡≥60歲79例(53.0%),<60歲70例(47.0%);亞型分布:經典型37例(24.8%),間質型49例(32.9%),神經元型26例(17.4%),原神經細胞型37例(24.8%)。治療資料完整124例,其中接受放療41例(33.1%),化療107例(86.3%)。IDH基因突變檢測147例,其中8例(5.4%)陽性。MGMT甲基化檢測119例,其中55例(46.2%)陽性。
2.2細胞通路的GSEA和GSVA篩選見圖1。GSEA分析結果顯示,8種細胞通路在復發和無復發組患者之間存在顯著差異,且富集在復發組。GSVA分析結果顯示,PI3K/AKT/mTOR信號通路在兩組患者之間存在顯著差異,未發現其他差異性通路。選定在兩種分析方法中均存在明顯差異的PI3K/AKT/mTOR信號通路作為目標通路進行下一步分析。
2.3與GBM的OS相關基因的篩選首先以149例為研究對象,以OS為終點事件,應用單因素Cox回歸分析對PI3K/AKT/mTOR信號通路中的105個基因進行篩選,結果顯示有12個基因與GBM的OS顯著相關;然后經多因素Cox回歸分析篩選出(α入=0.1)5個基因(表1),其中MAP2K6、MAPK1和PTEN為保護型基因,MAP2K3和RAC1為風險型基因。利用這5個基因的mRNA表達水平及其多因素回歸的回歸系數建立復發風險評分模型。風險評分=0.377 1×MAP2K3基因表達水平+(-0.269 0)×MAP2K6基因表達水平+(-0.488 7)×MAPK1基因表達水平+(-0.325 6) ×PTEN基因表達水平+0.794 5×RAC1基因表達水平。
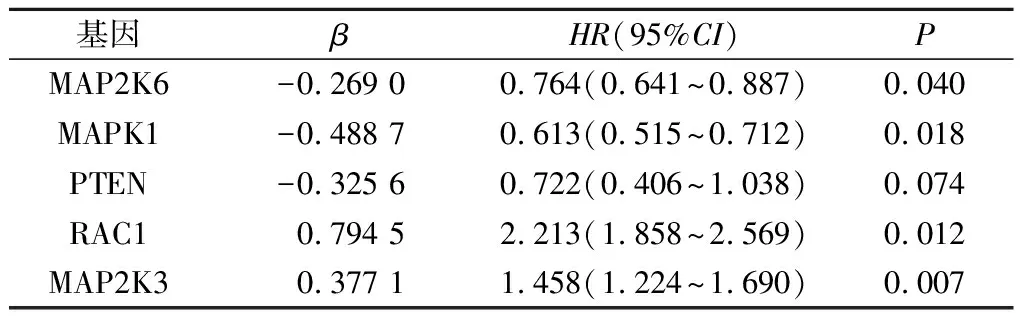
表1 多因素Cox回歸分析結果
2.4風險評分的預后預測價值以復發為終點事件,以GBM患者的風險評分,年齡分段,是否放療、化療,IDH基因突變,MGMT甲基化狀態,以及亞型為自變量,進行Cox回歸分析,結果見表2。結果顯示,風險評分對GBM的復發有預測價值。
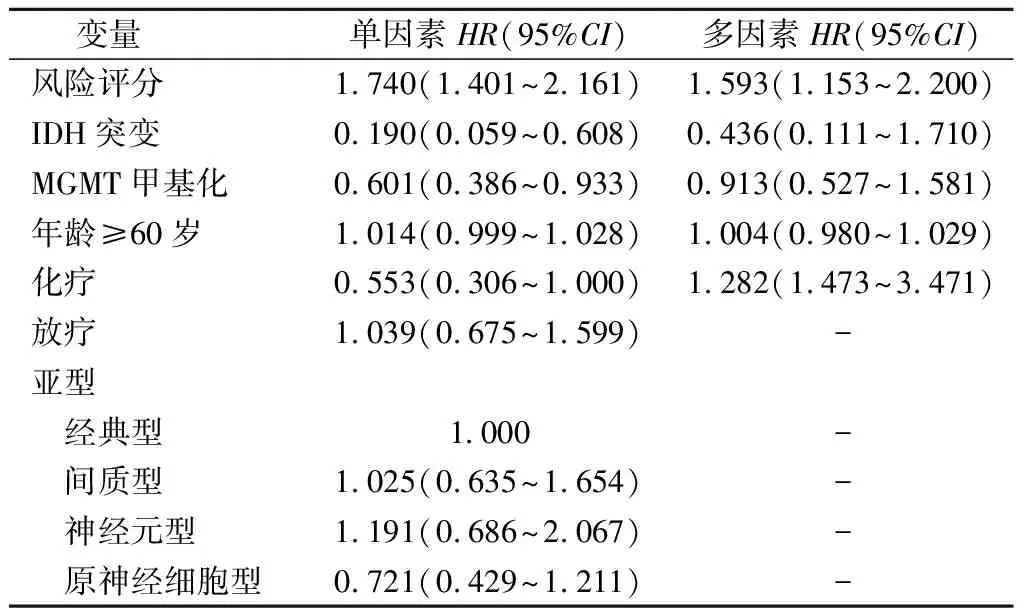
表2 GBM復發影響因素的Cox回歸分析結果
2.5高風險與低風險患者差異通路富集分析對149例患者進行GBM復發風險評分,高于評分中位數為高風險,低于中位數為低風險。通過DAVID Bioinformatics Resources 6.8(https://david.ncifcrf.gov/)在線對兩組患者進行差異通路富集分析。如圖2所示,KEGG通路富集分析結果顯示,共有12個細胞通路在兩組患者之間存在差異。
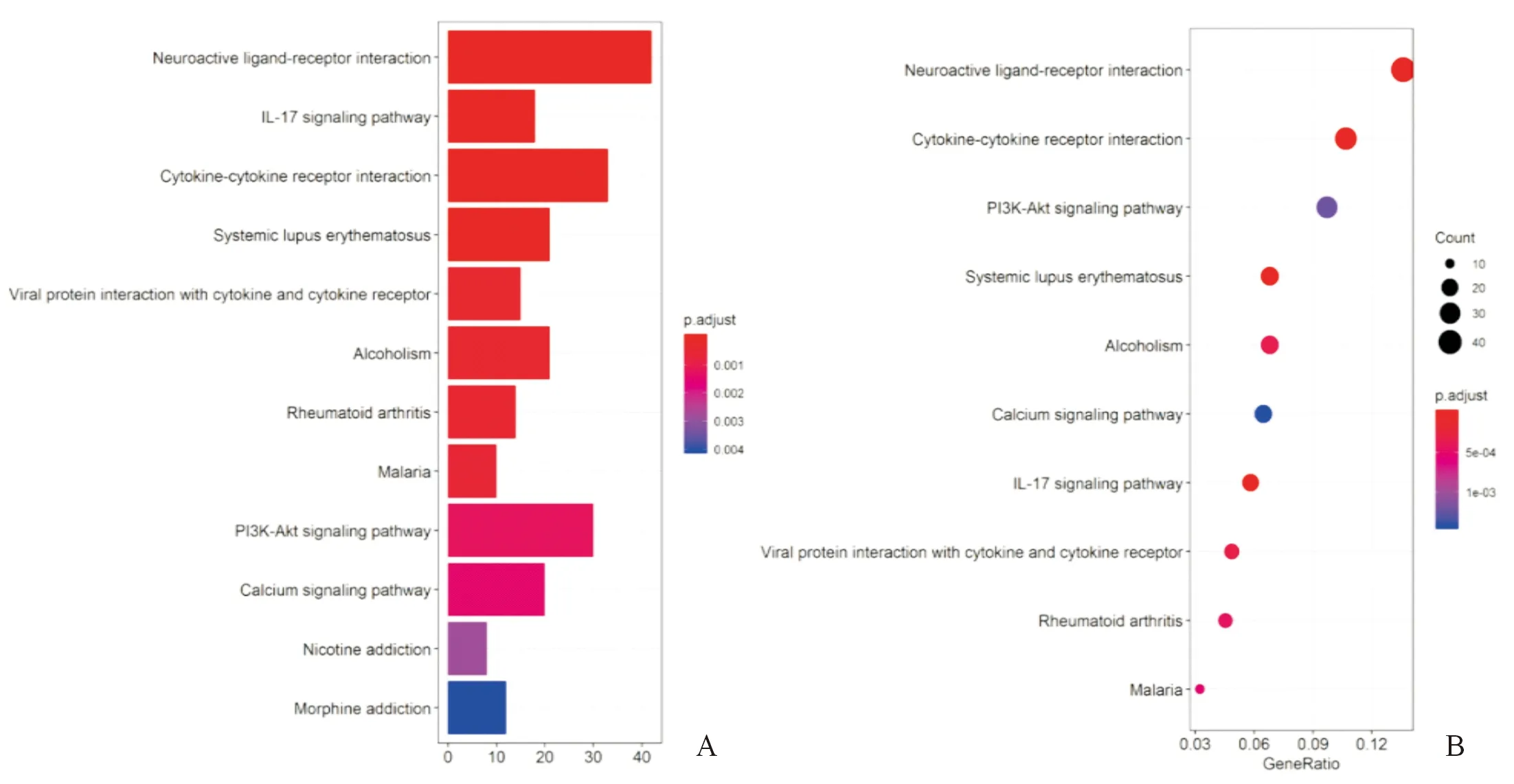
圖2 高風險和低風險人群之間差異基因的功能和途徑富集分析
3 討論
GBM具有浸潤性生長的特點,手術難以完全切除腫瘤,80%~90%的患者會在原發灶位置復發而導致預后極差[1]。GBM復發已是臨床研究中需重點解決的問題。
本研究利用TCGA數據,以GBM是否復發將患者分為兩組,采用GSEA和GSVA兩種分析方法尋找差異表達的信號通路,篩選出PI3K/AKT/mTOR信號通路;然后應用單因素Cox回歸分析從105個PI3K/AKT/mTOR信號通路中篩選出12個與GBM的OS顯著相關的基因;再經多因素Cox回歸分析篩選出MAP2K6、MAPK1、PTEN、MAP2K3和RAC1等5個基因。PI3K/AKT/mTOR信號通路與炎癥反應關系密切[6-7]。多篇文獻證實PI3K/AKT/mTOR信號通路與GBM的進展密切相關:有研究[5]提示上皮膜蛋白1通過PI3K/AKT/mTOR信號通路可促進GBM的進展。PI3K可能是GBM治療的靶標,PI3K抑制劑可用于GBM的治療[8-9]。這些為本研究選擇該通路基因構建風險評分模型提供了理論基礎。
本研究最終基于MAP2K6、MAPK1、PTEN、MAP2K3和RAC1構建了GBM復發風險評分模型。已有文獻證實作為預測模型主體的5個基因與腫瘤的治療存在一定聯系。MAP2K3,絲裂原活化的蛋白激酶激酶3,已成為一種新的抗癌治療靶點[10]。MAP2K6-FP可誘導腫瘤細胞自噬,從而增強卵巢癌細胞對紫杉醇的敏感性[11]。調節MAPK1表達可以抑制子宮頸癌細胞的增殖、遷移和侵襲能力[12]。PTEN為腫瘤抑制基因,其功能喪失與多種腫瘤的發生發展有關[12-15],其與GBM的DNA甲基化密切相關[16]。RAC1在胃腺癌上皮到間充質轉化和癌癥干細胞樣細胞表型中起到重要作用[17]。本研究基于這5個基因建立了GBM復發風險評分模型,回歸分析結果表明該風險評分是GBM的預后預測因子,其HR(95%CI)為1.593(1.153~2.200)。
雖然風險評分可以作為GBM復發的獨立預測因素,但是由于本研究樣本量和試驗條件的限制,該模型的實用性仍需要擴大樣本量進一步驗證。這5個基因是否可以作為GBM治療的靶點也需要通過實驗來進一步驗證。我們利用該模型將GBM患者分為高風險和低風險組,對兩組進行差異通路富集分析,找到12條差異通路,這些通路將為未來的研究提供方向。

