轉Cry1Ah基因抗蟲玉米HGK60對生物多樣性的影響
陳彥君, 李俊生, 閆 冰, 關 瀟*, 陶 均
1.中國環境科學研究院, 國家環境保護區域生態過程與功能評估重點實驗室, 北京 100012 2.海南大學熱帶作物學院, 海南 海口 570228 3.江西省科學院能源研究所, 江西 南昌 330096
轉基因作物商業化25年以來,總種植面積累計達到25×108hm2[1]. 在作物生長過程中,蟲害的發生以及除草劑的施用嚴重危害著其產品品質和產量. 通過轉基因技術導入抗蟲、抗除草劑基因可有效降低靶標害蟲的數量,降低作物對化學殺蟲劑的依賴,緩解除草劑對作物的影響[2],但其是否會對生態環境造成影響仍需要進行全方位的安全性測定,這也是轉基因作物環境安全評價的重要內容.
對生物多樣性的影響研究作為轉基因作物環境安全釋放的必要環節之一,目前已開展大量相關研究,但結論不盡相同. 部分研究表明,轉基因作物種植對根際土壤微生物[3-6]、昆蟲[7-10]、雜草[10-12]等的群落結構與組成無顯著影響,但也有學者認為其種植會影響田間生物多樣性[13-16],研究結果的差異表明轉基因作物種植后可能對生物多樣性產生的影響并非一概而論,受體及外源基因等的差異都可能影響研究結果. 因此,對于轉基因作物的安全性評價工作應遵循“個案原則”[17].
Cry1Ah基因的主要靶標動物為鱗翅目昆蟲,對其具有較高的殺蟲活性,但對家蠶等重要經濟昆蟲的殺蟲活性相對較低,表現出良好的環境安全性[18],具有廣闊的應用前景,但其是否會對生物多樣性產生顯著影響仍處于探索階段. 鑒于此,該文以轉Cry1Ah基因抗蟲玉米HGK60為研究對象,重點討論其對根際土壤微生物、田間節肢動物以及田間雜草的影響,以期為轉Cry1Ah基因抗蟲玉米HGK60的環境安全評價提供科學依據,為生物安全管理的健康發展提供支持.
1 材料與方法
1.1 研究區域概況
該研究于中國農業科學研究院海南樂東南繁生物育種試驗基地進行. 該基地位于海南島西南部樂東黎族自治縣,屬熱帶季風性氣候,年均氣溫為23.9~25.2 ℃,光照充足,熱量豐富,年降水量約 1 000 mm,但水量不平衡,干季、雨季分明. 選用玉米品種為轉Cry1Ah基因抗蟲玉米HGK60(簡稱“HGK60”)及其對照常規玉米鄭58(簡稱“鄭58”),均由中國農業科學院生物技術研究所提供.
試驗采取隨機區組設計,試驗組為HGK60,對照組為鄭58,每個處理均設置4個重復,每個重復(小區)面積為150 m2(10 m×15 m). 各小區間設置1 m寬的空白隔離帶,種植方式為一穴一粒、一穴兩粒循環播種,行距為60 cm,株距為25 cm. 玉米于2018年11月播種,田間管理同常規種植.
1.2 樣品采集與處理
1.2.1根際土壤樣品的采集、DNA提取、PCR擴增、高通量測序
樣品采集. 在玉米生長的苗期、喇叭口期、抽穗期、完熟期以及玉米收獲后,采用“抖根法”按照五點采樣法采集根際土壤樣品,取樣時避開道路等可能影響因素. 土壤樣品用干冰保存帶回置于-80 ℃ 下.
DNA提取. 選用FastDNA? SPIN Kit for soil(MP Biomedicals, Santa Ana, CA, US)試劑盒提取根際土壤微生物總DNA,采用超微量分光光度計檢測其濃度、純度.
PCR擴增. 針對V1~V9區,以稀釋后的基因組DNA為模板,使用通用引物8F(5′-AGAGTTTGATCC TGGCTCAG-3′)和1509R(5′-GNTACCTTGTTACGAC TT-3′)進行PCR擴增. PCR反應體系(50 μL):Trans Fastpfu 1 μL,5×Buffer 10 μL,5×StimuLate 5 μL,dNTPs(2.5×10-3mol/L each) 5 μL,Primer Mix(1 μmol/L) 2 μL,gDNA 1 μL,NFW 26 μL. PCR反應條件:預變性溫度98 ℃(2 min);變性溫度95 ℃(30 s),退火溫度60 ℃(45 s),延伸溫度72 ℃(90 s),35個循環后72 ℃終止延伸10 min. 根據PCR產物濃度進行等質量混樣,充分混勻后使用1×TAE 濃度為2%的瓊脂糖凝膠電泳純化PCR產物,割膠回收目標條帶. 所用試劑盒為QIAGEN公司QIAquick@ Gel Extraction Kit凝膠回收試劑盒.
高通量測序. 使用PACIFIC BIOSCIENCES(PacBio)公司的SMRTbellTMTemplate Prep Kit建庫試劑盒進行文庫的構建,通過Qubit定量和FEMTO Pulse檢測片段大小,庫檢合格后使用PacBio的Sequel平臺進行16S全長rDNA測序. 該研究測序工作委托北京諾禾致源生物信息科技有限公司完成.
1.2.2節肢動物調查
在玉米生長的苗期、喇叭口期、抽穗期和完熟期,采用五點法于每個生育期分別進行3次節肢動物調查:①直接觀察法,各點位調查15株玉米,記錄植株上節肢動物種類和數量;②陷阱調查法,各小區埋設25個(每個點位放5個)塑料杯,塑料杯直徑7.5 cm,間隔0.5 m,于調查的前一天在塑料杯中放置1/3容量的5%防凍液,24 h后記錄節肢動物的種類和數量.
1.2.3雜草調查
分別在玉米生長的苗期、喇叭口期、抽穗期、完熟期于各小區按照五點法,避開調查節肢動物時所設陷阱,選取5個1 m2(1 m×1 m)的樣方,調查并記錄樣方內雜草種類和數量.
1.3 數據統計與分析
1.3.1根際土壤微生物
1.3.1.1測序數據處理
將PacBio下機數據導出后,使用Lima軟件根據Barcode序列區分各樣本數據. 進行CCS(Circular Consensus Sequencing)校正及長度過濾,過濾含有連續相同堿基數>8的序列及引物切除. 對處理后得到的序列進行去除嵌合體處理,通過UCHIME v7.0.1090與Silva全長數據庫進行比對檢測嵌合體序列,去除嵌合體序列,得到最終有效數據.
1.3.1.2OTU聚類和物種注釋
利用Uparse v7.0.1001軟件對所有樣品的全部有效數據進行聚類,以97%的一致性將序列聚類成可操作分類單元OTUs(Operational Taxonomic Units). 依據相應算法原則,篩選OTUs中出現頻數最高的序列作為其代表序列. 對OTUs代表序列進行物種注釋,用Mothur方法與Silva(http://www.arb-silva.de)的SSUrRNA數據庫進行物種注釋分析(設定閾值為0.8~1),獲得分類學信息并統計各分類水平上各樣本的群落組成. 使用MUSCLE v3.8.31軟件進行快速多序列比對,得到所有OTUs代表序列的系統發生關系. 最后以數據量最少的樣品為標準,對各樣品數據進行均一化處理,后續分析均基于均一化處理后的數據進行. 使用R v2.15.3軟件繪制門水平上的前10位物種相對豐度柱形圖與屬水平上的前35位物種相對豐度聚類熱圖,并對同一生育期的組間差異進行分析(T檢驗).
1.3.1.3樣品復雜度分析(alpha diversity)
使用Qiime v1.9.1軟件計算Shannon-Wiener指數、Simpson指數、Chao1指數、ACE指數、Phylogenetic diversity指數(簡稱“PD指數”),使用R v2.15.3軟件進行alpha多樣性指數組間差異分析(非參數Wilcoxon檢驗).
1.3.1.4多樣品比較分析(beta diversity)
用Qiime v1.9.1軟件計算Weighted-Unifrac距離. 使用R v2.15.3軟件進行(NMDS),并進行beta多樣性指數組間相似性分析(Analysis of Similarities, ANOSIM).
1.3.2節肢動物與雜草的統計與分析
統計分析玉米各生育期田間節肢動物和雜草的群落結構與組成,計算各生態學指數.
Margalef指數(Dmg):
Dmg=(S-1)/lnN
(1)
Shannon-Wiener指數(H):
(2)
Simpson指數(D):
(3)
Pielou指數(J):
J=H/lnS
(4)
式中:S為物種個數;Pi=Ni/N,其中Ni為第i個物種的個體數,N為總個體數[19].
利用Excel 2010軟件進行數據整理,利用SPSS 16.0軟件進行統計分析,進行兩兩T檢驗.
2 結果與討論
2.1 轉Cry1Ah基因抗蟲玉米HGK60對根際土壤微生物的影響
將根際土壤樣品的高通量測序序列經過質控過濾后,共得到 633 812 條有效序列. 各樣品的高通量測序序列范圍為 6 480~55 762 條,平均有效序列為 21 127 條. 根據樣品中最小有效序列數,每個樣品隨機挑選 6 480 條有效序列進行樣品測序深度的均一化處理. 以97%的一致性(Identity)將其聚類成OTUs,共注釋到34門、188科、524屬.
2.1.1物種相對豐度統計
統計根際土壤微生物門水平上的物種相對豐度,豐度前10位的門分別為厚壁菌門(Firmicutes)、變形菌門(Proteobacteria)、酸桿菌門(Acidobacteria)、放線菌門(Actinobacteria)、浮霉菌門(Planctomycetes)、擬桿菌(Bacteroidetes)、綠彎菌門(Chloroflexi)、芽單胞菌門(Gemmatimonadetes)、未鑒定出的細菌(unidentified-bacteria)、藍細菌門(Cyanobacteria). 其中,厚壁菌門在各處理中的相對豐度為18.88%~45.61%、變形菌門為24.52%~37.68%、酸桿菌門為9.28%~13.16%,且在各處理中相對豐度均大于5%,為優勢種群.
結合T檢驗,比較HGK60與鄭58根際土壤微生物發現,酸桿菌門、浮霉菌門、綠彎菌門在各生育期的相對豐度均差異不顯著(P>0.05);厚壁菌門僅在抽穗期和完熟期表現為HGK60顯著高于鄭58(P<0.05),變形菌門僅在抽穗期和完熟期表現為HGK60顯著低于鄭58(P<0.05),放線菌門僅在完熟期表現為二者差異顯著(P<0.05),擬桿菌門、芽單胞菌門僅在抽穗期表現為二者差異顯著(P<0.05),但收獲后HGK60與鄭58在前10個門的相對豐度差異均不顯著(P>0.05)(見圖1).
根據所有樣品屬水平上的物種注釋,選取相對豐度前35位的屬繪制聚類熱圖(見圖2). 比較同一生育期HGK60與鄭58根際土壤微生物發現,部分物種存在一定差異,但僅出現在某個生育期,并未在整個生育期持續出現. 苗期,Chitinophaga、金黃桿菌屬(Chryseobacterium)等的相對豐度均表現為HGK60低于鄭58,寡養單胞菌屬(Stenotrophomonas)、Pelomonas等的相對豐度則表現為HGK60高于鄭58;喇叭口期,嗜糖假單胞菌屬(Pelomonas)、Occallatibacter等的相對豐度表現為HGK60高于鄭58;抽穗期,Haliangium、Crenobacter等的相對豐度表現為HGK60低于鄭58;完熟期,Aquicella、Dechlorobacter等的相對豐度均表現為HGK60低于鄭58. 這表明HGK60的種植會在某些生育期對部分屬水平上的物種產生一定影響.
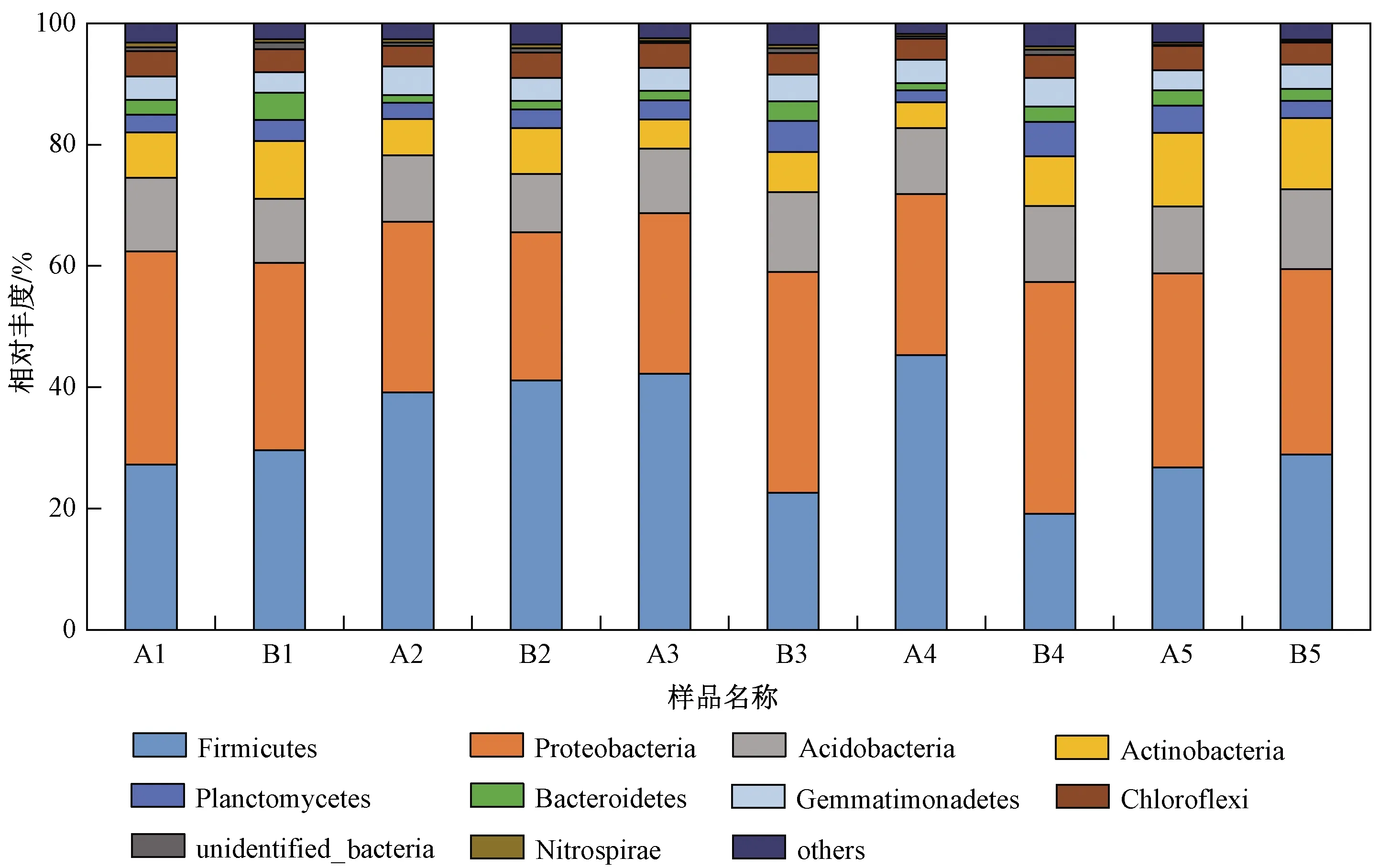
圖1 門水平上的前10的物種相對豐度Fig.1 The relative abundance of top 10 soil microorganisms at the phyla level
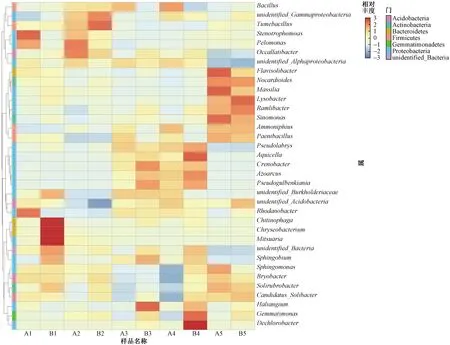
圖2 不同植株根際土壤中微生物前35個屬相對豐度聚類熱圖Fig.2 The relative abundance histogram of top 35 soil microorganisms at the genus level by heatmap
從生育期的角度來看,玉米根際土壤微生物部分屬水平上的物種呈現一定的季節性差異. 溶桿菌屬(Lysobacter)、類諾卡氏屬(Nocardioides)等的相對豐度主要表現為收獲后相對較高,玉米生長期間則相對較低;Tumebacillus等的相對豐度表現為喇叭口期明顯高于其他生育期;Pseudogulbenkiania、Crenobacter、Pseudolabrys、Aquicella等的相對豐度主要表現為抽穗期、完熟期相對較高,其他生育期則相對較低. 部分物種呈現一定的季節性特征,說明生育期是影響根際土壤微生物的因素之一. 但是由于聚類熱圖只能通過圖中不同處理間顏色的差異對處理間差異進行判斷,無法進行有效量化,需要結合多樣性統計結果做進一步分析.
2.1.2alpha多樣性指數與beta多樣性聚類分析
對HGK60與鄭58各生育期根際土壤細菌群落的alpha多樣性進行非參數Wilcoxon檢驗. Shannon-Wiener指數分析結果顯示,HGK60與鄭58僅在抽穗期、完熟期差異顯著(P<0.05);Simpson指數、Chao1指數在各生育期均表現為二者差異不顯著(P>0.05);ACE指數僅表現為收獲后二者差異顯著(P<0.05);PD指數則表現為僅抽穗期、完熟期二者差異顯著(P<0.05). 從整體上看,HGK60的種植不會對土壤微生物alpha多樣性產生持續性影響,部分影響主要存在于抽穗期與完熟期,除ACE指數外,收獲后HGK60與鄭58在各生態指標上差異均不顯著(P>0.05)(見表1).
在beta多樣性分析中,根據不同生育期玉米根際土壤樣品的測序結果,基于Weighted-UniFrac進行NMDS分析,以此對HGK60與鄭58根際土壤微生物群落結構的相似性及差異性進行定性分析(見圖3). 結合ANOSIM分析,比較同一生育期HGK60與鄭58,發現抽穗期、完熟期二者間差異顯著(P<0.05),苗期、喇叭口期、收獲后二者均差異不顯著(P>0.05),表明HGK60種植產生的土壤微生物群落結構的影響僅出現在某些生育期,并未在整個生長階段持續存在,且收獲后差異不顯著(P>0.05). 從生育期的角度來看,不同生育期玉米根際土壤樣品細菌群落存在明顯差異,喇叭口期與抽穗期、完熟期與收獲后均表現為差異顯著(P<0.05).

表1 玉米根際土壤微生物的alpha多樣性指數Table 1 Alpha diversity indexes of rhizosphere soil microorganism

圖3 非度量多維尺度(NMDS)分析Fig.3 Non-metric multidimensional scaling
2.2 轉Cry1Ah基因抗蟲玉米HGK60對田間節肢動物的影響
在HGK60與鄭58田間共調查到節肢動物 19 835 頭,二者分別有 9 727 和 10 108 頭,隸屬于7目19科60種(見表2). 比較同一生育期HGK60與鄭58玉米田間節肢動物數量分析,螟蛾科在苗期、喇叭口期、抽穗期均表現為HGK60顯著低于鄭58(P<0.05),其他物種的差異只表現在某個生育期,并不會在整個生育期持續出現(見表3),夜蛾科僅在抽穗期表現為HGK60顯著低于鄭58(P<0.05),緣蝽科、盲蝽科、葉蟬科僅在喇叭口期表現為HGK60顯著高于鄭58(P<0.05),飛虱可僅在完熟期HGK60顯著低于鄭58(P<0.05),蚜科僅在苗期、完熟期表現為二者差異顯著(P<0.05),草蛉科僅在抽穗期表現為HGK60顯著低于鄭58(P<0.05),瓢蟲科僅在苗期表現為HGK60顯著高于鄭58(P<0.05),薊馬總科則僅在喇叭口期HGK60顯著低于鄭58(P<0.05).

表2 田間節肢動物群落的目、科、種分布Table 2 Patterns of the arthropod community in the fields in different orders, families and species
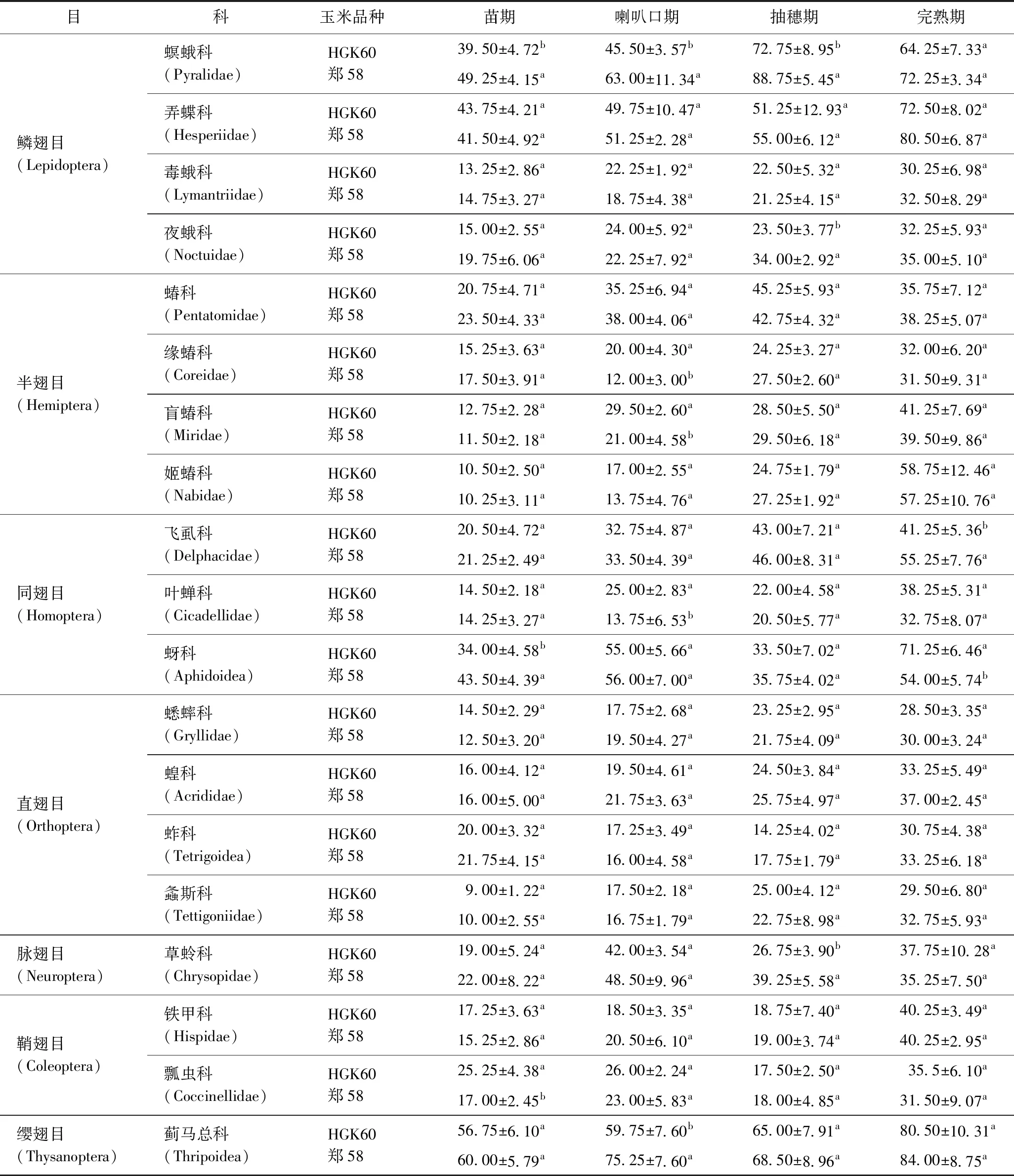
表3 各生育期田間節肢動物數量Table 3 The number of arthropods in each growth period 頭
比較HGK60與鄭58田間節肢動物群落的Margalef指數發現,僅抽穗期表現為HGK60顯著高于鄭58(P<0.05),其他生育期均表現為二者差異不顯著(P>0.05)〔見圖4(A)〕. Shannon-Wiener指數分析結果顯示,HGK60與鄭58在各生育期差異均不顯著(P>0.05)〔見圖4(B)〕. Simpson指數表現為僅喇叭口期HGK60與鄭58差異顯著(P<0.05),其他生育期二者差異均不顯著(P>0.05)〔見圖4(C)〕. Pielou指數分析結果顯示,HGK60與鄭58田間節肢動物Pielou指數的變化范圍在0.9~1.0之間,且二者在各生育期差異均不顯著(P>0.05)〔見圖4(D)〕.

圖4 田間節肢動物群落各生態指標Fig.4 The ecological indexes of arthropods in the fields
2.3 轉Cry1Ah基因抗蟲玉米HGK60對田間雜草的影響
調查結果顯示,HGK60與鄭58田間雜草發生種類有8科16種,多為一年生雜草(見表4). 各生育期內HGK60與鄭58的田間雜草密度差異均不顯著(P>0.05)(見圖5). 比較田間各雜草種類,發現僅喇叭口期的蒼耳表現為HGK60與鄭58差異顯著(P<0.05),其他生育期、其他物種均表現為二者差異不顯著(P>0.05).
由圖6可見,HGK60與鄭58田間雜草群落Margelef指數、Shannon-Wiener指數、Simpson指數的變化趨勢一致,且各生育期二者無顯著差異(P>0.05);HGK60與鄭58的Pielou指數變化范圍在0.8~1.0之間,HGK60僅在苗期顯著高于鄭58(P<0.05),其他生育期二者差異不顯著(P>0.05).
2.4 討論
2.4.1轉Cry1Ah基因抗蟲玉米HGK60對根際土壤微生物的影響
該研究結果顯示,HGK60種植后對根際土壤微生物的影響僅出現在某些生育期,并不會在整個生育期持續出現. 對門水平上相對豐度前10位根際土壤微生物的研究發現,厚壁菌門、變形菌門、酸桿菌門在各生育期均為優勢種群,其中厚壁菌門與變形菌門的相對豐度均在抽穗期和完熟期表現為HGK60與鄭58差異顯著,其他生育期之間差異均不顯著;酸桿菌門則在各生育期均表現為二者差異不顯著. 玉米收獲后前10個門均表現為HGK60與鄭58差異不顯著,認為HGK60的種植不會對玉米根際土壤微生物門水平產生持續且顯著的影響. 厚壁菌門的內在物種具有降解土壤中難溶化合物[20]、固定空氣中氮[21]、防治植物病蟲害[22]等作用,具有較強的降解能力和代謝活性,其在抽穗期、完熟期HGK60根際土壤中的相對豐度顯著高于鄭58,表明該生長階段HGK60的種植可有效增強土壤固氮、病蟲害防治及代謝能力等. 變形菌門廣泛分布于各類環境中,其在農業、環保、衛生等領域具有重要價值與作用[23-25]. 變形菌門的相對豐度在抽穗期、完熟期HGK60根際土壤中顯著低于鄭58,但收獲后二者差異不再顯著,表明HGK60的種植對變形菌門的影響過程相對較短且不持續.

表4 田間雜草數量調查結果Table 4 The number of each species in the fields 株

圖5 田間雜草密度Fig.5 Weed density in the fields

圖6 田間雜草各生態指標Fig.6 The ecological indexes of weeds in the fields
對前35個屬的研究發現,同一生育期HGK60與鄭58根際土壤微生物中金黃桿菌屬、寡養單胞菌屬、嗜糖假單胞菌屬等的相對豐度存在差異,但亦只出現在某些生育期,并未在整個生育期持續出現. 值得注意的是,金黃桿菌屬可降解苯胺、甲基叔丁基醚等難降解有機物[26];寡養單胞菌屬對甲基對硫磷具有較高的降解性能[27];嗜糖假單胞菌屬也具有降解有機物的作用[28]. 雖然以上物種均未對玉米根際土壤產生持續且顯著的影響,但仍值得關注,以充分發揮其功效,增加其對土壤微環境的良性作用.
對根際土壤微生物alpha多樣性的研究結果顯示,HGK60種植對土壤微生物的影響主要存在于抽穗期與完熟期,收獲后HGK60與鄭58在Shannon-Wiener指數、Simpson指數、Chao1指數、PD指數上的差異均不顯著;beta多樣性研究亦發現,抽穗期、完熟期HGK60與鄭58差異顯著,苗期、喇叭口期、收獲后二者均差異不顯著,與alpha多樣性的研究結果較為一致,均表明HGK60的種植雖在部分生育期對根際土壤微生物產生了顯著影響,但該影響并未持續存在,玉米收獲后HGK60與鄭58間差異不顯著. 已有學者對轉基因作物根際土壤微生物開展了研究,但并未得到十分明確的結論. 部分研究認為轉基因作物種植對根際土壤微生物無顯著影響[29-34];但也有研究認為轉基因作物的種植會對土壤微生物群落結構、多樣性等產生顯著影響[35-36]. 上述差異說明轉基因作物種植對土壤微生物多樣性的影響可能與作物類型、轉入的外源基因、研究方法等有關,不可一概而論,需要進一步深入研究.
從生育期的角度分析玉米根際土壤微生物的動態變化,發現生育期的推進會對其產生一定影響. ANOSIM分析結果顯示,HGK60與鄭58均表現出在喇叭口期與抽穗期、完熟期與收獲后兩兩生育期間的顯著差異. 一些學者也得出了生育期會對作物根際土壤微生物產生一定影響的結論[37-39].
2.4.2轉Cry1Ah基因抗蟲玉米HGK60對田間節肢動物的影響
通過對田間節肢動物群落的研究發現,HGK60主要對螟蛾科昆蟲有抑制作用. 從整體上看,HGK60種植對田間節肢動物的多個生態指標均未產生明顯影響,差異僅出現在個別生育期,并未在整個生育期持續出現. 部分研究亦得出了轉基因玉米種植不會對田間節肢動物產生顯著影響的結論[7-9],與筆者所得結果較為一致. 但是也有研究得出了不同的結論,認為轉基因抗蟲作物的種植會在一定程度上造成田間天敵昆蟲數量的下降以及非靶標昆蟲數量的上升[40];也有部分研究認為轉基因抗蟲作物可能會提高田間節肢動物群落的豐富度和多樣性,從而提高生態系統穩定性[41].
2.4.3轉Cry1Ah基因抗蟲玉米HGK60對田間雜草的影響
對田間雜草的研究結果顯示,HGK60的種植對田間種類、數量及各生態學指標等均無顯著影響,與趙思楠[42]得出的轉G10evo-epsps基因和Cry1Ab/Cry2Aj融合基因抗蟲耐草甘膦玉米雙抗12-6對田間雜草多樣性無顯著影響的研究結果較為一致;劉來盤等[10]對抗除草劑大豆田間雜草進行調查,認為其對雜草群落組成與多樣性也無顯著影響. 但也有研究認為,轉基因作物種植可改變田間單子葉、雙子葉雜草比例[43],其競爭優勢搶占生存空間及次生代謝發生改變,可能產生“化感”作用,抑制雜草生長,抗蟲作物通過影響害蟲取食習性變化也可對田間雜草產生間接影響[44]. 從已有研究結果來看,不同作物、不同轉入基因等對田間雜草的研究結果差異較大,表明了轉基因作物對環境壓力反應的復雜性.
3 結論
a) 轉Cry1Ah基因抗蟲玉米HGK60種植對根際土壤微生物的影響僅出現在某些生育期,其對抽穗期、完熟期的影響相對較大,但該影響并不會在玉米的整個生長階段持續出現,玉米收獲后HGK60與鄭58差異不顯著(P>0.05);生育期是影響根際土壤微生物的重要因素之一.
b) 轉Cry1Ah基因抗蟲玉米HGK60對螟蛾科昆蟲具有顯著抑制作用(P<0.05),但對田間節肢動物的種類及Margalef指數、Shannon-Wiener指數、Simpson指數、Pielou指數等生態學指標均無顯著影響(P>0.05).
c) 轉Cry1Ah基因抗蟲玉米HGK60種植對田間雜草密度及Margalef指數、Shannon-Wiener指數、Simpson指數、Pielou指數等生態學指標均無顯著影響(P>0.05).

