內熱針通過調控Bcl-2/Bax平衡改善大鼠膝骨關節炎損傷*
萬 超,譚華儒,燕 軍,蔡 凌,黃金良,任英杰,李二梅,趙 美
(1. 深圳市中西醫結合醫院,廣東 深圳 518104; 2. 深圳市寶安區中醫院, 廣東 深圳 518101)
膝骨關節炎(knee osteoarthritis,KOA)是一種關節軟骨發生退變或被破壞的膝關節病,主要病理變化包括軟骨下骨板及關節邊緣骨質增生、局部炎癥等[1]。軟骨細胞作為關節軟骨中唯一的細胞成分,其凋亡情況影響著關節軟骨的維持及更新[2-3]。B淋巴細胞瘤-2基因(b-cell lymphoma-2,Bcl-2)家族成員在調控線粒體凋亡通路方面發揮著重要作用。Bcl-2-Associated X(Bax)為促凋亡基因,而Bcl-2可抑制凋亡[4-5]。如何有效延緩軟骨細胞凋亡可能是緩解KOA進展的關鍵所在。內熱針起源于古代針灸技術中“九針”的一種,在治療上較常規針灸具有一定優勢[6]。前期研究發現,內熱針療法對KOA大鼠具有一定的治療效果[7],但內熱針有效性機制研究開展尚少。本研究通過觀察內熱針對KOA模型大鼠的治療效果,探究Bcl-2/Bax平衡與其治療作用的聯系,以期為KOA的臨床治療提供新方向。
1 材料與方法
1.1 主要試劑及儀器
1.1.1 主要試劑 大鼠白介素-1β,interleukin-1β,IL-1β(No. RA20030),Bioswamp公司;腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)(No. RA20035)和白介素-17(interleukin-17,IL-17)(No. RA20117)酶聯免疫吸附測定(enzyme linked immunosorbent assay,ELISA)試劑盒;RNA提取試劑盒(貨號9767),TAKARA公司;兔抗大鼠Bcl-2抗體(No. ab59348,稀釋比1∶500)、兔抗大鼠Bax抗體(No. ab32503,稀釋比1∶1000),英國Abcam公司;TUNEL Apoptpsis Assay Kit(No. PAB180028),Bioswamp公司。
1.1.2 主要儀器 JK-Ⅰ內熱針(濟寧佳科公司,型號0.5 mm)針體長6.5 cm,直徑0.5 mm,針柄長3.5 cm,直徑2.2 mm;RS15 A,中頻脈沖電治療儀(廣州睿盛公司);Real-Time System熒光定量PCR儀(美國BIO-RAD);ELX-808IU酶標儀(美國Bio-Tek);Tanon-5200全自動化學發光分析儀(上海天能)。
2 方法
2.1 動物分組
雄性SPF級Wistar大鼠32只,體質量200 g±20 g,購自湖北省實驗動物中心,動物許可證號SCXK(鄂)2016-0019。適應性喂養1周后隨機分為正常組、模型組、電療組和治療組4組各8例。
2.2 模型構建
除正常組外,其他組大鼠均采用經改良后的Videman法[8-9]構建KOA模型,6周后每組隨機抽取1只大鼠處死并取關節軟骨觀察病理學變化,確定建模成功后進行分組治療,正常組、模型組不給予任何治療。電療組造模成功1周后,采用中頻脈沖電療大鼠膝蓋周圍軟組織條索、硬結等部位,每天30 min,1周為1個療程,中間休息2 d,持續3周。治療組造模成功1周后,選取與電療組大鼠相同部位的3~5點作為內熱針進針部位,每周1次,持續3周。
2.3 樣本采集
腹腔注射戊巴比妥溶液(40 mg/kg)進行麻醉,腹主動脈放血致死。收集大鼠膝關節滑膜液用于ELISA檢測,收集膝關節軟骨組織,部分固定用于制作切片,剩余保存于-80 ℃。
2.4 HE染色
將固定液中的膝關節軟骨組織取出置于包埋盒中,脫水后浸蠟包埋。將蠟塊切成厚度為4 μm的切片,脫蠟后進行蘇木精-伊紅染色 (hematoxylin-eosin staining,HE)。中性樹膠封片,顯微鏡觀察各組大鼠膝關節軟骨組織病理學變化。
2.5 膝關節滑膜液炎癥因子IL-1β、TNF-α和IL-17表達水平檢測
分別依照大鼠IL-1β、TNF-α和IL-17 ELISA試劑盒說明書操作,檢測大鼠膝關節滑膜液炎癥因子IL-1β、TNF-α和IL-17的表達水平。
2.6 RT-qPCR檢測軟骨組織中Bcl-2及Bax表達水平
提取軟骨組織總RNA,反轉錄合成cDNA,以其為模板進行熒光定量PCR檢測。引物由上海生物工程有限公司合成,序列如下:Bcl-2:F 5'-CACAGAGGGGCTACGAGT-3',R 5'-CAGGCTGGAAGGAGAAGA-3';Bax:F 5'-TGGTTGCCCTCTTCTA-3',R 5'-CACCCTGGTCTTGGAT-3';GAPDH:F 5'-AACAAGCAACTGTCCCTGAGC-3',R 5'-GTAGACAGAAGGTGGCACAGA-3'。
2.7 Western bolt檢測軟骨組織中Bcl-2及Bax蛋白表達
提取大鼠軟骨組織蛋白,定量后以20 μg蛋白上樣量進行SDS-PAGE凝膠電泳,將蛋白轉至PVDF膜。室溫封閉1 h,PBS洗膜,分別加入Bcl-2、Bax及GAPDH抗體,室溫孵育1 h;PBS洗膜,加入HRP標記的二抗,室溫孵育0.5 h;PBS洗膜,加入化學放光試劑,曝光顯影。
2.8 TUNEL染色觀察軟骨組織中軟骨細胞凋亡水平
將固定液中的膝關節軟骨組織取出,脫水后浸蠟包埋。將蠟塊切成厚度為5 μm的切片,脫蠟后進行TUNEL染色。中性樹膠封片,顯微鏡下觀察切片中軟骨細胞的凋亡水平。
2.9 統計學方法
3 結果
3.1 各組大鼠膝關節軟骨組織病理學觀察
正常組大鼠軟骨組織結構正常,細胞數目較多;模型組軟骨組織結構散亂,軟骨細胞數目少,存在炎癥細胞浸潤現象;電療組及治療組相較于模型組,軟骨組織結構良好,軟骨細胞較多且炎性細胞減少(見圖1)。
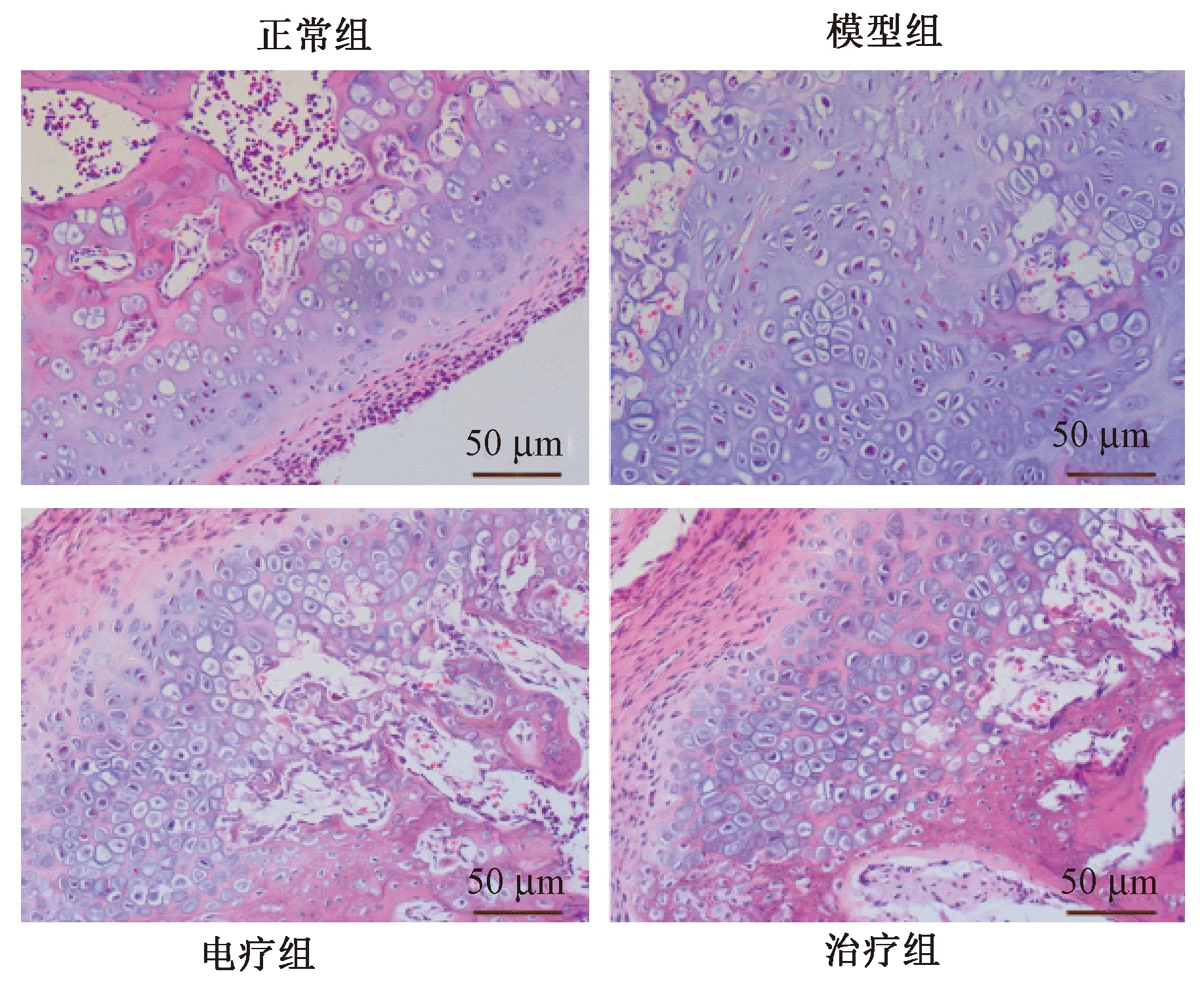
圖1 各組大鼠膝關節軟骨組織HE染色(200×)
3.2 ELISA檢測各組大鼠滑膜液炎癥因子IL-1β、TNF-α和IL-17含量
表1示,與正常組比較,模型組大鼠滑膜液中IL-1β、TNF-α和IL-17含量顯著增加(均P<0.01);與模型組比較,電療組和治療組滑膜液中IL-1β、TNF-α和IL-17含量顯著降低(均P<0.01);與電療組比較,治療組滑膜液中IL-1β和IL-17含量顯著降低(均P<0.01),而TNF-α含量無顯著變化。
表1 各組大鼠滑膜液中IL-1β、TNF-α與IL-17含量比較
3.3 各組大鼠軟骨組織中Bcl-2、Bax mRNA及蛋白的表達
表2圖2示,與正常組比較,模型組大鼠軟骨組織中促凋亡基因Bax在mRNA及蛋白水平表達顯著升高(P<0.01),而抑制凋亡基因Bcl-2的表達顯著降低(P<0.01);與模型組比較,電療組和治療組大鼠Bax表達均顯著降低(均P<0.01),而Bcl-2的表達均顯著升高(均P<0.01);與電療組比較,治療組大鼠Bax表達降低顯著(P<0.01)。且與模型組或電療組比較,治療組大鼠Bax/Bcl-2水平顯著降低(P<0.01)。
表2 各組大鼠軟骨組織中Bcl-2及Bax在mRNA及蛋白水平表達比較
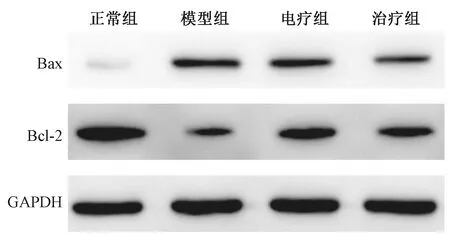
圖2 各組大鼠軟骨組織中Bcl-2及Bax蛋白印跡表達
3.4 TUNEL染色觀察各組大鼠軟骨組織中軟骨細胞凋亡水平比較
圖3示,與正常組比較,模型組大鼠膝關節軟骨組織中軟骨細胞凋亡情況嚴重,而經電療或內熱針治療后,軟骨細胞凋亡現象得到緩解。

圖3 各組大鼠膝關節軟骨組織TUNEL染色
4 討論
KOA始發部位為關節軟骨,主要表現為關節疼痛、腫脹、功能障礙等[10]。針對KOA目前臨床尚未有特效或治愈的方法,其治療目的主要在于緩解臨床癥狀。骨關節炎國際研究學會的最新版治療指南強調藥物和非藥物聯合治療方法[11],因此尋求治療KOA有效的聯合手段、改善其臨床癥狀成為目前預防保健與臨床治療研究的主要目標。
中醫學認為,內熱針療法可溫經散寒、活血通絡、緩解局部腫脹、松解黏連組織,加強針刺的作用[12],使氣血調和、瘀去新生、經脈通暢、通則不痛而病愈[13]。研究者陳先武等[14]采用內熱針聯合膝關節腔灌洗術治療膝骨關節炎,結果治療組顯效率達80.76%,顯著高于正常組(膝關節腔灌洗術)的61.53%。對120例膝骨性關節炎患者采用內熱針聯合氨基葡萄糖膠囊的治療效果顯示,治療組總有效率顯著優于正常組,且能有效降低外周血炎癥因子的表達,提示內熱針能促進氨基葡萄糖在關節腔內的吸收,改善組織內缺血缺氧等現狀,進而改善關節疼痛,提升治療效果[15]。內熱針的顯著療效同樣在兔KOA模型中被證明[16]。而本研究通過內熱針治療KOA大鼠的病理變化,結果顯示內熱針對KOA模型大鼠的關節軟骨損傷具有一定的緩解及修復作用。
炎癥反應是KOA常見的并發癥,降低炎癥反應發生對軟骨組織的損傷修復具有積極意義[17]。本研究結果顯示,內熱針能顯著降低KOA模型大鼠膝骨關節滑膜液中炎癥因子IL-1β、TNF-α及IL-17的分泌,減少浸潤的炎性細胞數。龐青民等[18]采用針灸聯合獨活寄生湯加減治療KOA患者,結果顯示觀察組患者治療后血清中TNF-α、IL-6和IL-1的水平顯著低于正常組,提示此療法同樣可以明顯減輕KOA患者的炎癥反應。程紅等[19]采用電針治療兔KOA模型,顯示電針可能通過抑制脊髓IL-17、IL-17R的表達來調控骨關節炎性疼痛。此外,軟骨細胞凋亡導致的功能退變與KOA的發生發展密切相關。孫鵬等[20]采用獨活寄生湯含藥血清治療KOA模型大鼠,結果顯示模型組大鼠關節軟骨細胞凋亡數量顯著高于正常組,而陽性藥物組細胞凋亡數量較模型組顯著降低,提示該療法能抑制KOA軟骨細胞衰老、凋亡,促進軟骨細胞再生,從而達到治療的目的。吳晶金等[21]采用益氣養血方干預LPS誘導的軟骨細胞,結果顯示調控Bcl-2/Bax平衡、抑制IL-1β、TNF-α釋放可能是益氣養血方干預骨關節炎軟骨細胞凋亡的機制之一。而本研究同樣證明,內熱針治療大鼠KOA模型能通過降低炎癥反應及抑制軟骨細胞凋亡達到緩解膝關節軟骨組織損傷的目的。且內熱針治療能夠降低Bax的表達、促進Bcl-2的表達,進而調控Bcl-2/Bax的平衡穩態。
綜上所述,內熱針治療KOA的作用途徑可能是通過調控Bcl-2/Bax平衡、減緩軟骨細胞的凋亡并降低炎癥反應來實現的。

