青年胃癌的臨床特征及預后影響因素分析
馮時 周 波 曹先東
安徽醫科大學第一附屬醫院胃腸外科,安徽合肥 230000
胃癌是威脅人類健康的重要疾病之一,近年來每年全球新增病例超過100萬例,發病率在惡性腫瘤中排第五位[1]。我國是胃癌的高發地區,2020年我國胃癌新發病例約34.6萬例,其發病率和死亡率僅次于肺癌[2]。胃癌的發病年齡段主要在50~70歲,青年人胃癌患者是其中較為特殊的群體,其發病率低,占胃癌群體的2%~9%[3-6]。雖然近年來我國胃癌總體發病率趨于平穩,但我國青年胃癌的發病率和死亡率卻有上升趨勢[7]。目前青年胃癌沒有明確的定義,年齡分界值因不同的原因被定義在30~50歲,Takatsu 等[4]將年齡直方圖中第五個百分位數內的患者,即≤40歲的人群定義為青年群體,而Bleyer 等[8]根據美國國家癌癥研究所的要求將15~39歲人群定義為青年群體。本研究中以40歲為界限,這與多數關于青年胃癌的研究統一[3,4,6]。
既往研究中,因為青年胃癌患者的比例低于中老年患者,所以選擇年輕患者的小病例群體與中老年患者的大病例群體進行比較[3,9]。本研究中,采用傾向評分匹配法(PSM)進行配對,目的是選擇具有相似觀察協變量的研究組和對照組的樣本,減少數據偏差和混雜變量,以此來增加觀察性研究中的證據水平[5]。
1 資料與方法
1.1 研究對象
收集2013年1月~2017年12月安徽醫科大學第一附屬醫院收治的4154例胃癌病例,依照納排標準,共納入3024例患者。其中94例年齡≤40歲的患者作為研究組,使用傾向評分匹配法在納入患者中按1∶1 進行配對,選擇與研究組具有相同手術時間、手術方式、手術時長以及體重指數的中老年患者(年齡>40歲)作為對照組,以減少無關變量對于預后分析的干擾。本研究經醫院醫學倫理委員會審核批準,并征得所有患者的書面同意。
納入標準:①年齡≥18歲;②行R0或R1 胃癌根治術;③術后病理診斷為腺癌。排除標準:①已行新輔助化療的患者;②殘胃癌患者;③失訪患者。
1.2 數據采集
本研究中對于臨床分期為cT1N0M0的患者采取胃切除加D1 淋巴結清掃術;cT2N0M0 以及Ⅱ/Ⅲ期的患者采用胃切除加D2 淋巴結清掃術。術后病理分期為Ⅱ期及Ⅲ期的患者,進行以S-1 單藥或者氟尿嘧啶聯合奧沙利鉑的輔助化療方案。隨訪間隔為術后1~2年每3個月復查1次,3~5年每半年復查1次,此后每年隨訪1次,隨訪截止至2019年10月1日。患者的臨床特征包括人口統計學特征,初發癥狀,家族史,胃癌大體類型等。同時使用查爾森合并癥指數(CCI評分)對基礎疾病情況進行量化,比較兩組患者基礎疾病情況,其中評分>1分指患者合并有多種或較重的基礎疾病。腫瘤的組織分化類型采用WHO分類標準。腫瘤分期按照美國癌癥聯合委員會(AJCC)第8版進行分期[10]。腫瘤部位分為:①胃近端,包括胃食管交界處和胃的近端1/3;②胃中端,包括以胃體為主的胃中部1/3;③胃遠端,包括從角切跡處,胃竇到幽門;④全胃,病變累及范圍超過上述任一區域或原發病灶多發。
1.3 統計學方法
應用SPSS 22.0 統計學軟件進行數據分析,計量資料用均數±標準差()或者中位數表示;計數資料用率表示,組間比較采用χ2檢驗或Fisher 確切概率法。生存分析采用Kaplan-Meier 方法,并對生存率的比較進行Log-Rank 檢驗;與預后相關的危險因素采用非參數Cox 回歸分析。以P<0.05 為差異有統計學意義。
2 結果
2.1 臨床特征
本研究共納入94例青年胃癌患者,中位年齡35歲。5年內,安徽醫科大學第一附屬醫院青年胃癌患者新發數量逐年升高,且發病率有總體升高趨勢(圖1)。由圖2可見,發病人群主要集中在50~80歲年齡段,青年患者占比僅為3.37%。研究組女性發病多于男性,對照組各年齡段男性均多于女性。
兩組患者臨床資料如表1所示,研究組女性比例高于對照組,差異有統計學意義(P<0.05);研究組CCI評分低于對照組,即研究組基礎疾病少于對照組,差異有統計學意義(P<0.05)。
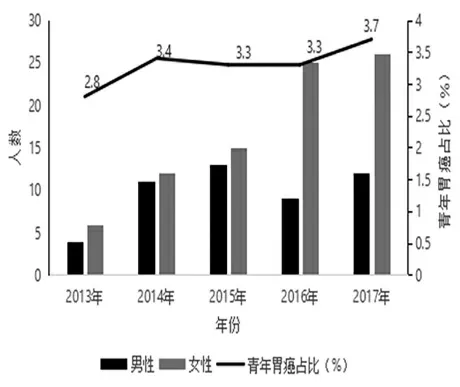
圖1 每年新發青年胃癌人數及其占胃癌總體人數的比例
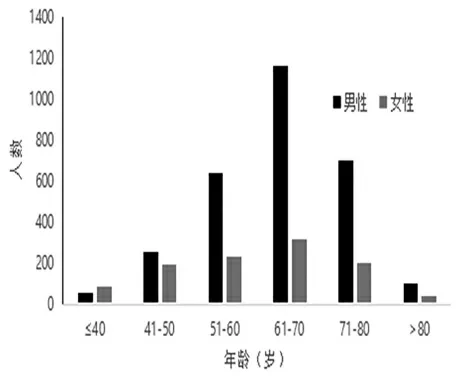
圖2 胃癌發病人數年齡直方圖
兩組患者的初發癥狀不同,差異有統計學意義(P<0.05);研究組中以上腹部疼痛不適為初發癥狀者多于對照組,進食哽咽者少于對照組,胃近端腫瘤的發病率低于對照組,差異有統計學意義(P<0.05);研究組的低分化型比例高于對照組,差異有統計學意義(P<0.05);兩組的腫瘤標志物陽性率比較,差異無統計學意義(P>0.05);兩組胃癌家族史、腫瘤最大徑、腫瘤浸潤深度T分期、N分期、TNM分期、大體分型以及術后完成化療人數的比較,差異無統計學意義(P>0.05)。
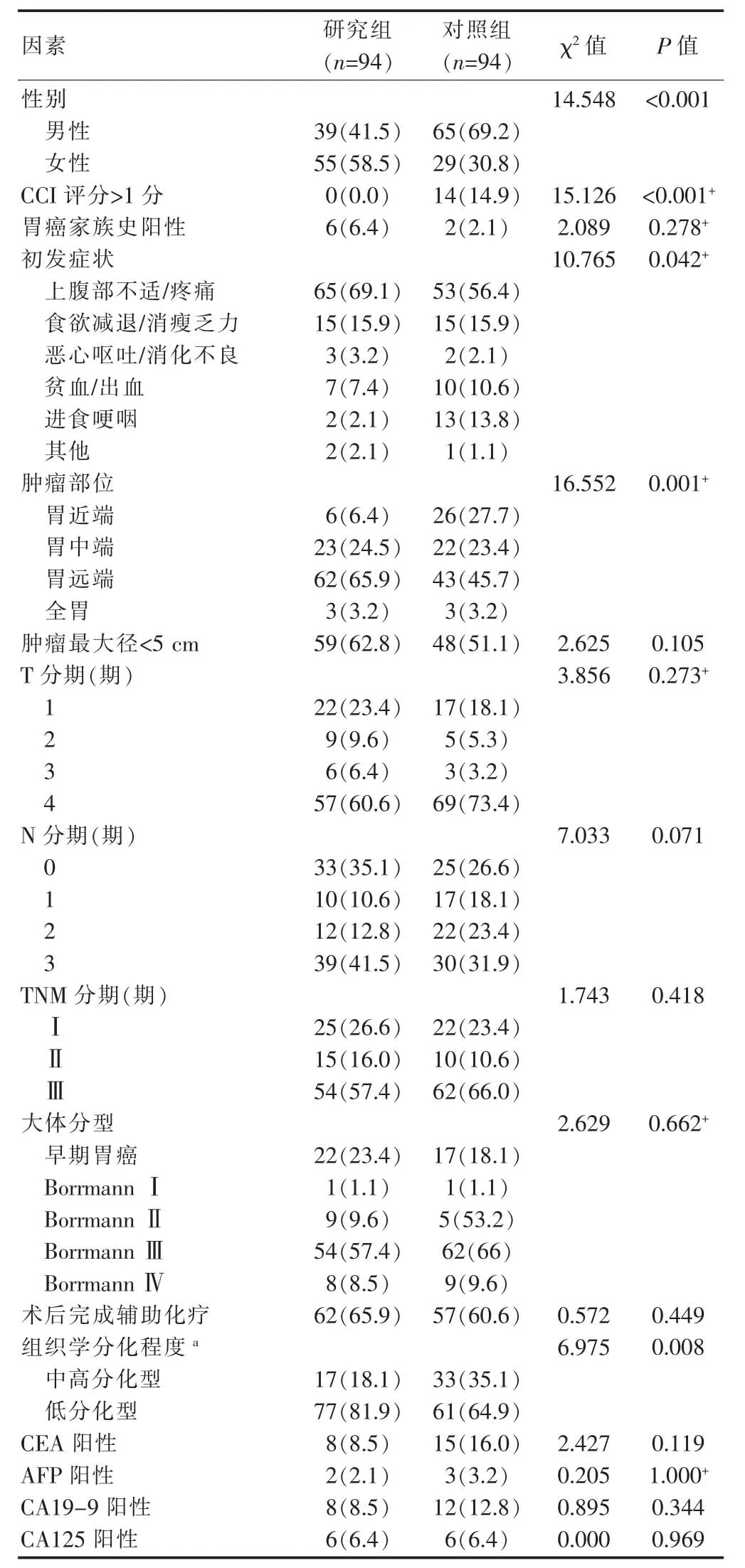
表1 兩組患者臨床資料的比較[n(%)]
2.2 生存預后分析
研究組和對照組的中位生存時間分別為26.5個月和27.5個月。兩組的1、3、5年生存率分別為69.1%、58.5%、41.3%和70.2%、59.5%、45.8%。兩組總體累計生存率比較,差異無統計學意義(P=0.675)(圖3,封三)。不同TNM分期的生存曲線如圖4、5、6(封三)所示,分別描述了兩組在Ⅰ~Ⅲ期的生存曲線,各期的累計生存率比較,差異無統計學意義(P=0.329、0.079、0.621)。通過單因素分析可見與預后有關的影響因素包括腫瘤部位、腫瘤大小、淋巴結轉移、TNM分期、大體分型、癌胚抗原(CEA)、甲胎蛋白(AFP)、糖類抗原125(CA125)和糖類抗原(CA19-9)(P<0.05);通過多因素分析,獨立的不良預后因素包括CA125陽性(HR:3.876,95%CI=1.518~9.896,P<0.05)以及進展期胃癌(HR:11.909,95%CI=2.844~49.861,P<0.05)(表2)。
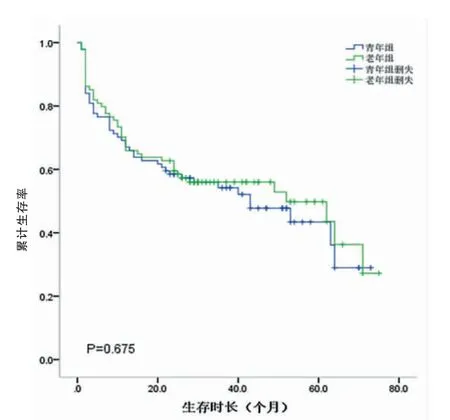
圖3 青年組和老年組胃癌患者總體累計生存率
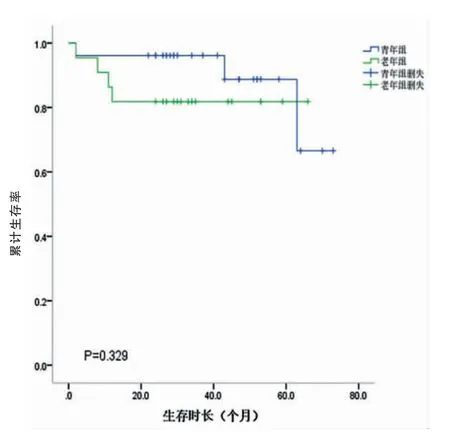
圖4 Ⅰ期累計生存率
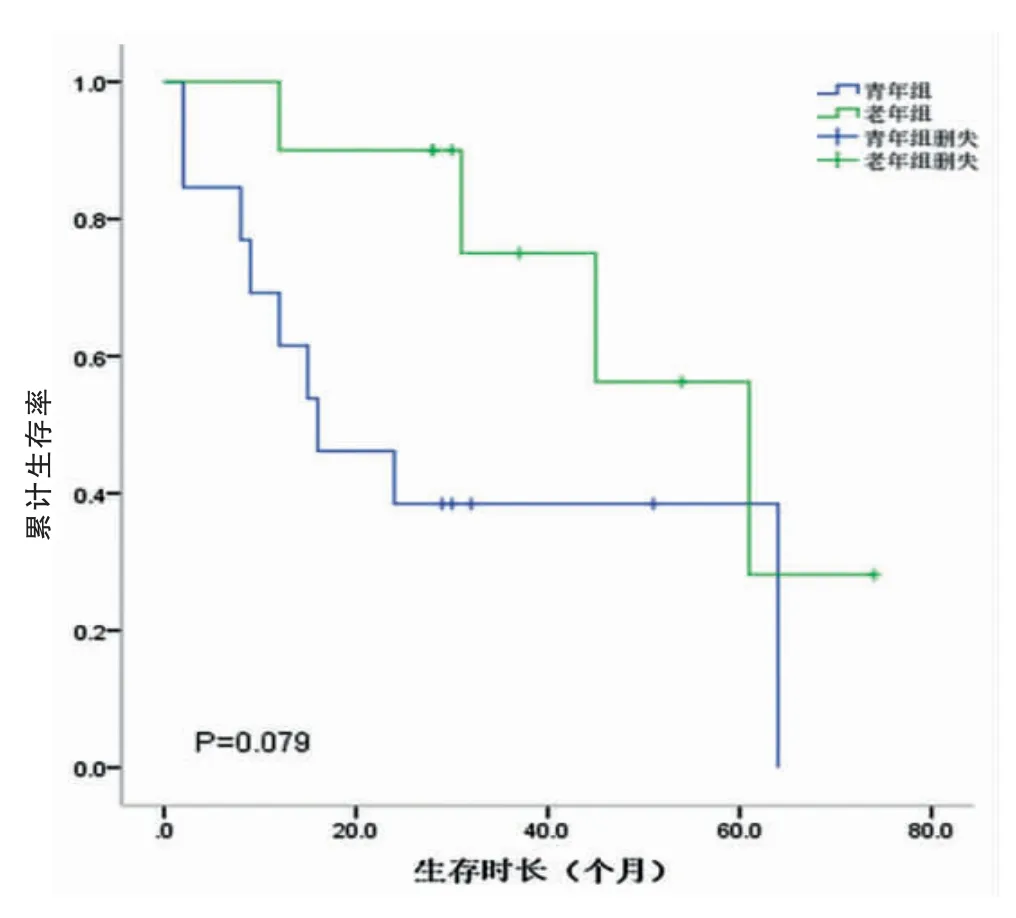
圖5 Ⅱ期累計生存率
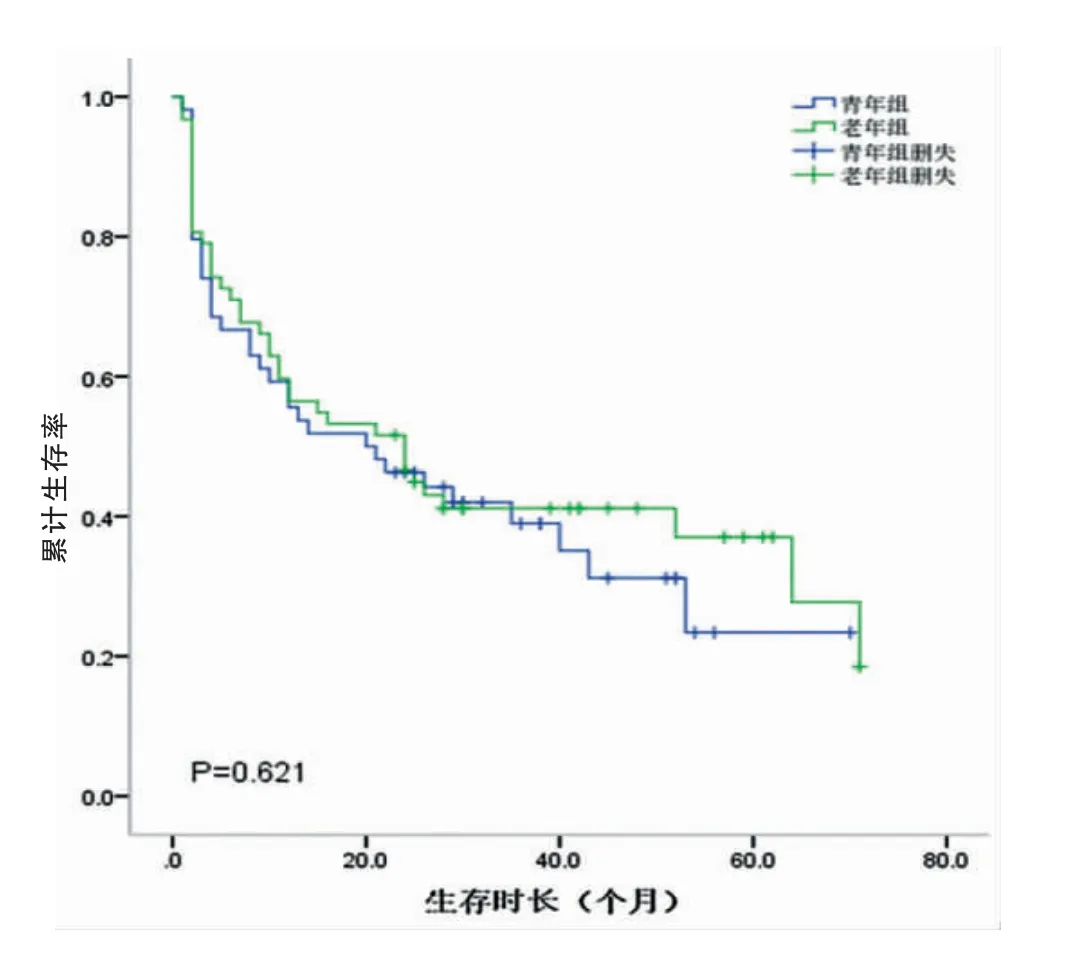
圖6 Ⅲ期累計生存率
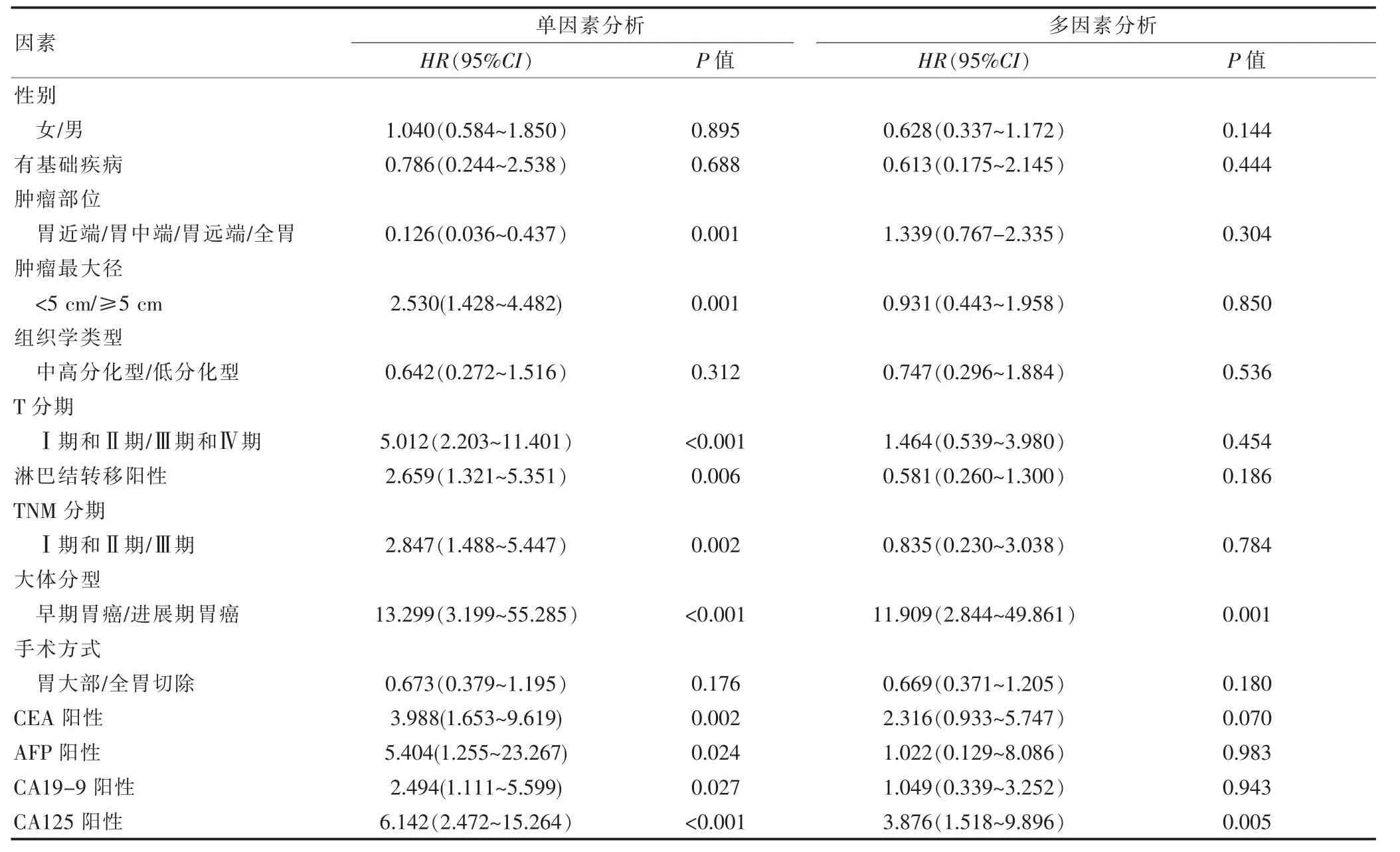
表2 青年胃癌患者預后影響因素分析
3 討論
近年,我國青年的胃癌發病率有升高趨勢,這與我國青年人飲食與生活習慣的改變密不可分[11]。且年輕人早期發現癌癥比其他年齡段的人更難,主要原因是年輕人本身及醫護人員普遍缺乏對該年齡段癌癥風險的認識,癌癥的征兆或癥狀往往被視為心身表現或其他疾病。
與Zhou 等[9]的研究結果相同,本研究中對照組女性患者比例低于研究組。導致這一現象的原因,一方面是胃癌危險因素如吸煙和飲酒的長期累積,會導致中老年患者中男性比例升高,女性比例降低;另一方面,雌激素對胃癌的發生起到一定防護作用[12],并且自然絕經年齡較大或絕經后激素替代治療的女性胃癌發病風險也比較低,因此青年女性受雌激素保護作用時間較短可能是其發病率高的原因[13]。此外,年輕女性胃癌患者雌激素受體的高表達與胃癌發病相關[14]。總之,雌激素及雌激素受體在青年胃癌發展過程中的作用與機制仍有待進一步研究。
本研究中青年患者的腫瘤主要位于胃遠端,而中老年人以胃近端為主,這一差異與國內先前的研究相同[9,15]。然而,來自日本的Isobe 等[16]研究顯示青年患者近端胃癌更多,巴西的一例研究則報告了年齡和腫瘤部位之間沒有關聯[17]。這可能是因為不同國家人群遺傳及飲食的差異所導致的。胃食管反流的發病率會隨著年齡的增長而增長[18],而其導致的賁門腸上皮化生是賁門癌的癌前病變,這可能是中老年人賁門癌發病率較青年人高的原因。
本研究中研究組與對照組的總體生存率比較,差異無統計學意義(P>0.05),在根據TNM分期進行分組后,這兩個年齡組之間比較,差異無統計學意義(P>0.05),由此可見存活率與年齡無關。盡管青年患者腫瘤侵襲性較強,分期較晚,但其基礎疾病較少,對根治性手術及化療耐受性較高,這使得兩組患者在不同分期中的生存期相近。這與Liu 等[5]的研究結果是一致的。但也有研究報告了青年患者的生存率較低[16]或者較高[3],這種不一致有多種原因。青年胃癌的定義是多種多樣的,在最近的研究中,青年與中老年患者的年齡界限從40歲到50歲不等,這也與不同地區胃癌發病率和死亡率不同有關[3-6]。研究發現,在我國年輕患者與中老年患者相比,存活率無差異或者更高,而在日本更多研究發現年輕患者預后較差[16,19]。此外不同的治療方案以及部分研究中青年患者較少的樣本量也會導致這種偏差。
血清腫瘤標記物對檢測癌癥的復發和遠處轉移、預測患者生存起著重要作用。通過多變量生存分析,CA125陽性是青年患者預后的獨立危險因素,這與Zhou 等[9]的研究結果相同。CA125陽性患者預后較差是因為高水平的CA125 不僅與胃癌腹膜擴散的發生顯著相關,而且是淋巴結轉移及遠處轉移的危險因素[20]。此外,CEA、AFP 和CA19-9 均是胃癌的獨立預后危險因素[21]。然而在本研究中,CEA、AFP 和CA19-9對青年胃癌患者沒有預后價值,可能是因為樣本量相對較少。
綜上所述,相對于老年人胃癌而言,青年人胃癌不僅在性別分布及腫瘤部位、內鏡下大體分型等方面不同,而且具有組織學分化程度低、臨床分期差等特點。臨床工作中應增強對青年胃癌的警惕性,提高其早期診斷率,同時根據患者的臨床特征建立個體的預后評估,使用適合個體的治療方法以改善預后。

