小桐子低溫誘導型啟動子JcDnaJ20p 的克隆及煙草轉化功能鑒定
王海波 郭俊云
(曲靖師范學院 生物資源與食品工程學院,曲靖 655011)
轉錄水平的調控在植物基因表達中發揮重要作用[1-2]。啟動子是功能基因上游負責RNA 聚合酶識別并開始轉錄的順式作用元件(Cis-acting element),其包含RNA 聚合酶特異結合所需的保守序列,以及控制轉錄精確起始的TATA-box 核心元件與控制轉錄頻率的CAAT-box 和GC-box 元件[1],也可通過與特定反式作用因子(Trans-acting element)如轉錄因子的結合,從而調節功能基因轉錄的速度與頻率[1-3]。根據基因的表達方式,啟動子分為組成型啟動子(如花椰菜花葉病毒CaMV35S 啟動子[4]、水稻肌動蛋白ActinI 啟動子[5]、玉米泛素Ubiquitin啟動子[6])、組織特異性啟動子(如擬南芥韌皮部AtPP2基因啟動子[7]、火炬松微管組織PAL基因啟動子[8])、誘導型啟動子(如干旱誘導Lea啟動子[9]、rd29A啟動子[10]、低溫誘導cor15a啟動子[11]、高鹽誘導Rab16A啟動子[12]、病原誘導SRA啟動子[2,13]等)。目前,在植物遺傳轉化研究中,大部 分 使 用CaMV35S(Cauliflower mosaic virus 35S promoter)作為目的基因表達的啟動子,作為典型的植物組成型強啟動子,CaMV35S 驅動外源基因在植物中表達沒有組織特異性與發育階段特異性,但會造成轉基因植物由于過表達浪費大量物質與能量,增加代謝負擔,甚至改變植物的代謝途徑與外部形態,從而影響植物正常生長發育[14],而誘導型啟動子具有逆境誘導表達特性且不影響植物正常生長的優點,成為培育植物抗逆新品種的最好選擇。
目前,已經從多種植物中分離出低溫誘導表達啟動子。擬南芥cor15a基因屬典型低溫誘導表達基因,其過量表達可以顯著提高擬南芥的低溫抵抗能力,同時該基因的啟動子也具有低溫誘導表達特性,能夠在低溫條件下,特異驅動GUS基因的表達[11]。另外,擬南芥rd29A基因啟動子在植物抗冷基因工程中也有廣泛的應用,且由rd29A啟動子驅動的轉基因植株比由CaMV35S 啟動子驅動的轉基因植株生長影響更小[10]。
能源植物小桐子作為主要的生物柴油植物之一,其種子含油量高,且流動性與石化油摻和性好,成為未來最有可能替代化石能源的潛力樹種,我國在“十五”、“十一五”、“十二五”能源發展綱要中都把發展小桐子產業列為可再生能源中長期發展規劃的重點[15]。小桐子(Jatropha curcasL.)屬大戟科(Euphorbiaceae)麻瘋樹屬(Jatropha)多年生落葉半肉質小喬木或大灌木[16],目前在我國滇、黔、川、桂、閩、粵及瓊等省份有較多野生資源分布[17]。小桐子原產中南美洲的熱帶及亞熱帶地區,低溫冷害是限制小桐子種植面積進一步擴大與產業發展的主要環境因素。前期通過小桐子低溫轉錄組[18]與數字基因表達譜[19]測序表明,小桐子低溫條件下高誘導表達基因主要包括電子傳遞與氧化還原平衡類基因、水解酶基因、滲透調節物運輸家族基因以及轉錄因子家族基因,暗示小桐子在響應低溫過程中能量平衡、光合效率、滲透調節等功能起重要作用。DnaJ20 蛋白屬于Hsp40 家族分子伴侶,在逆境脅迫下能保護胞內蛋白質等的結構與功能穩定性。DnaJ20基因在12℃低溫處理12、24、48 h 下上調表達都達到極顯著水平,與小桐子的抗冷性直接相關,而其啟動子是否也具有低溫誘導表達特性還未見報道。本研究克隆了DnaJ20基因上游2 023 bp 的啟動子序列,并通過GUS基因融合構建了pCambia1381Z-JcDnaJ20p-GUS 植物表達載體,進而在煙草中瞬時表達鑒定了該啟動子的低溫誘導特性,旨在為小桐子抗冷性基因工程的研究提供理論與應用依據。
1 材料與方法
1.1 材料
實驗所用小桐子材料采自云南省元謀縣干熱河谷地區。遺傳轉化受體煙草品種為云煙87。大腸桿菌(Escherichia coli)菌株DH5α、根癌農桿菌(Agrobacterium tumdfaciens)菌株EHA105、植物表達載體pCambia1381Z 由本實驗室保存。pMD18-T 載體、T4 DNA 連接酶、基因組提取試劑盒、凝膠回收試劑盒及質粒提取試劑盒均購自寶生物工程有限公司(TaKaRa)。TaqDNA 聚合酶購自TOYOBO 公司,限制性內切酶購自Fermentas 公司。其他試劑為國產分析純。引物合成與測序由深圳華大基因有限公司完成。
1.2 方法
1.2.1 小桐子JcDnaJ20p 啟動子的克隆及序列分析 根據本實驗室前期小桐子數字基因表達譜(低溫12℃處理12、24、48 h)數據[19],分子伴侶DnaJ20基因屬于低溫高響應基因。通過DnaJ20基 因 的mRNA 序 列(GenBank 登 錄號:XM_012230104.2)對小桐子基因組數據庫(JatCur_1.0)進行Blast 相似性檢索,獲得該基因起始密碼子ATG 上游2 500 bp 的啟動子序列。利用Primer5.0 軟件設計擴增引物(JcDnaJ20p_C),上游F:5'-ACGCGTCGACCGTTTGAAAGTTTGGAAGG-3',下劃線表示SalI 酶切位點;下游R:5'-CCCAAGCTTG AGATCATTCCTGCAGTAG-3',下劃線表示Hind III 酶切位點,菌落PCR 驗證引物(JcDnaJ20p_T),上游F:5'-ACGCGTCGACCGTTTGAAAGTTTGGAAGG-3';下游R:5'-CAAAGGGAAATAATTTCATTG-3'(擴增長度284 bp)。
采用植物基因組DNA 提取試劑盒提取小桐子葉片基因組DNA。以基因組DNA 為模板,使用高保 真DNA 聚 合 酶KOD FX Neo DNA Polymerase 及JcDnaJ20p_C 引物進行PCR 擴增,擴增條件為:98℃預變性5 min;98℃變性10 s,60℃退火30 s,68℃延伸2 min,30 個循環,68℃后延伸5 min。將擴增片段切膠回收后與克隆載體pMD18-T 連接,命名為pMD18-T-JcDnaJ20p,轉化大腸桿菌DH5α 感受態細胞,涂LB 抗性平板(包含50 mg/L Amp),過夜生長。利用引物JcDnaJ20p_T 進行菌落PCR 驗證的陽性克隆,送檢測序并提取重組質粒。測序序列 通 過PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)對啟動子順式作用元件進行鑒定。
1.2.2 植物表達載體的構建 將pMD18-TJcDnaJ20p 質粒與植物表達載體pCambia1381Z 經SalI、Hind III 雙酶切,切膠回收后利用T4 DNA 連接酶16℃過夜連接,將小桐子啟動子JcDnaJ20p序列克隆至pCambia1381Z 的多克隆位點,獲得JcDnaJ20p 啟動子與GUS基因融合的植物表達載體pCambia1381Z-JcDnaJ20p-GUS,將該質粒轉化大腸桿菌DH5α 感受態細胞,涂布LB 抗性平板(含50 mg/L 的Kan),37℃過夜生長,提取重組質粒,通過SalI 與Hind III 雙酶切進行鑒定。同時構建CaMV35 啟動子與GUS基因融合的植物表達載體pCambia1381Z-35S-GUS,將pCambia1381ZJcDnaJ20p-GUS、pCambia1381Z-35S-GUS 融合載體與pCambia1381Z-GUS 空質粒通過凍融法轉化根癌農桿菌EHA105 菌株。
1.2.3 煙草轉化及GUS 組織化學染色 將以上轉化了不同載體的農桿菌菌株挑取單克隆于1 mL LB液體培養基中(含50 mg/L Rif 與50 mg/L Kan),28℃震蕩培養24 h。將過夜培養的農桿菌轉至25 mL LB 液體培養基中(含50 mg/L Rif 與50 mg/L Kan),加入100 μL 0.5 mol/L 2-(N-嗎啉)-乙磺酸(2-N-morpholino ethane sulfonic acid,MES),28℃震蕩培養至OD 值約為1.0,4 000 r/min 離心15 min,棄上清,用10 mmol/L MgCl2重懸菌體至OD 值約為1.0,靜置3 h。取正處于生長期的煙草葉片,用針頭在葉片反面扎數個創傷孔,將轉化pCambia1381ZJcDnaJ20p-GUS 質粒的農桿菌菌液通過注射器注入葉片下表皮進行浸染,同時以轉化pCambia1381Z-35S-GUS 與pCambia1381Z-GUS 空質粒的農桿菌為對照浸染煙草葉片。將以上浸染的煙草葉片分別置于15、4℃的培養箱中進行低溫處理24 h,室溫25℃為對照,之后進行GUS 組織化學染色。將煙草葉片置于GUS 染液(購自Coolaber 公司)室溫下染色1 h,用70%乙醇進行脫色,每次1 h,重復4 次,拍照觀察。
2 結果
2.1 小桐子JcDnaJ20p啟動子的克隆及植物表達載體的構建
根據GenBank 中發表的小桐子基因組數據設計引物,擴增得到JcDnaJ20基因起始密碼子上游2 023 bp 的啟動子DNA 片段,命名為JcDnaJ20p(圖1-A)。pCambia1381Z 是包含標記基因GUS的啟動子功能分析專業植物表達載體,雙酶切-T4 DNA 連接酶法構建了JcDnaJ20p 啟動子與GUS基因融合的植物表達載體pCambia1381Z-JcDnaJ20p-GUS(圖2),通過農桿菌菌落PCR(擴增長度284 bp)(圖1-B)與SalI、Hind III 雙酶切驗證(圖1-C)顯示,pCambia1381Z-JcDnaJ20p-GUS 已成功轉化農桿菌EHA105 菌株,同時提取陽性菌落的重組質粒(圖1-D)并送樣進行測序。測序結果表明,克隆的JcDnaJ20p 啟動子序列與小桐子基因組中的序列相似性為99.8%(圖3-D)。
2.2 小桐子JcDnaJ20p啟動子的序列分析
根據Wu 等[20]構建的小桐子基因組高密度遺傳連鎖圖譜,通過Scaffold 數據在染色體水平定位JcDnaJ20基因,并使用MapChart 軟件進行可視化繪圖顯示,小桐子JcDnaJ20基因定位7 號染色體(總長度131.4 cM)的9.7 cM(圖3-A)。進一步通過基因組數據分析顯示,小桐子JcDnaJ20基因(GenBank登錄號:105644672)長度為894 bp,包含1 個外顯子(618 bp),在基因兩端還鑒定到長度分別為82 bp、194 bp 的5'-UTR、3'-UTR 區域(圖3-B)。

圖1 小桐子JcDnaJ20p 啟動子的克隆
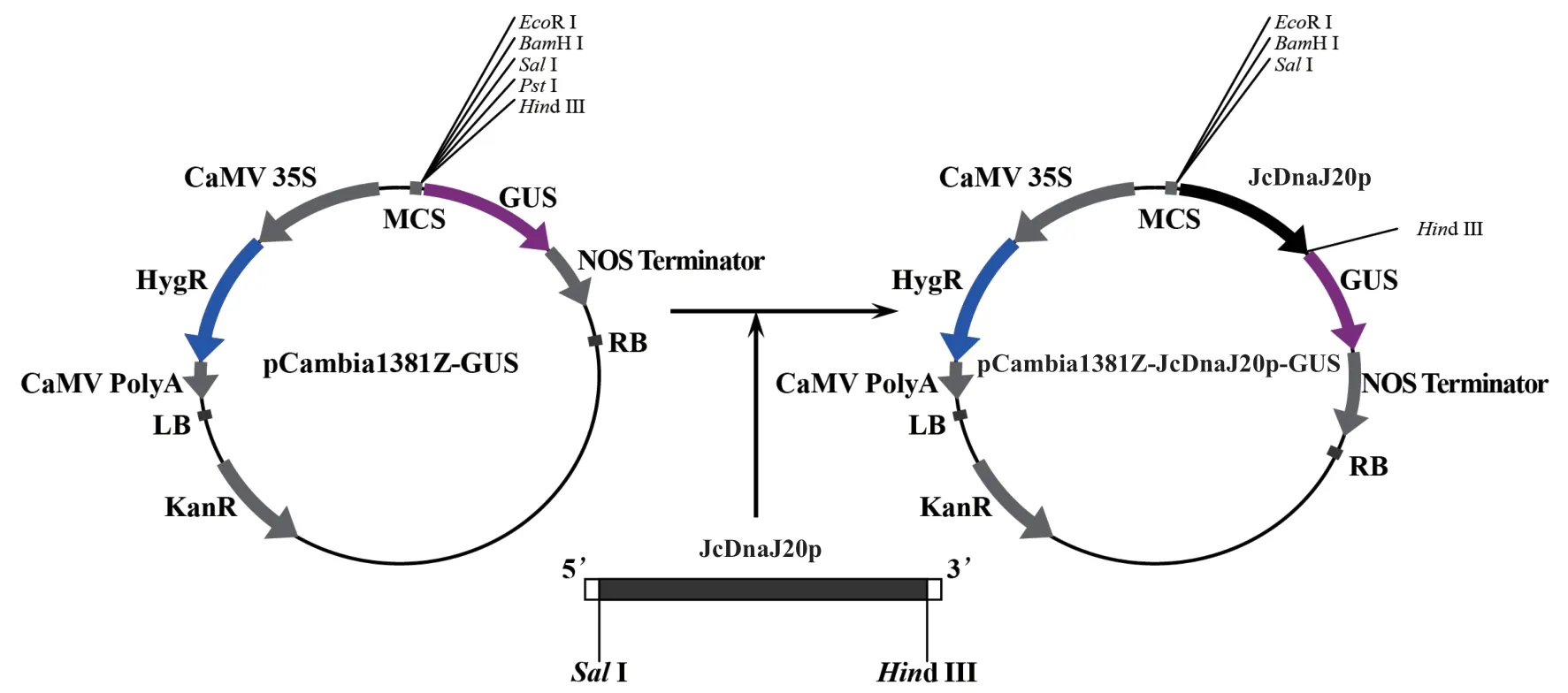
圖2 小桐子JcDnaJ20p 啟動子與GUS 基因融合植物表達載體的構建
利用PlantCARE 工具分析克隆的JcDnaJ20p 啟動子序列存在的順式作用元件。結果表明,該啟動子具有真核生物典型的核心啟動子序列,包含31 個CAAT-box 和87 個TATA-box。另外,還鑒定到激素類的響應元件,如脫落酸響應元件(ABRE,核心序列ACGTG)、赤霉素響應元件(P-box,核心序列CAAAAGG),以及非生物脅迫類響應元件,如低溫/脫水響應元件(DRE,核心序列ACCGAGA)(圖3-C)。還包括MYB、MYC 轉錄因子識別(CAACGG)與 結 合(CAACAG) 序列,MYBHv1 結合元件(CCAAT-box,核心序列CAACGG),從而具備與多種信號轉導系統互作的通路,同時,具有多個光信號響應元件(ATC-motif,核心序列AGTAATCT;GT1-box,核心序列GGTTAA;Gap-box,核心序列CAAATGAA;TCCC-motif, 核心序列TCTCCCT;TCT-motif,核心序列TCTTAC)(圖3-D)。另外,通過GenBank 數據庫下載JcDnaJ20基因上游5000 bp 啟動子序列,與克隆的2 023 bp 序列相似性為99.8%,且在克隆序列的上游鑒定到更多的與防御、脅迫相關的響應元件(TC-rich repeats,核心序列GTTTTCTTAC)。

圖3 小桐子JcDnaJ20p 啟動子順式作用元件的分析
2.3 煙草葉片GUS活性的組織化學染色
以轉化空質粒pCambia1381Z-GUS、35S啟動子融合GUS的載體pCambia1381Z-35S-GUS 為對照,將pCambia1381Z-JcDnaJ20p-GUS 重組載體采用農桿菌滲透法轉化煙草葉片,之后以常溫25℃為對照,分別置于15、4℃經過低溫處理24 h 后進行GUS 染色。結果顯示,轉化pCambia1381Z-GUS 的煙草葉片,由于缺乏啟動子,GUS報告基因在3 個溫度下都沒有表達,而轉化pCambia1381Z-35S-GUS 的煙草葉片在3 個溫度下都檢測到GUS表達活性,但染色深度基本一致,與35S 啟動子為組成型啟動子的特性一致。另外,轉化pCambia1381Z-JcDnaJ20p-GUS 的煙草葉片在3 個溫度下也都表現出GUS表達活性,且隨著溫度的降低,表達量逐漸升高,GUS 染色的顏色也逐漸加深(圖4),表明小桐子JcDnaJ20p 啟動子具有啟動子活性,且屬于低溫誘導型啟動子。

圖4 轉基因煙草葉片的GUS 組織化學染色
3 討論
功能基因啟動子區域的不同順式作用元件決定了該基因的誘導表達模式。通過分析發現,小桐子JcDnaJ20基因啟動子區除了具有真核生物典型核心啟動子元件CAAT-box 和TATA-box 外,也鑒定到低溫、干旱響應DRE 元件(Dehydration Responsive element),文獻報道,DRE 順式作用元件普遍存在于干旱、高鹽、低溫脅迫應答基因的啟動子中[10-11],說明其可能參與小桐子抗冷性與抗旱性的脅迫響應過程。同時,還鑒定到參與多種脅迫調節的MYB元件、MYC 元件。如擬南芥抗逆rd(Responsive to drought)系列基因都包含MYB 元件[21],另外,擬南芥低溫誘導CBF系列基因都包含MYC 元件[22],暗示JcDnaJ20基因及其啟動子在小桐子抗冷性及其他抗逆性響應中發揮重要作用,成為未來小桐子轉基因研究的主要候選功能基因。
植物逆境誘導型啟動子,對下游調控基因只在逆境脅迫條件下才誘導其表達,避免過量表達浪費植物的物質與能源而導致生長發育障礙[1-3,14]。目前,國內外對植物低溫信號轉導機制以及低溫誘導啟動子已有一些報道。cor15a作為典型的低溫誘導基因,其過量表達能顯著提高擬南芥的低溫抵抗能力,同時cor15a基因啟動子也具有低溫誘導表達特性[11]。將該啟動子與GUS標記基因構建融合表達載體并轉化馬鈴薯表明,經過低溫處理的轉基因馬鈴薯葉片都檢測到GUS 產物,而未經低溫處理的對照組則未檢測到GUS 活性[23]。低溫冷害誘發的次級水分脅迫也被認為是冷害的主要原因之一,在擬南芥rd29A啟動子區域鑒定到干旱、低溫及高鹽脅迫響應的順式作用元件[10]。Kasuga 等[24]將組成型啟動子CaMV35S 與低溫誘導啟動子rd29A驅動的CBF基因在轉基因煙草中進行表達,發現兩個轉基因株系都表現出較野生型對照組更強的抗冷性,且由rd29A驅動的CBF轉基因植株比CaMV35S 驅動的轉基因植株表現出更弱的生長抑制。另外,擬南芥ADH 啟動子[25]、LT178 啟動子[26]、CBF2 啟動子[27],小麥mwcs120 啟動子[28],水稻Tdcor39 啟動子[29]及大麥blt4.9 啟動子[30]也都表現出低溫誘導特性,DnaJ20基因是小桐子低溫誘導上調表達較顯著的基因,屬于分子伴侶DnaJ基因家族,煙草瞬轉及低溫誘導表達證明,該基因啟動子能夠提高GUS基因的表達量,具有低溫誘導啟動子活性。本研究對深入理解低溫脅迫下DnaJ基因家族的作用機制奠定了基礎,同時為后續小桐子抗冷育種的研究積累了潛在基因資源。
4 結論
轉錄組測序表明,DnaJ20基因是小桐子低溫誘導高表達基因。本研究克隆到小桐子DnaJ20基因上游2 023 bp 的啟動子序列,PlantCARE 分析表明,該啟動子中包含低溫脅迫等響應元件。同時,成功構建了該啟動子驅動的GUS標記基因的植物表達載體,通過煙草瞬時轉化表達顯示,該啟動子能夠顯著提高GUS基因的表達量,具有低溫誘導啟動子活性。