血站核酸檢測實驗室HBV DNA項目室內質量控制方法探討
文良雪, 張瀾藝, 蘇 麗, 王明芬, 劉永生
(遵義市中心血站,貴州 遵義 563000)
進行室內質量控制(internal quality control,IQC)是實驗室有效運行的需要,也是《血站實驗室質量管理規范》[1]等我國醫療衛生行業相關規定的強制要求。在實時進行實驗監控的同時,還應定期對結果進行匯總和回顧性分析,以確保IQC的有效運行。目前,我國血站血液篩查核酸檢測實驗室均各自采用不同的IQC方案,未見統一標準。為建立適合本實驗室的HBV DNA檢測IQC方法,本研究在日常使用陽性質控品判定實驗是否在控的基礎上,結合陽性質控品循環域值(cycle threshold,Ct)、陽性對照Ct值、內標Ct均值、內標Ct值標準差的Levey-Jenning質控圖、總體監控指標進行回顧性分析。
1 材料和方法
1.1 標本來源
收集遵義市2018年4月1日— 6月29日無償獻血者酶聯免疫吸附試驗非反應性血液標本14 172份。
1.2 儀器與試劑
乙型肝炎病毒(hepatitis B virus,HBV)DNA陽性質控品(1.0 mL/支,濃度200 IU/mL,批號20171106,北京康徹思坦公司),HBV、丙型肝炎病毒、人類免疫缺陷病毒(I型)核酸檢測試劑盒[聚合酶鏈反應(polymerase chain reaciton,PCR)熒光法,含陰、陽性對照,批號20171213,上海科華公司],Microlab STAR全自動樣本處理儀(瑞士HAMILTON公司),ABI 7500實時熒光PCR擴增儀(美國ABI公司)。
1.3 方法
采用8份標本混檢模式,按照試劑盒說明書的操作步驟進行每日核酸檢測。每批實驗均含1個陽性質控品、1個陽性對照和1個陰性對照。當HBV DNA陽性質控品、試劑盒陽性對照為反應性,試劑盒陰性對照為陰性,且內標陽性時,判定該批實驗在控。
1.4 繪制Levey-Jenning質控圖
在ABI 7500實時熒光PCR擴增系統中查得每批實驗的陽性質控品Ct值、陽性對照Ct值、內標Ct均值、內標Ct值標準差。以前20次檢測的數據為基準,用SPSS 18.0軟件繪制箱型圖進行離群值檢驗(剔除超過3s的數據),分別計算數據的均值、標準差和變異系數,用Excel 2007軟件繪制Levey-Jenning質控圖。
1.5 回顧性分析
將前20次檢測以后每批次的實驗結果進行正態分布檢驗,用Excel 2007軟件把數據自動繪入Levey-Jenning質控圖,使用Westgard多規則質控方法進行判斷。
1.6 總體監控指標分析
統計3個月的檢測標本總數及混樣反應性、拆分反應性次數,并計算總體監控指標:混檢陽性率(混樣反應性次數/標本總數×100)、拆分陽性率(拆分反應性次數/標本總數×100)、拆出率(拆分反應性次數/混樣反應性次數×100)。
1.7 統計學方法
采用SPSS 18.0軟件進行統計學分析。
2 結果
2.1 實驗在控判定結果
3個月的檢測數據中,每個批次實驗HBV DNA陽性質控品、試劑盒陽性對照及陰性對照均符合判定規則,所有批次實驗均在控。
2.2 Levey-Jenning質控圖繪制
統計ABI 7500實時熒光PCR系統中的實驗數據,計算其均值、標準差和變異系數。繪制箱型圖進行離群值檢驗,均值未出現離群值。繪制Levey-Jenning質控圖。見表1、圖1~圖4。
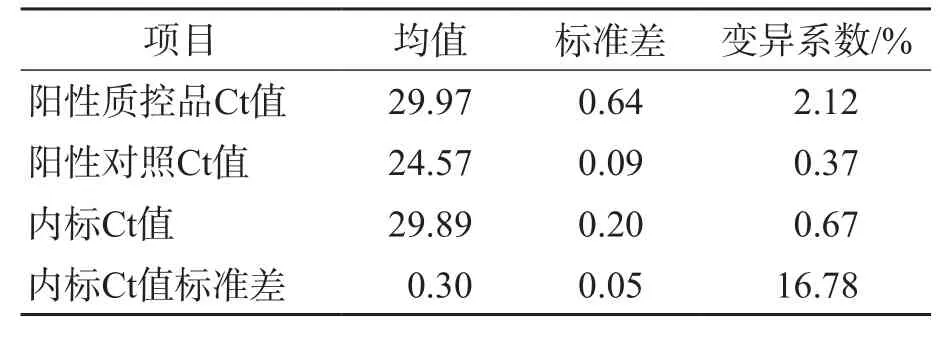
表1 前20次實驗均值、標準差、變異系數統計表

圖1 陽性質控品Ct值Levey-Jenning質控圖
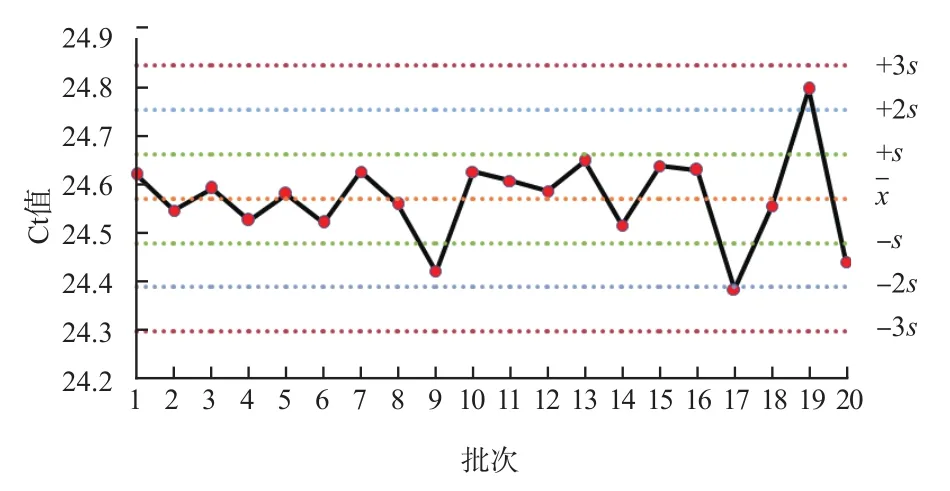
圖2 陽性對照Ct值Levey-Jenning質控圖
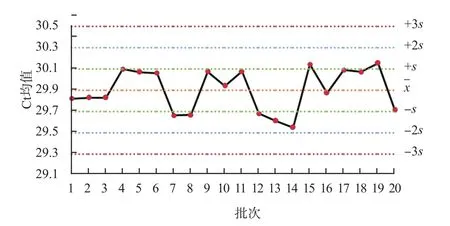
圖3 內標Ct均值Levey-Jenning質控圖
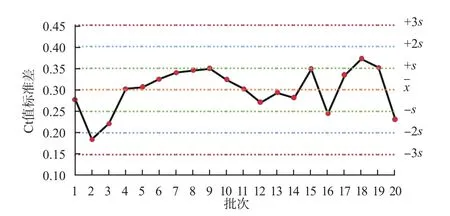
圖4 內標Ct值標準差Levey-Jenning質控圖
2.3 回顧性分析結果
所有結果均服從正態分布,計算所有實驗累積均值、標準差、變異系數。見表2。

表2 累積均值、標準差、變異系數統計表
把前20次實驗后每批次的實驗數據自動繪入Levey-Jenning質控圖,得到3個月的Levey-Jenning質控圖,使用Westgard多規則質控方法進行判斷,陽性質控品在第1、21、31天發生12s警告,第32天發生13s失控,第34天違背41s規則,第28~38天違背規則,見圖5。陽性對照在第17、19、35、40、42、44、46、48、50、60天發生12s警告,見圖6。內標Ct均值在第26、54天發生12s警告,第30、58天發生13s失控,見圖7。內標Ct值標準差在第2、26、30、57天發生12s警告,第27天發生22s失控,第58天發生R4s失控,見圖8。
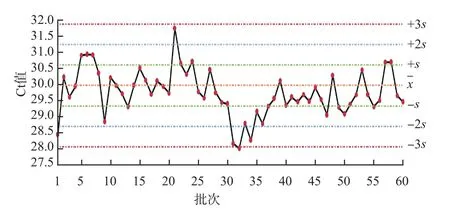
圖5 陽性質控品Levey-Jenning質控圖

圖6 陽性對照Levey-Jenning質控圖
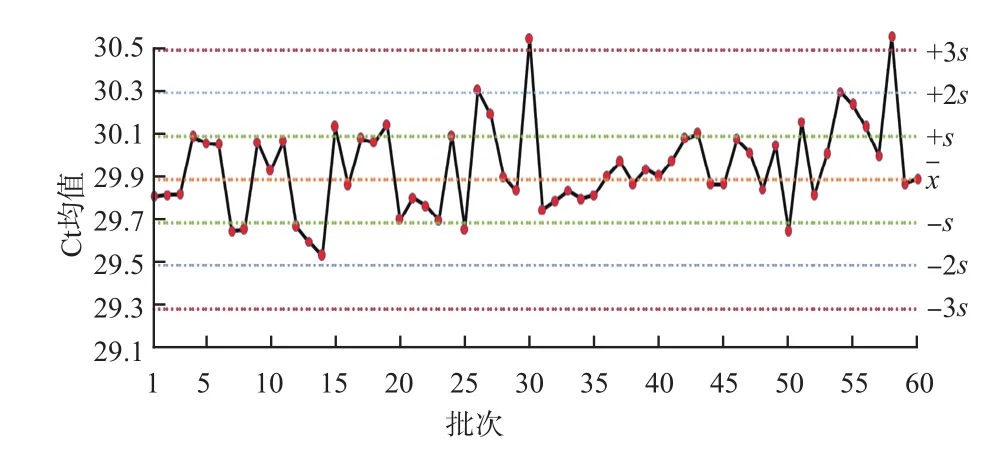
圖7 內標Ct均值Levey-Jenning質控圖

圖8 內標Ct值標準差Levey-Jenning質控圖
2.4 總體監控指標分析結果
3個月共檢測標本14 172份,其中HBV DNA混樣反應性13次,拆分反應性8次,混檢陽性率、拆分陽性率和拆出率分別為0.092%、0.056%、61.540%。
3 討論
《血站技術操作規程(2019版)》[2]要求每批核酸檢測應至少有1個外部質控品,外部質控品由第三方提供,建議濃度為檢測系統最低檢測限的2~5倍。科華系統8混檢模式HBV DNA檢測最低檢測限為50 IU/mL。本實驗室選擇的質控品濃度為200 IU/mL,陽性對照為試劑盒陽性對照,設立質控品和陽性對照的意義在于排除假陰性和進行實驗監控,兩者不可相互替代;陰性對照可以排除假陽性。內標與靶標DNA在同一反應體系中同時進行核酸提取和擴增檢測,可以驗證實驗過程的可靠性,監測其中是否存在PCR反應的抑制物、降解核酸的酶或影響擴增反應的雜質等。質控品、陽性對照結果為反應性,陰性對照為陰性,且內標有效擴增,則認為該批實驗在控。在實時監控進行IQC的同時,觀察質控品、陽性對照、內標Ct值波動情況,進行回顧性分析,監控實驗性能,發現批間變異,可反映實驗的有效性和穩定性。
本研究質控品和陽性對照Ct值變異系數分別為2.41%、0.49%,表示批間穩定性較高,測定結果較一致。將質控品和陽性對照Ct值聯合內標Ct值進行分析,結果可顯示反應體系對靶標核酸檢測值高低的影響。內標Ct均值反映了批內實驗穩定性集中趨勢,該值在29.89附近波動,且變異系數為0.70%,離散趨勢小。內標Ct標準差的變異系數為17.96%,說明批間存在一定的變異,應嚴格監控核酸檢測的實驗過程,采取適時進行儀器維護與保養、按說明書要求貯存和使用試劑、控制實驗室溫濕度、使用不間斷電源等措施,控制實驗條件,保證實驗精密度和準確度。
實驗數據正態分布驗證結果顯示其服從正態分布,可采用Levey-Jenning質控圖及相應的質控規則進行IQC。Levey-Jenning質控圖可以直觀地顯示數據的分布,易于發現保存和使用過程中試劑性能的衰減情況(質控品和陽性對照檢測值是否呈現連續走低趨勢等)及試劑批號更改對實驗的影響等。本研究使用同一批號的檢測試劑盒,該試劑盒性能良好,并未出現衰減趨勢。
Westgard多規則質控方法12s作為警告規則,對誤差檢出具有靈敏度高的特點,但識別特異性相對較低。因此觸發12s警告規則后,應及時啟用13s→22s→R4s→41s→規則進行檢驗,13s和R4s規則可判定是否為隨機誤差,22s、41s、規則判定是否為系統誤差[2]。實驗中發生的12s警告,按Westgard“13s→22s→R4s→41s→”規則依次檢驗,未發生失控。質控品Ct值在第32天測定值超出x-3s控制線,違背13s規則,分析其原因,可能為質控品復融沒有在室溫條件下放置足夠長的時間導致了濃度不均、上樣前震蕩混勻不充分等,但該批實驗陰、陽性對照和質控品均有效,該批檢測結果是可接受的;第28~38天違反41s和規則,均在的下側,實驗有效,但警告應對系統進行一定的維護;內標Ct均值在第30、58天超出+3s控制線,可能存在提取效率降低、提取純化不夠、有檢測抑制物的情況,也可能是試劑室溫平衡時間不夠、磁珠在上機前未充分混勻等所致;內標Ct值標準差在第27天發生22s失控、在第58天違背R4s失控,說明該批次內標Ct值波動較大,原因可能是儀器不穩定、電壓波動、環境溫度和濕度變化大、擴增儀孔間溫度不均勻等。
本研究混檢陽性率為0.092%、拆分陽性率為0.056%,反映了血液篩查引入核酸檢測檢測后的功效,表明核酸檢測對于剔除病毒感染早期酶聯免疫吸附試驗非反應性核酸陽性血液、提高輸血安全的價值。本研究拆出率為61.540%,其與核酸檢測檢測效能有關,可反映核酸檢測過程的穩定性[3]。若混檢陽性率顯著升高,而拆分陽性率、拆出率卻有所下降,則提示實驗室檢測過程中污染風險增高[4],此時應當回顧排查所有可能導致污染的操作過程,進行實驗室環境監測,并進一步評估污染風險。對總體監控指標進行分析發現,與本實驗室上一年同期比較(混檢陽性率、拆分陽性率、拆出率分別為0.084%、0.040%、46.670%)數據均略有上升;與安徽蕪湖市中心血站(拆分陽性率為0.080%、拆出率為65.710%)[5]結果相當,比河南省紅十字血液中心(0.035%、34.480%)[6]、江蘇淮安市中心血站(0.030%、42.420%)[7]、山東濰坊市中心血站(0.014%、44.400%)[8]略高。可能與獻血者人群來源不同、地方病毒流行率不同等有關。
需要指出的是,本研究IQC方法可能并不完全適用于臨床PCR實驗室。因為采供血單位只需要篩出陽性即可,且出于提高血液安全、把漏檢率控制在最小、盡量降低輸血傳播傳染病風險的考慮,采取的檢測策略比較激進[9]。而在臨床醫療機構中,必須準確定量,盡可能減少假陰性和假陽性,否則會給臨床診治帶來負面影響,危及患者安全。臨床機構若按此方法,可能會導致臨床檢驗中心和ISO 15189外審專家對IQC開具不合格項。
綜上所述,在血站血液篩查日常檢測中使用HBV DNA陽性質控品進行IQC實時監控,并定期對陽性質控品Ct值、試劑盒陽性對照Ct值、內標Ct均值、內標Ct值標準差繪制的Levey-Jenning質控圖進行回顧性分析,再結合日常檢測結果進行總體監控指標的統計分析,觀察實驗有效性和穩定性,可以有效實施血站HBV DNA檢測的IQC,以達到及時采取預防措施或糾正措施進行持續改進的目的。

