鋅指蛋白家族在乳腺癌發生發展中的作用及機制
雷 婷(綜述),肖 斌,何詠茵,孫朝暉,李林海(審校)
轉錄因子(transcription factor,TF)在真核生物中廣泛存在,是一類能與特異DNA序列結合的核內蛋白質因子,可與啟動子順式元件作用或與其他TF的功能區域相互作用來調控基因的轉錄表達。根據不同的DNA結合基序,TF主要分為經典鋅指、同源域和基本的螺旋-環-螺旋。近期研究表明,大量鋅指蛋白在乳腺癌組織和細胞中異常表達,與乳腺癌發生、侵襲和轉移等進程相關[1-3]。因此,揭示鋅指蛋白在乳腺癌發生、發展中的作用機制有助于開發乳腺癌新的診斷或治療靶點。本研究旨在探討鋅指蛋白的結構、分類及其在乳腺癌發生發展中的作用機制。
1 鋅指蛋白結構及分類
鋅指蛋白是指含有穩定“指狀結構”的一類蛋白質,該結構通過結合Zn2+自我折疊形成。鋅離子的存在是鋅指蛋白發揮調控作用的關鍵:當鋅離子缺乏時,鋅指蛋白與DNA/RNA序列結合的特異性會被顯著抑制,同時,蛋白本身的結構穩定性也會被破壞,影響基因表達。
根據與鋅離子結合的保守性氨基酸殘基Cys和His的不同組合,Krishna等[4]將鋅指蛋白分為8個折疊群,包括類C2H2型鋅指(C2H2-like)、塞結狀鋅指(gag knuckle)、高音譜號鋅指(treble clef)、帶狀鋅指(zinc ribbon)、Zn2Cys6鋅指、類TAZ2型鋅指(TAZ2-domain like)、鋅離子結合短環鋅指(short zinc binding loops)及金屬硫蛋白鋅指(metallothionein);也可根據鋅指結構序列和功能的不同將其分為C2H2型、RING型(C3HC4)、LIM型(C2HC5)、C4型等9大類別[5]。
C2H2型是研究最為廣泛的鋅指蛋白,以單體形式與核酸發生相互作用,可根據其N端結構域進一步分為KRAB型(krüppel-associated boxes)、SCAN型(SRE-ZBP,CTfin51,AW-1 and number 18 cDNA)、BTB(broad-complex,tramtrack,and bric-a-brac)/POZ(poxvirus and zinc finger)型等[6],這些功能結構域通過調控TF之間或與其他細胞成分間的選擇性結合來控制亞細胞定位、DNA結合和基因表達。
2 與乳腺癌相關的鋅指蛋白
2.1鋅指蛋白217(zinc finger protein 217,ZNF217)
ZNF217位于染色體20q13.2區域,其mRNA表達水平可作為ER(+)乳腺癌患者內分泌治療反應的預測因子[7]。Bellanger等[8]通過體內外研究表明,ZNF217是乳腺癌發生骨轉移的重要中介和指標。一方面,ZNF217 mRNA表達水平高的原發性乳腺癌發生骨轉移的風險更高;另一方面,非侵入性多模態體內成像發現,ZNF217增加了骨轉移生長速度,加速了嚴重的溶骨性病變的發展。此外,ZNF217過表達可驅動異常分化和激活信號通路,促進自我更新能力、間充質標記的表達、運動和轉移,并抑制成人組織干細胞基因在癌癥中的下調。硅片篩選發現,核苷類似物三西利賓(triciribine)可抑制ZNF217誘導的腫瘤生長和化療耐藥,并可抑制AKT和MAPK等信號通路磷酸化。
本研究為在臨床環境中使用三西利賓治療過表達ZNF217的乳腺癌患者提供理論基礎,同時也證明ZNF217可作為乳腺癌進展過程中的潛在預后生物標志物和治療靶點[9]。
2.2ZEB1(zinc finger E-box-binding homeobox)
ZEB1位于10p11.2號染色體上,是上皮間質轉化(epithelial-mesenchymal transition,EMT)相關TF,在間質瘤(如膠質瘤、肺癌、乳腺癌、胰腺癌)中高表達,且與腫瘤侵襲性顯著相關[10-12]。ZEB1誘導EMT的作用機制是與上皮細胞標記蛋白E-cadherin的啟動子區連接,抑制其轉錄表達,導致細胞失去上皮性質[13]。Liang等[14]證實,敲除ZEB1可通過下調Flk-1抑制MDA-MB-231細胞血管擬態的形成。透明質酸(hyaluronan,HA)主要由透明質酸合酶2(hyaluronan synthase 2,HAS2)合成,是一種細胞外基質蛋白多糖,在乳腺腫瘤中富集[15]。研究發現,胞外HA與CD44s協同觸發ZEB1表達而促進ZEB1介導的EMT,而ZEB1也可直接與HAS2啟動子結合并激活其表達,促進更多的HA合成,從而進一步增強ZEB1,形成HA/CD44 s、HAS2和ZEB1正反饋回路[16]。
ZEB1/p53軸作為一種基質特異性信號通路,可促進乳腺上皮腫瘤進展[17]。間質成纖維細胞中ZEB1的缺失可增加成纖維細胞生長因子2/7(fibroblast growth factor 2/7,FGF2/7)、血管內皮生長因子(vascular endothelial growth factor,VEGF)和白細胞介素6(interleukin-6,IL-6)啟動子的乙酰化及p53的表達和募集,從而減少其在周圍間質中的產生和分泌。而在ZEB1基質缺失的乳腺腫瘤中,p53消融能充分恢復受損的腫瘤生長和進展。
2.3Snail 鋅指蛋白Snail是一種E-cadherin表達的轉錄抑制因子,其通過與上皮性腫瘤抑制基因(cadherin 1,CDH1)結合啟動EMT,是EMT的關鍵誘導因子之一。Maturi等[18]對Snail1在三陰性乳腺癌細胞中進行全基因組染色質免疫沉淀測序(ChIP-seq)分析,發現Snail1通過多種新機制參與乳腺癌細胞的惡性表型。Bossart等[19]證實,它莫西芬(tamoxifen)可誘導Snail抑制侵襲性小葉乳腺癌生長。Snail在細胞遷移和轉移中也起著至關重要的作用[20]。具體來說,Snail在乳腺癌細胞中誘導PAPS合酶2(3′-phosphoadenosine 5′-phosphosulfate synthase 2,PAPSS2)和多能聚糖(versican,VCAN)的表達,而PAPSS2的缺失以及PAPSS抑制劑氯酸鈉的加入導致MCF7和MDA-MB-231細胞遷移減少,裸鼠肺轉移率和微轉移結節數量也明顯降低。此外,Snail、PAPSS2和VCAN在乳腺癌組織中的表達呈正相關。這些結果體現了Snail1作為轉移性乳腺癌治療靶點的潛力。
3 鋅指蛋白在乳腺癌中的作用及機制
鋅指蛋白由于其特殊的指狀結構,可通過識別并結合DNA、RNA等序列或與蛋白質相互作用,從而實現轉錄調控。作為人體內重要的TF,鋅指蛋白廣泛參與乳腺癌的發生發展過程(表1)。

表1 鋅指蛋白在乳腺癌中的作用機制
3.1增殖、生長和凋亡 ZFP57(zinc finger protein 57)是KRAB-ZNF家族成員,在胚胎干細胞(embryonic stem cell,ESC)中可以維持DNA甲基化。研究發現,ZFP57為乳腺癌抑制因子,可通過調控MEST啟動子區的甲基化,下調MEST介導的Wnt/β-catenin信號通路,從而抑制乳腺癌細胞增殖[21]。Wang等[22]發現,ZNF496通過C2H2結構域與ERα的DNA結合域相互作用,選擇性抑制ERα靶基因,最終抑制ERα(+)乳腺癌細胞的生長。Han等[23]的研究表明,ZIC1(zinc finger of the cerebellum 1)抑制乳腺癌細胞增殖,并通過抑制Akt/mTOR/P70S6K通路進而抑制生存素(survivin)表達,促進細胞凋亡。
CTCF(CCCTC-binding factor)是一種11-鋅指多功能蛋白,具有轉錄激活、抑制和染色質屏障活性等分子功能。研究發現,CTCF的缺失致使乳腺癌細胞發生增殖減少、凋亡增加、細胞周期阻滯等表型改變,這與p53的激活密切相關。CTCF作為p53的轉錄抑制因子,其結合位點位于TP53第一個外顯子上游約800 bp處。CTCF的缺失會激活p53及其下游基因p21和Bax(BCL2 associated X),導致細胞周期阻滯和凋亡[24]。
TRPS1(transcriptional repressor GATA binding 1)常在乳腺癌中發生擴增和失活突變。Cornelissen等[25]通過體內外功能喪失的方法分析TRPS1在乳腺發育和侵襲性小葉型乳腺癌中的作用,發現其導致E-cadherin功能喪失。E-cadherin和TRPS1的聯合失活導致小鼠乳腺類器官的持續增殖和加速乳腺腫瘤的形成。可見TRPS1在乳腺癌中能夠作為一種依賴于環境的腫瘤抑制因子,同時對正常乳腺上皮細胞的生長和分化起著至關重要的作用。
SALL1(spalt like transcription factor 1)是一種調控器官發生和干細胞發育的多鋅指TF,可通過介導核小體重構和去乙酰化酶(NuRD)復合物的募集來誘導癌細胞衰老[26]。Cui等[27]發現,Znhit1(zinc finger HIT-type containing 1)可通過上調同源性磷酸酶(phosphatase and tensin homolog,PTEN)致使PI3K/Akt/mTOR通路失活,進而抑制乳腺癌的發生。
綜上所述,鋅指蛋白主要通過轉錄調控一系列下游靶基因的形式,激活或抑制Wnt/β-catenin、Akt/mTOR等乳腺癌相關通路,進而影響乳腺癌細胞的增殖、生長和調亡。
3.2侵襲、遷移和轉移 Liu等[28]發現,GGNBP2(ZNF403)通過抑制IL-6/STAT3信號通路的激活,進而抑制三陰性乳腺癌的侵襲性。高通量乳腺癌表達數據集分析表明,ZNF367在轉移性乳腺癌中特異性過表達,同時高表達ZNF367的患者無轉移生存期和總生存期較短[29]。體內外實驗表明,ZNF367促進腫瘤轉移,同時伴有循環腫瘤細胞(circulating tumor cell,CTCs)數目的增加。由于CTCs的存活與其抵抗失巢凋亡的能力相關,而Hippo通路的中下游效應器YAP1(yes associated protein 1)已證實在乳腺癌細胞中發揮抑制失巢凋亡和促進轉移的作用。ZNF367通過招募染色質重構蛋白BRG1激活CIT(citron rho-interacting serine/threonine kinase)和TP53BP2(tumor protein p53 binding protein 2)的轉錄,而CIT和TP53BP2可以抑制YAP1的磷酸化,進而抑制Hippo通路,激活YAP1信號,并抑制乳腺癌的失巢凋亡和促進CTCs的存活,最終導致乳腺癌的遠處轉移。Lee等[30]發現,A20在人基底樣乳腺癌中顯著上調,其表達水平與無轉移患者的生存期呈負相關。進一步研究表明,A20可在3個賴氨酸殘基上磷酸化Snail1,促進TGF-β1誘導的EMT,從而促進侵襲性基底樣乳腺癌的轉移。
Osx(Osterix)是一種鋅指TF,對成骨細胞分化和骨形成至關重要。Yao等[31]證實,Osx上調與淋巴結轉移和患者預后不良有關,且Osx通過上調參與侵襲、血管生成和骨溶解的基質金屬蛋白酶9/13(matrix metallopeptidase 9/13,MMP9/13)、血管內皮生長因子(vascular endothelial growth factor,VEGF)、IL-8和甲狀旁腺激素樣激素(parathyroid hormone like hormone,PTHrP),促進乳腺癌的侵襲和骨溶解轉移。Chen等[32]確定了乳腺癌細胞中低氧誘導的表觀遺傳閱讀器ZMYND8(zinc finger MYND-type containing 8)。ZMYND8與低氧誘導因子(hypoxia inducible factor,HIF)相互作用,并通過募集BRD4(bromodomain containing 4)并增加RNA聚合酶Ⅱ磷酸化共激活HIF誘導的癌基因,從而增加血管生成和細胞運動性,減少癌細胞死亡,同時促進乳腺癌ZMYND8被p300乙酰化,乙酰化的ZMYND8對于HIF激活及乳腺腫瘤的進展和轉移是必需的。
3.3耐藥 ZNF703為常見乳腺癌致癌基因,屬于NET/NlZ鋅指TF家族成員,其表達上調和細胞凋亡耐藥、化療耐藥之間存在聯系。Marzbany[33]通過RT-PCR比較ZNF703在人乳腺癌組織、正常乳腺組織和MCF-7乳腺癌細胞株中的表達水平,發現其在乳腺癌組織和MCF-7細胞中的表達分別增加了93.3%和4倍。他們還研究了抗ZNF703 RNAi干擾和布洛芬單獨或聯合對MCF-7細胞存活和凋亡的抑制作用,結果表明,布洛芬聯合抗ZNF703 siRNA比單獨治療更能促進細胞凋亡[33],可見抗ZNF703 RNAi聯合布洛芬作為環氧化酶-2的抑制劑,對乳腺癌細胞具有高度抑制作用,顯示出治療乳腺癌的潛力。
ZEB1也是乳腺癌對抗雌激素治療產生耐藥性的關鍵因素[34]。ZEB1通過在ERα啟動子上形成ZEB1/DNMT3b/HDAC1復合物,抑制ERα轉錄,導致DNA甲基化和ERα沉默。因此,ZEB1會下調ERα表達并減弱雌激素對細胞生長的抑制。大量的乳腺癌標本檢測表明,ZEB1與ERα蛋白質表達存在顯著的負相關性。此外,乳腺癌高度表達ZEB1抑制ERα啟動子甲基化。裸鼠異種移植模型證實ZEB1表達下調可在體內恢復乳腺癌細胞對抗雌激素治療的反應性。最終結果表明,ZEB1可在乳腺癌中誘發ERα啟動子甲基化和授予雌激素抗性。Zhang等[35]發現,ZEB1通過在ATM啟動子上形成ZEB1/p300/PCAF復合物,激活ATM激酶表達,增加乳腺癌中同源重組介導的DNA損傷修復和DNA斷裂清除,導致化療耐藥。
3.4干細胞特性 腫瘤干細胞因其自我更新和治療抵抗等特性,被認為是造成腫瘤發生發展、耐藥耐輻射和復發的主要原因。Li等[36]發現,ZNF32可通過上調膜相關雌激素受體(G protein-coupled estrogen receptor 1,GPER)的表達,激活ERK信號,誘導干細胞樣亞群的擴增和增加耐藥性。他們還證明ZNF32通過與GPER啟動子結合誘導GPER表達,ZNF32/GPER表達與移植瘤小鼠模型中腫瘤發生率和腫瘤負荷的增加之間存在相關性。綜上所述,ZNF32參與GPER/ERK信號傳遞,并賦予乳腺癌干細胞樣特性。Hong等[37]的研究表明,TFRUNX1(RUNX family transcription factor 1)通過抑制干細胞活性和直接抑制ZEB1表達來抑制乳腺癌腫瘤生長。Kuo等[38]分析位點突變,發現Myeloid Zinc finger-1磷酸化驅動骨橋蛋白介導的癌相關成纖維細胞表型,進而增加乳腺癌細胞的干性。
3.5自噬 自噬是細胞內膜結構、蛋白復合物和溶酶體作為溶細胞自噬體降解和更新細胞質成分的主要分解代謝過程,雖然機制尚未完全闡明,但大量研究表明其在乳腺癌中發揮重要作用。ZNF32被認為是一種有效的自噬抑制劑,可保護乳腺癌細胞免受過度刺激-自噬誘導的細胞死亡[39]。乳腺癌細胞中,ZNF143低表達可通過調控p53-Beclin1軸的自噬過程表現出更好的生存力。與普通MCF7細胞比較,經ZNF143敲除的MCF7細胞在饑餓狀態下表現出更好的存活率和更多的自噬小泡,且Beclin1、p62和ATGs等自噬相關蛋白也在ZNF143敲除細胞中表達發生改變。此外,ZNF143敲除影響p53的穩定性,表現出對蛋白酶體抑制劑MG132的依賴性。而對ZNF143敲除的乳腺癌細胞進行蛋白質組分析,發現NAD(P)H醌脫氫酶1[NAD(P)H Quinone Dehydrogenase 1,NQO1]對p53的穩定性起作用[40]。
4 總結與展望
作為真核生物TF中的一個大家族,鋅指蛋白在多個生物學領域發揮著重要作用。雖然其機制尚未完全闡明,但轉錄調控的特性已得到廣泛證實和初步應用,不僅在基因表達調控等基礎研究領域展現了廣闊前景,還在臨床腫瘤診斷和治療等領域展露出巨大的潛力。鋅指蛋白廣泛參與乳腺癌生長、侵襲、轉移等一系列發生發展過程:一方面,鋅指蛋白可通過鋅指結構域招募相互作用蛋白,從而激活或抑制下游基因及相關通路;另一方面,鋅指蛋白在不同鋅指基序組合下表現出不同的特異性DNA結合能力,從而通過結合直接調控下游基因及通路,影響乳腺癌進程(圖1),這為探究一些新型鋅指蛋白如何在乳腺癌發生、發展中發揮轉錄調控功能,為乳腺癌診斷、靶向治療及耐藥,發掘其臨床應用價值。此外,隨著對鋅指蛋白結構和功能研究的不斷深入,未來有望通過設計更多人工鋅指蛋白來調控相應的基因轉錄,實現根據需要利用鋅指蛋白調控真核生物中基因的表達,為基因治療開拓新領域。
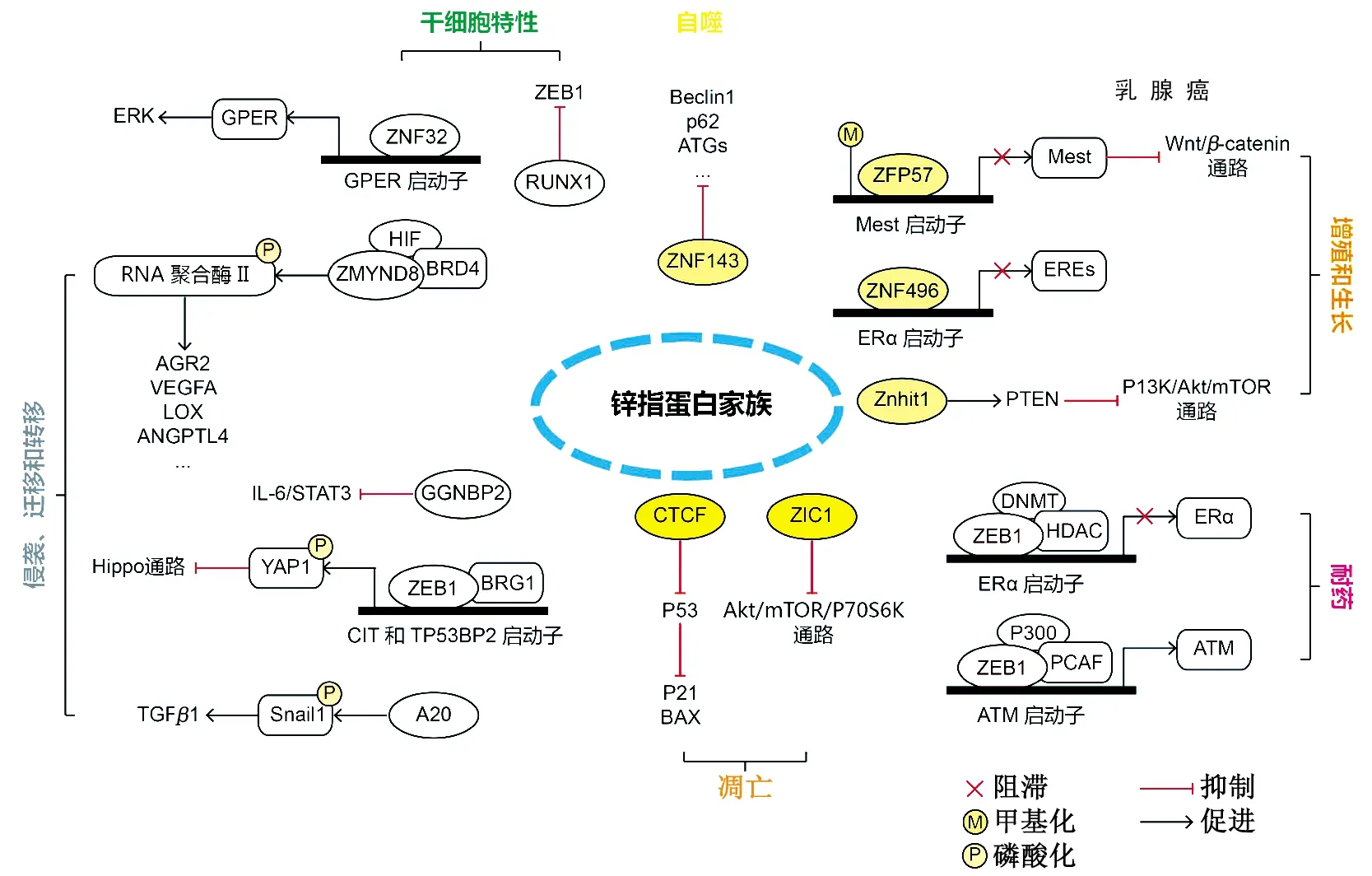
ERK:胞外信號調節激酶;GPER:G蛋白偶聯雌激素受體;ZNF:鋅指蛋白;ZEB1:轉錄抑制因子鋅指E-盒結合同源異形盒;RUNX1:侏儒相關轉錄因子1;Beclin1:人卷曲螺旋肌球蛋白樣BCL2結合蛋白;ATGs:自噬相關蛋白;Mest:中胚層特異性轉錄同源蛋白;ERα:雌激素受體α;Znhit1:HIT型鋅指蛋白1;PTEN:同源性磷酸酶;DNMT:DNA甲基轉移酶;HDAC:組蛋白去乙酰化酶;PCAF:賴氨酸乙酰轉移酶2B;ATM:毛細血管擴張性共濟失調突變激酶;ZIC1:小腦鋅指1;CTCF:CCCTC結合因子;BAX:BCL2結合X蛋白;TGFβ1:轉化生長因子β1;Snail1:蝸牛家族轉錄抑制因子1;CIT:枸櫞相互作用絲氨酸/蘇氨酸激酶;TP53BP2:腫瘤蛋白p53結合蛋白2;BRG1:染色質重構蛋白1;YAP1:Yes1相關轉錄調控因子;GGNBP2:配子生成素結合蛋白2;STAT3:信號轉換器和轉錄激活因子3;AGR2:前梯度蛋白2同源物;VEGFA:血管內皮生長因子A;LOX:賴氨酰氧化酶;ANGPTL4:血管生成素樣蛋白4;ZMYND8:MYND型鋅指蛋白8;BRD4:溴結構域蛋白4;HIF:低氧誘導因子。

