原發性肝癌患者血清sTRAIL、MMP-3水平及其與肝纖維化指標的相關性
幸紅軍
遼寧省沈陽市第四人民醫院檢驗科,遼寧沈陽 110031
原發性肝癌為我國常見惡性腫瘤之一,目前其病因及發病機制尚未完全明確,盡早診治可明顯提高患者總體療效。部分原發性肝細胞癌能夠通過檢驗指標診斷,不能采用檢驗指標診斷的需進行穿刺或者手術取病理組織活檢確診,但后者具有創傷性,有一定的潛在風險,難以重復進行,另外,抽樣誤差也可能影響病理診斷的準確性。血清生化指標檢測是臨床上最常用的無創檢查方式,相關研究表明,原發性肝癌的惡變由多種因素所致,機體受刺激時可誘導T淋巴細胞浸潤,并促進可溶性腫瘤細胞壞死因子相關凋亡誘導配體(sTRAIL)表達,sTRAIL能夠參與機體自身免疫性疾病、炎性反應和肝細胞凋亡,引起肝臟免疫受損[1]。基質金屬蛋白酶(MMP)在肝癌細胞外基質、組織再塑形中有重要作用,MMP-3高表達是多種惡性腫瘤發生、發展的標志,其表達水平與腫瘤淋巴結轉移、腫瘤分化程度有明顯相關性,可能成為判斷腫瘤預后、復發、侵襲、轉移的危險標志物[2]。另有研究發現,肝纖維化為多種慢性肝病的必然發生的病理改變,肝纖維化能夠反映肝臟病變程度[3]。近年來,有研究發現,細胞外基質合成及降解相關的標志物與肝纖維化程度關系密切[4]。本研究旨在分析原發性肝癌患者血清sTRAIL、MMP-3的表達及與肝纖維化指標的相關性,為原發性肝癌的臨床診治提供參考依據。
1 資料與方法
1.1一般資料 選擇本院2018年1月至2019年5月收治的52例原發性肝癌患者納入原發性肝癌組。納入標準:均根據臨床病史、癥狀、實驗室指標及影像學檢查確診為原發性肝癌;心、腦、腎等器官無明顯障礙;KPS評分大于60分;未接受放化療[5]。排除標準:近期接受過正規免疫調節劑治療;合并肝臟血管畸形、血管瘤等疾病;合并凝血功能障礙及血液系統病變;妊娠期或者哺乳期女性。原發性肝癌組中男32例,女20例;年齡38~73歲,平均(51.42±8.51)歲;TNM臨床分期[5],包括Ⅰ期13例,Ⅱ期20例,Ⅲ期19例。收集同期本院收治的63例肝良性腫瘤患者作為良性腫瘤組,均經穿刺取病理組織活檢確診為良性腫瘤,其中肝細胞腺瘤21例,肝血管瘤26例,肝囊腫16例;男37例,女26例;年齡36~71歲,平均(52.65±7.49)歲。選擇同期在本院門診體檢的健康體檢者39例作為對照組,其中22例,女17例;年齡37~74歲,平均(53.75±7.03)歲。3組研究對象年齡、性別比較,差異無統計學意義(P>0.05),具有可比性。
1.2方法 采集所有受試者空腹外周靜脈血,3 000 r/min離心15 min,將上清液保存在—80 ℃低溫箱中待檢。采用酶聯免疫吸附試驗檢測血清sTRAIL、MMP-3水平,試劑盒購自上海江萊生物科技有限公司。采用放射免疫法測定透明質酸(HA)、層黏連蛋白(LN)、Ⅲ型前膠原肽(PCⅢ)、Ⅳ型膠原(Ⅳ-C)水平,試劑盒購自上海雅吉生物科技有限公司。
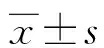
2 結 果
2.1各組血清sTRAIL、MMP-3和肝纖維化指標比較 原發性肝癌組血清sTRAIL、MMP-3水平高于良性腫瘤組及對照組(P<0.05);良性腫瘤組血清sTRAIL、MMP-3水平高于對照組(P<0.05);原發性肝癌組肝纖維化指標HA、LN、PCⅢ、Ⅳ-C水平高于良性腫瘤組及對照組,差異均有統計學意義(P<0.05);良性腫瘤組及對照組HA、LN、PCⅢ、Ⅳ-C水平比較,差異無統計學意義(P>0.05)。見表1。
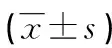
表1 各組血清sTRAIL、MMP-3和肝纖維化指標比較
2.2不同TNM分期原發性肝癌患者血清sTRAIL、MMP-3和肝纖維化指標比較 Ⅰ期、Ⅱ期、Ⅲ期患者血清sTRAIL、MMP-3和HA、LN、PCⅢ、Ⅳ-C水平依次升高,兩兩比較,差異均有統計學意義(P<0.05)。見表2。
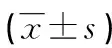
表2 不同TNM分期原發性肝癌患者血清sTRAIL、MMP-3和肝纖維化指標比較
2.3血清sTRAIL、MMP-3對原發性肝癌的診斷價值分析 sTRAIL、MMP-3、sTRAIL+MMP-3的ROC曲線下面積(AUC)分別為0.686、0.730、0.806,靈敏度分別為0.857、0.731、0.846,特異度分別為0.562、0.698、0.650。見表3和圖1。

圖1 血清sTRAIL、MMP-3對原發性肝癌診斷的

表3 血清sTRAIL、MMP-3對原發性肝癌的診斷價值分析
2.4原發性肝癌患者血清sTRAIL、MMP-3和肝纖維化指標之間的相關分析 原發性肝癌患者血清sTRAIL、MMP-3和肝纖維化指標之間均呈正相關(r=0.501~0.651,P<0.05)。見表4。

表4 原發性肝癌患者血清sTRAIL、MMP-3和肝纖維化指標之間的相關分析
3 討 論
原發性肝癌是危及患者生命安全的常見惡性腫瘤,盡管目前臨床在其治療上取得了明顯進展,但由于此類疾病具有高度的惡性生物學行為,加上傳統外科手術及放化療等方法的局限性,原發性肝癌患者的預后較差。明確原發性肝癌發生、發展和肝內轉移機制,探討有效的防治手段有助于提高該疾病的療效。
相關研究報道,NK細胞誘導的細胞毒性作用可能由腫瘤壞死因子(TNF)超家族經受體-配體結合受體所致,在原發性肝癌發生、發展中有重要作用[6]。另有研究報道,sTRAIL為TNF超家族成員,廣泛表達于活化的NK細胞、T淋巴細胞等,可特異性誘導腫瘤細胞、轉化細胞出現凋亡,不影響正常組織細胞的凋亡功能,機體在病理狀態下sTRAIL可參與免疫反應,調控細胞凋亡[7]。因此,sTRAIL被證實參與機體腫瘤細胞凋亡、炎性反應等多種病理反應。本研究結果顯示,原發性肝癌患者血清sTRAIL水平明顯高于良性腫瘤組及對照組,說明原發性肝癌的病理損傷中存在sTRAIL誘導的細胞凋亡,可能是肝臟清除病毒及病理受損的機制之一。進一步分析顯示,Ⅲ期原發性肝癌患者血清sTRAIL水平較Ⅱ期和Ⅰ期患者明顯上升,提示隨著腫瘤分期的進展,血清sTRAIL水平相應上升。ROC曲線分析發現,血清sTRAIL對原發性肝癌診斷的AUC高于0.500,證實其在此類疾病中的診斷價值。
已有研究證實,腫瘤細胞侵襲細胞外基質為原發性肝癌發生的另一重要環節,腫瘤細胞侵襲突破基底膜后可誘導基底膜降解,在基質內快速侵襲性生長,從而促進腫瘤的轉移[8]。MMPs為內源性蛋白水解酶,正常狀態下其主要水解細胞外基質,并參與細胞的生成及代謝,維持細胞穩定性,病理狀態下其過度表達,達到浸潤組織及轉移癌細胞的目的。MMP-3能夠誘導降解構成細胞外基質及基底膜的LN、纖維連接蛋白等,促進腫瘤浸潤、轉移。本研究結果顯示,原發性肝癌組血清MMP-3水平較良性腫瘤組及對照組高,說明其在原發性肝癌中的表達明顯上調,可能是因為腫瘤細胞中MMP-3調節系統紊亂,從而增加降解細胞外基質的能力,促進新生血管形成及腫瘤侵襲能力,導致腫瘤惡性浸潤生長。以上結果說明,監測血清MMP-3水平能反映病灶的侵襲能力,預測原發性肝癌患者生存情況。另外,本研究發現,原發性肝癌Ⅲ期患者血清MMP-3水平明顯高于Ⅱ期和Ⅰ期患者(P<0.05),提示通過測定血清MMP-3水平能夠反映腫瘤分期情況。ROC曲線也提示MMP-3對原發性肝癌有一定的診斷作用。
一方面,原發性肝癌患者需經歷長期的炎性反應及纖維化階段,單核細胞、巨噬細胞活化后可釋放大量的細胞因子及炎癥介質,通過旁分泌途徑誘導細胞增殖,導致成纖維細胞的增生,促進HA、LN的增加[9]。另一方面,肝實質細胞受損后可減少肝內細胞數量,對血清HA、LN的攝取及降解可引起纖維化指標水平異常上升,導致肝細胞發生持續的損傷、修復及增生,影響正常肝細胞的增殖,增加細胞變異可能性,從而誘導肝細胞癌。PCⅢ及Ⅳ-C由肝臟間質細胞合成,經內皮細胞分解,能夠客觀反映肝纖維化狀態,是反映肝纖維化生成的血清學指標[10]。本研究結果顯示,原發性肝癌組HA、LN、PCⅢ、Ⅳ-C水平較良性腫瘤組及對照組高,而良性腫瘤組及對照組HA、LN、PCⅢ、Ⅳ-C水平相似,說明原發性肝癌患者有明顯的肝纖維化傾向,考慮與大部分原發性肝癌患者具有慢性肝臟疾病史,肝纖維化水平上升,此類患者腫瘤包膜破壞、肝細胞受損程度及細胞外基質分解代謝活躍有關。本研究相關分析顯示,原發性肝癌患者血清sTRAIL、MMP-3水平與肝纖維化指標呈正相關,說明血清sTRAIL、MMP-3水平能夠在一定程度上反映肝纖維化程度。
綜上所述,血清sTRAIL、MMP-3可能參與原發性肝癌的發生、發展,且與肝纖維化指標水平呈正相關,對原發性肝癌的早期診斷有重要價值。但本研究樣本量較少,需進一步加大樣本量,減少隨機誤差再進行下一步研究,以增加結論可靠性。

