對新形勢下藥品流通監管的建議
張磊 張秀洪
福建省食品藥品認證審評中心
近年來,隨著新一輪機構改革和相關法律法規及規范性文件的修訂完善,我國藥品流通監管模式及行業生態發生了顯著轉變。通過職責劃分,國家級、省級、市級等各級藥品監督管理部門的監管責權更加清晰明確;近年來國家級、省級、市級組織開展的一系列專項檢查、有因檢查和飛行檢查等日常監管檢查,我國藥品流通行業違法違規經營狀況得到了有效整治和改善,藥品流通領域風氣得到了有效凈化,藥品經營秩序得到有效規范。同時,由于機構改革的縱向深入推進,部分監管職權發生調整,當下藥品流通領域也面臨著一些新問題,如國家級藥品監督管理部門對省級藥品流通環節監管缺位、部分法律法規及規范性文件未及時、有效修訂等,導致監管過程中出現新的問題。
本文通過分析新一輪機構改革以來藥品流通領域監管過程中遇到的問題,重點梳理了藥品流通領域監管方式、監管職權及相關法律法規、專業化檢查員隊伍建設存在的問題,并有針對性地提出建議,以期為監管部門監管提供參考。
一、新形式下的藥品批發換證檢查模式滯后,建議將監管資源轉移至事中事后監管
為精簡審批流程,深化“放管服”改革,強化事中事后監管,國家藥品監督管理局(以下簡稱“國家局”)從服務大局出發,在新《藥品管理法》中,對藥品經營企業不再規定實行認證制度,不再發放認證證書。從此,長期以來延續的藥品GSP認證檢查[1]審批模式宣告終結[2]。然而,藥品批發企業認證檢查的取消未將許可換證檢查一并納入取消范疇。根據新《藥品管理法》第五十一條的規定,《藥品經營許可證》到期后需重新審查發證。自《藥品管理法》正式實施一年多以來,幾乎各省級藥品監督管理局(以下簡稱“省級局”)采用的審查模式依舊少不了現場檢查環節,導致當前形勢下只是少發一張證,原先該有的換證檢查程序并未精簡,改革不夠徹底到位。主要原因是在現有的“四個最嚴”監管環境下,若沒有國家局的頂層設計和倡導,各省級局無合理精簡依據,不敢擅自將許可換證檢查程序一并精簡。各省級局在每輪換證高峰期中,需耗費大量的人力物力財力來完成五年到期換證檢查任務。但是,現有的換證模式仍是企業提前花費大量時間精心準備迎檢,這種企業有備而來的迎檢,很難挖查出企業存在的重大問題線索,不能充分反應出企業的真實經營狀況,檢查時見到的往往是企業最完美的狀態,達不到預期的監管效果。
因此,建議國家局可通過鼓勵試點的方式,各省級局大膽嘗試,逐步探索取消這種事前通知、精心準備的五年一換證審批模式,探索申報材料審查備案換證方式,將有效監管力量解放出來,轉而強化不提前通知、不聽匯報、直入現場的事中事后監管,使藥品流通領域的監管更科學[3]。同時對于違法違規行為,發現一起,查出一起,通報一起,形成監管震懾力,樹立監管威信,形成企業不敢亂、不想亂的市場環境,守住人們用藥安全的美好愿望和需求。
二、國家局在藥品流通監管環節缺位,建議國家局持續強化在藥品流通環節的監管地位
為形成責權清晰的監管模式,強化屬地監管職責,此次機構改革,根據《國家藥品監督管理局職能配置、內設機構和人員編制規定》[4],國家局重點負責藥品、醫療器械和化妝品的研制環節許可檢查,將藥品批發企業和零售連鎖總部監管事權下放至省級局統籌監管,弱化了國家局對各省級局藥品流通環節的監管。根據國家局官網發布的一系列監管動態,機構改革前,國家局每年會組織部分骨干力量,對各省藥品批發企業流通環節開展監督檢查,查處了一大批違法違規行為。如根據國家藥品監督管理局發布的2016年度藥品檢查報告顯示,檢查的50家藥品批發企業中嚴重違法規定的有40家,占比80%[5];2017年度藥品檢查報告顯示,檢查的55家藥品批發企業中嚴重違反規定的有19家,占比34.5%[6];2018年度藥品GSP檢查報告顯示,檢查的藥品57家批發企業中嚴重違反規定的有19家,占比33%(表1);2019-2020年,國家局持續加大對化妝品的飛行檢查,而對藥品流通環節監管缺失。伴隨著當下促發展和抓質量成為新形勢下主題,各省政府在面臨經濟下行壓力背景下,促發展顯得尤為重要。各省級局在日常監管中,難免因歸屬為轄區內企業,同時面臨促發展難題時,會出現有所偏頗。長期以往,國家局監管的缺位,可能會積蓄部分重大藥品流通安全風險隱患。
國家局的監督檢查有其天然優勢,抽調的各省骨干檢查在嚴格秉持公平公正原則下,能更少顧慮將發現的問題充分暴露出來,淘汰不遵守法律法規的行業不法者,形成強大震懾力,減少藥品流通環節的風險,促進行業的風清氣正。因此,鑒于國家局在藥品流通環節特殊地位,建議國家局持續保持對藥品流通環節監督檢查的重視,避免在藥品流通環節出現系統性、區域性重大事故。
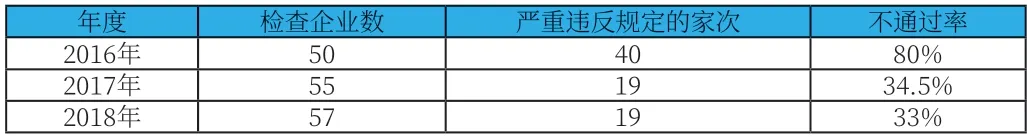
表1 2016-2018國家局開展藥品批發企業檢查不通過率一覽表
三、監管事權劃分不夠科學合理,建議予以適當調整
機構改革后,根據國家局“三定方案”的規定[4],省級局負責零售連鎖總部許可,市縣兩級市場負責藥品零售。連鎖企業總部與其所屬零售門店,兩者為一個完整的有機整體,此種分工模式導致了監管過程中零售連鎖總部與其所屬門店相分離,監管過程中將一個完整有機體切割成兩個獨立部分分頭管理,從而在監管過程中難以有效監管。如由于職責分工所在,省級局在對連鎖總部進行監管時,重點落在連鎖總部,未其對所屬門店管理情況進行延伸;市級局在對所屬門店進行監管時,未對其與連鎖總部的關聯進行延伸,出現職責分工明確后相互推諉情形,容易留下監管空白地,不能有效發揮連鎖總部模式的集團化、統一化管理優勢。因此,建議國家局能在今后的機構改革中,重新劃分該項事權,重新進行整合,將連鎖總部與其門店按照統一的整體進行統一監管,避免形成兩頭管后兩頭都不管的情形。
四、藥品流通環節配套法律法規體系尚不健全,建議進一步改革完善相關法律法規及規范性文件
健全的法律法規體系是行業從業者的基本遵循,也是監管部門的監管依據和監管支撐。新《藥品管理法》實施后,《藥品注冊管理辦法》、《藥品生產監督管理辦法》等藥品研制、生產環節相關配套法規陸續發布實施,《藥品經營監督管理辦法》目前尚處于征求意見稿中而未正式生效實施。伴隨著新《藥品管理法》的實施,藥品GSP認證相應取消,GSP認證證書也不再發放,監管過程中不再存在收回或者撤銷藥品GSP證書的風險控制措施,這樣導致過渡期內由于沒有有效的法律支撐,部分問題難以判定處理。如在換證許可過程中發現嚴重缺陷該如何處理,是停業整頓還是限期整改,或是吊銷《藥品經營許可證》,由于目前無有效的法律依據參考,各省市采取的做法不一;換證許可檢查中檢查結果判定適用《藥品經營質量管理規范現場檢查指導原則》中認證檢查結果判定還是監督檢查結果判定或是有新的判定形式,目前亦尚不明確。
根據新《藥品管理法》的規定,國家鼓勵、引導藥品零售連鎖經營,根據《藥品經營質量管理規范現場檢查指導原則》的規定,藥品零售連鎖的檢查指導原則參照藥品批發企業執行。但與藥品批發企業相比較,藥品零售連鎖企業有其獨特的業態特點,由于沒有明確的檢查指導原則或相應附錄文件,監管部門及行業從業者對部分經營行為難以達成統一意見,形成五花八門的做法。如連鎖總部對所屬門店如何管理問題、門店間藥品調撥問題、連鎖門店是否可以獨立采購問題、是否允許加盟門店問題,再如委托儲存配送的同時委托采購,零售連鎖總部是否必須再審核批準建立首營品種基礎數據庫問題;委托儲存配送時,委托方與受托方計算機系統管理問題、以及其他問題等[7],以上問題有待配套性規范文件進一步規范明確。
因此,建議國家局加緊出臺《藥品經營監督管理辦法》,同時修訂《藥品經營質量管理規范現場檢查指導原則》,增加新形勢下藥品零售連鎖模塊的監管指導文件,縮短法律法規及規范性文件過渡期內造成的不確定性和混亂性。
五、藥品類體外診斷試劑經營企業人員資質要求過高,建議適當降低門檻
從實際出發是立法的基本著力點和出發點[8],法律法規的規定從實際出發,適應行業需求才能有更強的生命力和執行力。2016年,國家局修訂印發的《藥品經營質量管理規范現場檢查指導原則》,在原有的基礎上新增了《體外診斷試劑(藥品)經營企業》作為第三部分,將藥品類體外診斷試劑納入藥品流通范疇進行管理,進一步強化了藥品類體外診斷試劑管理要求,明確了檢查指導原則。根據指導原則的要求,企業質量管理人員中應至少1人為主管檢驗師,并具有檢驗學相關專業大學本科以上學歷及3年以上體外診斷試劑檢驗工作經歷。該條旨在保證該類藥品在流通環節的安全性、可靠性。然而結合當下人才實際及企業訴求,該條款門檻過高,滿足以上條件的人才大部分在醫療機構任職,在實際執行中很難挖掘到符合要求的人才流轉到藥品批發企業擔任質量管理崗位,或者找到的人為醫院退休離職人員再就業,難以保證其有效履職,達不到法規預期效果。現行狀態下部分經營藥品類體外診斷試劑企業為符合規范要求而設置該崗位,流于形式。因此建議在下次修訂該指導原則時,國家局可適當放寬該條條款標準,降低要求,保證該崗位人員能真正在職在崗和有效履職。
六、檢查結果判定原則不全面、過于教條,建議與時俱進的進行修訂完善
(一)變更許可檢查結果判定原則無統一規定
現場檢查結果判定原則作為檢查下結論的重要依據,影響整個檢查和行政審批最終結果。現行的《藥品經營質量管理規范現場檢查指導原則》對于監督檢查結果判定予以了明確,但對于許可類變更事項檢查結果判定并未明確,導致各省在無明確指導意見下,各自采取約定俗成的延續做法。長此以往,容易導致監管雙方因對檢查結論意見不同而導致糾紛,且由于目前沒有明確的法律判定依據,若產生行政糾紛,監管部門會處于被動狀態。因此,建議國家局對許可變更類檢查結論出臺相應指導意見或出臺相關法律法規規范性文件,為保證許可變更檢查和行政審批的嚴肅性提供法律保障。
(二)許可換證檢查結果判定原則過于教條
根據原《藥品經營質量管理規范認證管理辦法》的規定,在審批檢查過程中,被要求限期整改的企業,認證檢查機構在收到復查申請后組織復查,該法規旨在進一步督促藥品經營企業有效整改,持續提升藥品質量管理體系。但該項法規的要求在有利的同時,導致出現以下幾點不利之處:一是造成監管資源的浪費。在審批過程中,時常遇到部分主要缺陷項目通過紙質整改材料審查即可確定是否整改到位,但由于法規明確規定需再次組織復查,監管部門得再次安排現場復查,導致了監管資源的浪費,不利于國家倡導的提速、增效;二是不利于問題的暴露。質量管理體系的完善是一個循序漸進過程,《藥品經營質量管理規范現場檢查指導原則》中規定的藥品批發企業主要缺陷項共103項,很難有企業做到百分之百的盡善盡美。檢查過程中發現企業存在部分非關鍵主要缺陷(如個別供應商首營資料未及時更新問題),但該企業整體質量管理體系相對完善可控時,難免會存在缺陷項目口頭告知企業的情形,不利于問題的暴露和持續的完善整改。因此,建議在下一步相關法律法規及規范性文件修訂時,堅持《藥品管理法》中倡導風險管理原則,對于限期整改情形,不強制要求組織復查,可根據風險程度具體情況具體對待,讓監管雙方都更愿意充分暴露所有問題,促進企業質量管理體系的持續改進和提升。
七、專業化檢查員隊伍要專業,建議對建立的檢查員隊伍實行嚴格的上下級考核機制
建立一支業務精湛、素質優良的檢查員隊伍,是監管部門實施有效監管的利劍。近年來,隨著機構改制的推進,加上問責制度的嚴厲,部分有能力的骨干檢查員轉崗或輪崗,造成骨干監管人員流失,給各級監管和檢查員抽調工作帶來了困難。為解決該難題,國家從頂層設計,在新《藥品管理法》規定國家建立職業化、專業化藥品檢查員隊伍,國務院辦公廳相應的發布了《關于建立職業化專業化藥品檢查員隊伍的意見》(國辦發〔2019〕36號),對檢查員隊伍建設工作做了初步規劃和設想。當下,山東、吉林、江西等部分省市推進該項工作,建立了首批專業化為主,兼職化為輔的檢查員隊伍。
但在實際執行過程中,大部分省市通過遴選方式,從市縣級檢查員隊伍中遴選,通過該方式最快的將建立的隊伍投入到檢查工作中。在實際執行過程中往往有背離設計初衷的可能,部分能力不足、即將退休、有背景的市縣級檢查員或領導通過該方式直接晉級到省級單位,但無法有效完成專業化檢查員檢查任務,在監管過程中無法有效識別企業存在的風險,留下監管隱患。因此。建議各級專業化檢查員隊伍的建設,都要有嚴格的準入審查機制,同時上級監管部門對下級監管部門進行嚴格的監督考核,隨機抽取隊伍中的檢查員參與考核檢查,對不符合要求的嚴格實行淘汰機制,建立一支真正實干且有水平的專業化檢查員隊伍。
藥品流通環節是保障藥品質量安全可靠的重要環節之一,科學合理的監管方式、完善完備的監管法規制度及監管隊伍是保障藥品流通環節不出問題的重要支撐。基于此,本文從以上幾方面,提出目前監管形勢存在的漏洞,并相應的提出合理化建議,希望能為當下的藥品流通監管提出參考。

