曼氏裂頭蚴糖原磷酸化酶的生物學特性分析及功能域克隆、表達
譚欽月,王清吟,符瑞佳,周曉君,劉亞妹,王妹妹,林于金,呂 剛,梁 培
曼氏迭宮絳蟲(Spirometramansoni, Sm)成蟲通常寄生于貓、狗和人體的小腸中,一般不引起明顯的癥狀,但當S.mansoni中期裂頭蚴感染人體時,則可引起嚴重的裂頭蚴病[1]。裂頭蚴病是一種因感染曼氏迭宮絳蟲的幼蟲——裂頭蚴(Sparganum)而導致的寄生蟲病,呈全球分布,但在亞洲感染病例報道相對較多[2-3]。而在我國,該病主要在南方地區(海南、廣東、廣西、湖南等)分布,但近年來中部地區也有不少的病例報道[4]。在我國目前已經有1 600多例病例,分別來自27個省、市、自治區[5],并且報道病例呈逐年上升趨勢。人體感染裂頭蚴的主要途徑是通過食用半生的含裂頭蚴感染的青蛙肉、蛇肉或飲用含有原尾蚴的生水[6]而感染。
糖原作為大多數生物的主要能量儲存形式,是由葡萄糖殘基構成的含許多分支的大分子多糖,其功能是儲存碳水化合物。糖原的降解和合成是通過糖原磷酸化酶(Glycogen phosphorylase,GP)與糖原合成酶活性的變化來實現的。而其中GP是糖原分解代謝中的關鍵酶,通過切斷α(1→4)連接將糖原分子上的葡萄糖分子移除,從而催化糖原的磷酸化反應, 在糖原分解過程中起到了限速酶的作用。GP 通過降解糖原不僅產生了葡萄糖小分子為生物體提供能量,同時也維持著細胞的滲透壓平衡[7]。有相關研究報道,剛地弓形蟲需要通過糖原磷酸化酶進行支配淀粉的儲存,并導致腦囊腫[8]。在藍氏賈第鞭毛蟲研究中發現,糖原磷酸化酶可以通過調節糖原的儲存和降解從而在寄生蟲的生長和分化過程中發揮重要作用[9]。有研究通過利用染料木黃酮對棘溝賴利絳蟲中糖原代謝中的糖原磷酸酶的抑制,能夠明顯的抑制寄生蟲對葡萄糖的利用,從而達到影響寄生蟲的生存[10]。曼氏迭宮絳蟲的裂頭蚴寄生于第二中間宿主(青蛙、蛇)的肌肉部位,肌肉中主要的營養成分是糖原,那么幼蟲在生長發育過程中所需要的營養來源則是通過對糖原分解來獲取能量,為此糖原磷酸化酶對于裂頭蚴而言應是極其重要的。而在曼氏裂頭蚴迭宮絳蟲關于糖原磷酸化酶的研究尚屬空白,為此本研究從曼氏裂頭蚴中提取cDNA,從成蟲文庫中調取SmGP的全長序列進行生物信息學分析,并對功能域片段(fSmGP)克隆和蛋白的原核表達。
1 材料與方法
1.1 材 料
1.1.1實驗材料 由海南醫學院呂剛教授團隊提供曼氏迭宮絳蟲成蟲的全長核苷酸序列。從天根生化科技有限公司購得大腸埃希菌DH5α和BL21;全長5 369 bp、兩端含His標簽以及含有卡那霉素抗性的原核表達質粒載體pET-28α(+)由中山大學寄生蟲學教研室贈送。
1.1.2主要試劑 酵母提取物、胰蛋白胨和Trise-Base購自英國OXOID公司;T4-DNA ligase、限制性內切酶BamH I與HindIII、預染蛋白Marker購自美國Thermo公司;蛋白誘導劑異丙基-β-D-硫代半乳糖苷(IPTG)購自Sigma公司;Taq DNA聚合酶購自大連寶生物工程有限公司;質粒小提試劑盒、瓊脂糖凝膠DNA純化試劑盒購自天根生化科技有限公司;脫脂奶粉等化學試劑購于北京Solarbio公司。
1.2 方 法
1.2.1SmGP的生物學信息學分析 從基因組文庫中調取SmGP的全長序列,利用ORF Finder確定該基因的開放閱讀框。通過NCBI網站(https://www.ncbi.nlm.nih.gov/)的BLASTx程序,將編碼的氨基酸序列與其他物種的氨基酸序列進行比對;通過蛋白分析系統Expasy(www.expasy.org/),分析SmGP蛋白的物理化學性質、磷酸化位點預測、二級結構預測;通過SWISS-MODEL軟件進行SmGP的三維建模,B、T細胞表位位點預測。
1.2.2引物設計與合成 通過B、T細胞表位分析軟件(http://tools.immuneepitope.org/tools)預測SmGP序列中潛在的B、T細胞表位位點,以此來明確fSmGP;并由此來設計引物,由生工生物工程有限公司合成引物,上游引物:5′-GGGATCCATGACTCTTGGTTTGGCTGCCTAT- 3′(下劃線為BamH I酶切位點);下游引物:5′-GAAGCTTGAGGTAGGCCATGTTGACACG- 3′ (下劃線為HindIII酶切位點)。
1.2.3基因的克隆 以曼氏迭宮絳蟲裂頭蚴的cDNA為模板,反應條件:94 ℃預變性5 min:94 ℃變性45 s,57 ℃退火50 s,72 ℃延伸60 s,共35個循環;72 ℃再延伸10 min;進行PCR擴增。擴增得到的產物在1%的瓊脂糖凝膠電泳下鑒定,并進行DNA純化回收(按回收試劑盒的說明)。利用限制性內切酶BamH I和HindIII對原核表達載體pET-28α(+)質粒和擴增產物分別進行雙酶切,用DNA試劑盒純化得到純化產物,在T4連接酶作用下進行連接,連接產物轉化入E.coilDH5α感受細胞,鋪板培養。次日挑選陽性克隆,進行質粒提取和雙酶切鑒定。將pET-28α-fSmGP質粒轉化到表達菌株BL21(DE3),培養后的菌液送生工生物工程股份有限公司測序。
1.2.4重組蛋白的表達 重組質粒菌液(pET-28α-fSmGP)和空質粒pET-28α(+)熱菌分別加入到含0.1%的卡那霉素的LB液體培養基中,37 ℃ 250 r/min,搖菌5 h;加入IPTG(終濃度1 mmol/L)繼續以37 ℃ 250 r/min搖菌3 h和5 h。將收集的菌液進行12% SDS-PAGE電泳分析。
1.2.5Western blot鑒定 蛋白表達菌液進行離心,收集沉淀進行蛋白樣本處理,進行12% SDS-PAGE電泳,然后于冰水混合物中在電壓100 V條件下電泳1 h,進行轉膜;在5%脫脂奶粉封閉4 ℃過夜;然后用PBS漂洗5次,每次5 min,再用1∶20 000稀釋的抗His單抗室溫孵育2 h;PBS漂洗后,室溫孵育HRP標記的小鼠二抗(1∶5 000稀釋,PBS),進行DAB顯色3~5 min,出現條帶后立即用去離子水終止反應。
2 結 果
2.1SmGP核酸序列SmGP最長的開放閱讀框為1 560 bp,共編碼519個氨基酸。根據NCBI數據庫分析,該蛋白屬于Glycosyltransferase-GTB-type超基因家族;并發現與SmGP基因編碼蛋白質序列同源性最高的是細粒棘球絳蟲(Echinococcusgranulosus,CDS19686.1)一致性為89.98%,與人GP(肌型)(Homosapiens,AAC18079.1)的氨基酸序列一致性為70.93%,與小鼠GP(肌型)(Musmusculus,AAG00588.1)的氨基酸序列一致性為71.15%。
2.2SmGP蛋白質理化性質SmGP理論分子量和等電點分別為59.80 kDa、6.95,由C、H、N、O、S 5種原子共同組成。該蛋白的半衰期,在哺乳動物網織紅細胞中、在酵母菌內中和在大腸埃希菌中分別為30 h、>20 h和>10 h。消光系數反應了蛋白在特定波長下可吸收光或不可見光的能力可用于測蛋白濃度,該序列在280 nm的波長下,當二硫鍵全部打開時為1.896,當二硫鍵全部結合時為1.885。該蛋白GRAVY值為-0.397,即此蛋白質呈現親水性。
2.3SmGP的磷酸化位點 NetPhos分析顯示,該序列有潛在的磷酸化位點42個,但高于閾值(0.05)的只有32個位點,故預測該序列具有可行性的磷酸化位點應處于32個,包含19個絲氨酸(Ser)磷酸化位點、8個蘇氨酸(Thr)磷酸化位點、5個酪氨酸(Tyr)磷酸化位點,磷酸化位點在N-端、中間區域和C-端都含有,且主要聚集在250~500氨基酸之間,如圖1所示。

圖1 SmGP的磷酸化位點預測Fig.1 Phosphorylation site prediction for SmGP
2.4SmGP的二級結構 Secondary Structure分析顯示,SmGP二級結構以α螺旋(47.98%)為主,β折疊為16.57%,無規則卷曲則占有35.45%。
2.5SmGP的三維空間結構SmGP蛋白的三維空間結構表明GP為完全對稱的二聚體形式存在生物體內,其中以白鏈顯示為蛋白的A鏈,藍鏈顯示的為蛋白的B鏈,以紅色顯示的是蛋白的起始位點,且起始點位置均暴露于空間外側,同時模型顯示SmGP有6個功能結合位點,葡萄糖結合位點(粉色和紫色)、AMP結合位點(橙色和藍色)、磷酸吡哆醛結合位點(黃色和灰色)如圖2所示。

圖2 SmGP的三維空間結構Fig.2 Three dimensional structure of SmGP
2.6SmGP的B、T細胞表位位點 通過B細胞表位分析軟件顯示,SmGP可能存在10個潛在的B細胞位點,如表1所示。通過NetCTL顯示,該蛋白可能存在15個潛在的T細胞位點,在氨基酸序列100~400區域最為密集,如表2所示。結合B、T細胞的表位特點,選取氨基酸序列段在100~400區間的功能區域,進行特異性引物設計,為進一步對SmGP的研究奠定基礎。

表1 SmGP的B細胞表位Tab.1 B cell epitopes of SmGP
表2 SmGP的T細胞表位Tab.2 T cell epitopes of SmGP
2.7重組pET-28α-fGP質粒雙酶切鑒定 利用特異性引物,運用PCR技術從曼氏裂頭蚴的cDNA模板中擴增出GP基因的功能域片段,經1%瓊脂糖凝膠電泳檢測在800 bp附近有特異條帶,分子大小與理論值876 bp相一致。將PCR擴增產物進行測序分析,通過NCBI網站BLASTx程序,將PCR擴增得到的fSmGP氨基酸序列與GenBank中的核苷酸和氨基酸序列進行比對分析,該蛋白屬于Glycosyltransferase-GTB-type超基因家族,說明fSmGP擴增成功。由HindIIII和BamHI雙酶后的重組質粒,分別獲得的基因片段在800 bp和5 000 bp附近,與fSmGP的理論值876 bp和pET-28α(+)空載的理論值5 369 bp相一致,如圖3。測序結果表明插入序列與fSmGP的基因序列一致,上述結果說明重組質粒構建成功。
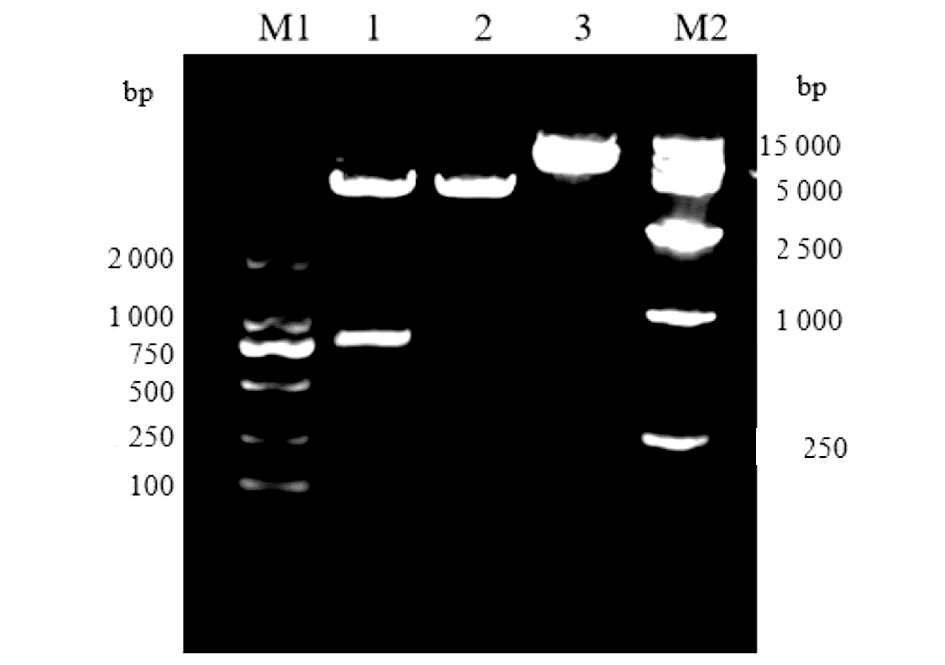
M1:DNA Marker DL2000;1:由BamH I和HindIII雙酶切后的重組質粒;2:pET-28α(+)空載質粒:3:重組質粒;M2:DNA Marker DL15000圖3 重組質粒雙酶切鑒定Fig.3 Identification of the recombinant plasmid for fSmGP expression by double enzyme digestion
2.8fSmGP蛋白的表達和鑒定 將重組質粒導入大腸桿菌BL21中,在37 ℃下分別誘導3 h、5 h,探索fSmGP蛋白表達的最佳條件。12%SDS-PAGE電泳結果顯示如圖4,在略大于35 kDa的位置上均出現特異的蛋白條帶,條帶的分子量大小與預測的fSmGP蛋白質分子38 kDa大小一致(因含有His標簽),且pET-28α(+)空載質粒誘導前后均無此蛋白,提示此蛋白可能為fSmGP。同時,在上述條件下,1號和2號的含有fSmGP重組質粒的大腸埃希菌在37 ℃ 5 h誘導條件下最佳。Western blot結果顯示如圖5,重組蛋白能被His單克隆抗體識別,識別得到條帶均在34~43 kDa之間,與預測分子量38 kDa相符合,結果表明成功誘導獲得fSmGP蛋白。
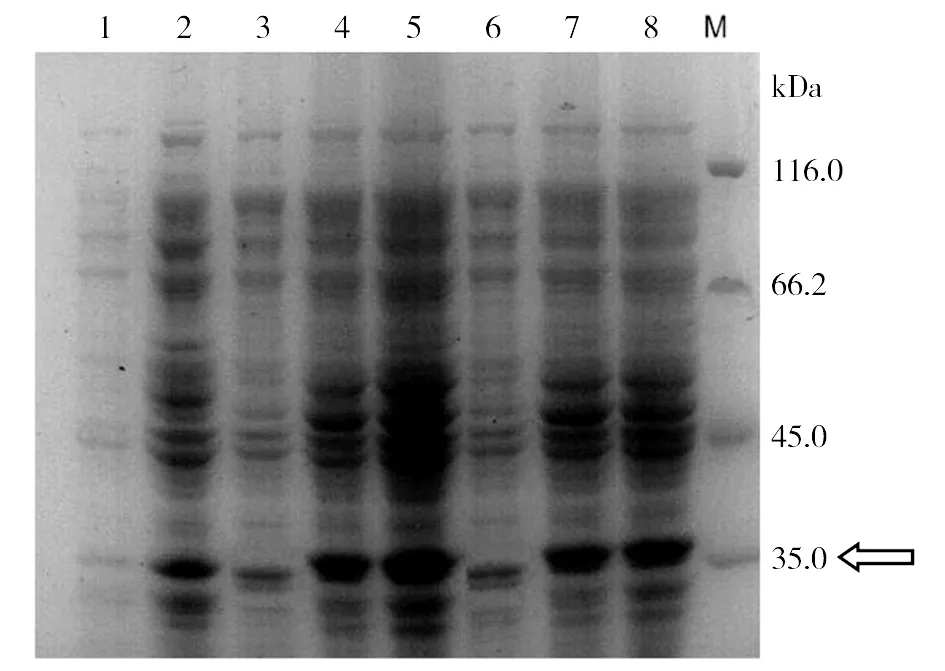
M:Protein Marker;1:未經誘導的大腸埃希菌pET-28α(+)載體;2:經IPTG誘導的大腸埃希菌pET-28α(+)載體;3:1號重組質粒大腸桿菌未誘導;4:1號重組質粒大腸桿菌經37 ℃誘導3 h;5:1號重組質粒大腸桿菌經37 ℃下誘導5 h;6:2號重組質粒大腸桿菌未誘導;7:2號重組質粒大腸桿菌經37 ℃誘導3 h;8:2號重組質粒大腸桿菌經37 ℃下誘導5 h;圖4 重組pET-28α-fSmGP融合蛋白的表達Fig.4 Expression of recombinant pET-28α-fSmGP protein
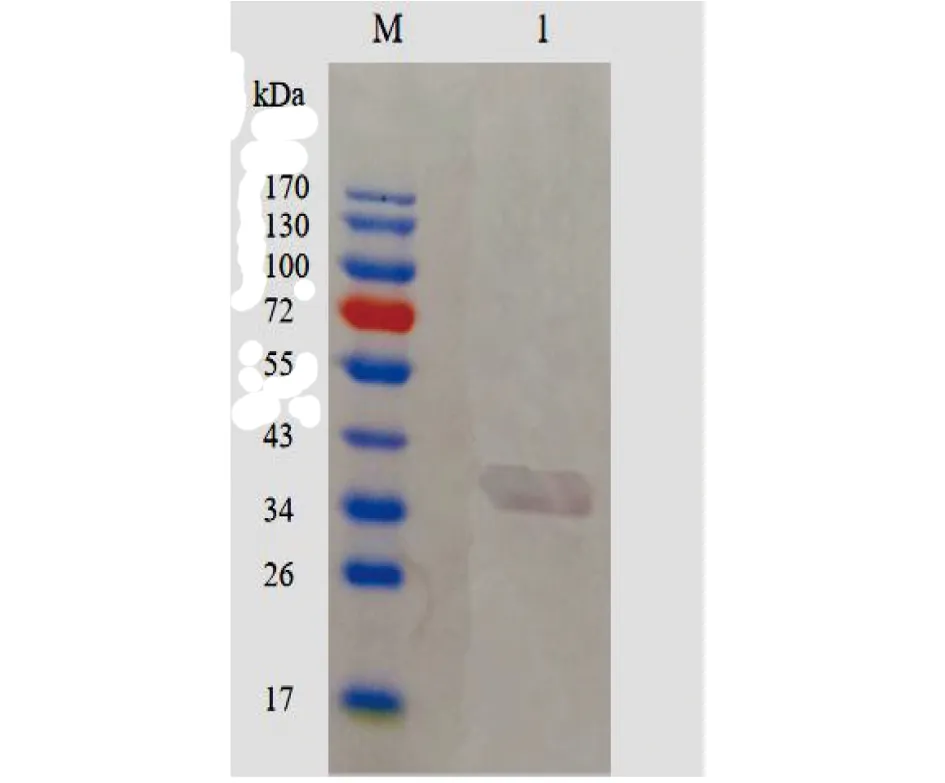
M:Protein Marker;1:重組蛋白與His單克隆抗體反應條帶圖5 fSmGP的western blot鑒定Fig.5 Identification of fSmGP by western blotting
3 討 論
本文進行SmGP蛋白理化性質分析,可得知其在體外有較好的穩定和具有較好的親水性,二級結構主要以α螺旋為主。有研究發現在生物體內,GP常以GPa和GPb兩種形式存在,分別呈活化狀態(R狀態)和鈍化狀態(T狀態),而GP的失活和活化的轉化,在GP的共價修飾調節中:其主要是取決于磷酸化作用和去磷酸化作用的速率,GP的Ser殘基可被磷酸化修飾,使無活性狀態轉變成有活性狀態;在本文的生物信息學分析中發現,該蛋白以二聚體的形式存在并且氨基酸序列中含有19個潛在的Ser磷酸化位點和SmGP分子中存在2個AMP結合位點。在GP的別構調節中,AMP是別構活化劑,通過改變其構象,促使其由T形式轉變為R形式[11-13]。由此可推測SmGP的活性調節位點為Ser磷酸化位點和AMP結合位點。在空間建模圖中顯示,分子中的6個結合位點均分布在整個分子表面,這有利于分子發揮活性功能作用。
SmGP屬于Glycosyltransferase-GTB-type超基因家族,與其他絳蟲、人類氨基酸序列的同源性較高,因此,該蛋白全長序列在作為診斷分子和疫苗開發方面均沒有太大的價值。全長序列中,B細胞表位和T細胞表位較為集中的分布在于100~400氨基酸的區域。為此,本實驗選取了基因序列同源性較低且B、T細胞較為密集的區域,同時也是磷酸化位點較為集中的區域進行基因克隆和蛋白表達。
曼氏裂頭蚴主要寄生于青蛙或蛇的肌肉部位,也可寄生于人體的皮下組織、眼部、腦部等,均是葡萄糖含量較低而糖原主要分布的組織部位。此外,在本實驗室其他課題組檢測分析感染裂頭蚴的青蛙組織和正常青蛙組織中,發現糖原含量存在顯著性差異,SmGP作為糖原分解的關鍵酶,那么其在裂頭蚴的營養攝取和能量代謝方面肯定發揮了不可或缺的作用。目前臨床中用于抗寄生蟲的藥物主要的作用機理是阻斷寄生蟲的能量來源,為此,SmGP可能是一個有潛在研究價值的藥物靶點。本研究成功表達SmGP蛋白,為深入了解其結構、功能及其在蟲體生長發育過程中參與糖代謝的規律等研究奠定了基礎。
利益沖突:無

