肺炎衣原體與中樞神經系統疾病相關性研究進展
袁 帥,吳移謀
肺炎衣原體(Chlamydiapneumoniae,Cpn)是一類具有獨特的雙相發育周期的專性胞內寄生菌,在功能和形態上存在多種不同的形式。在細胞外,衣原體以具有感染性的原體(Elementary body,EB)的形式存在;當EB侵入宿主細胞后,EB分化為具有繁殖性的網狀體(Reticulate body,RB);隨后,RB通過二分裂進行復制并生成子代EB,后者通過裂解和擠出的方式離開宿主細胞感染鄰近細胞[1]。Cpn是常見的呼吸道病原體,其感染可導致血管內皮損傷、交界性改變以及血腦屏障破壞等,因此常參與中樞神經系統(Central nervous system,CNS)疾病的發生、發展。有研究報道其與動脈粥樣硬化、冠狀動脈疾病和神經炎癥相關[2-3]。本文將就近年來Cpn與CNS疾病的相關性研究進展進行綜述。
1 Cpn感染導致CNS疾病的可能機制
Cpn能夠感染包括巨噬細胞、單核細胞、淋巴細胞、平滑肌細胞和內皮細胞在內的多種細胞。由于這些細胞類型分布廣泛,由感染引起的疾病在許多器官系統中都有可能發生。因此,經上呼吸道感染后,Cpn可引起全身性傳播。在應激條件下,Cpn以不再復制、增殖的異形體(Abnormal body,AB)形式長期存在于宿主細胞內,當所處環境有利于其自身活躍增殖時,它可以轉換為RB重新進入循環發育周期[4]。Cpn可抑制宿主細胞凋亡以逃避CD4+和CD8+免疫識別,并通過上述機制逃避免疫系統的監視,在宿主體內進入隱蔽而靜止的感染狀態[5]。這種宿主不能完全消除病原體所致的慢性持續性感染是Cpn致病的重要因素。Cpn感染后可通過改變連接復合物蛋白從而改變血腦屏障的通透性,并促進單核細胞通過人腦血管內皮細胞的遷移,受Cpn感染的遷移巨噬細胞進入CNS后可響應由感染觸發以及自身免疫過程引起的炎癥,進一步促進CNS內炎癥的發生發展[3,6]。
在通過血腦屏障并進入CNS后,Cpn可進入慢性持續性感染狀態,對炎癥及自身免疫反應產生慢性而持久的影響。在其他病因誘發的疾病病程中,進入持續性感染狀態的Cpn也可因為免疫力的降低、疾病造成的病理改變或炎癥發生等因素重新活躍,推動炎癥及自身免疫的發展,繼而影響疾病的進程。因此,過去的研究中,感染性因素被認為是多發性硬化(Multiple sclerosis,MS)、阿爾茲海默病(Alzheimer’s disease,AD)等慢性CNS疾病可能的重要病因,Cpn作為潛在病原體被密切關注。
2 Cpn與多發性硬化
MS是一種異質性自身免疫性疾病,以炎癥、脫髓鞘和軸突變性為特征,同時影響灰質和白質,是較為常見的CNS脫髓鞘疾病。MS具有復雜的病理生理,是遺傳和環境因素之間多重且尚不清楚的相互作用的結果[7]。在過去的20年,研究人員一直在探索感染在MS中的作用,并對患者進行了各種病毒和細菌感染的檢查,發現有許多慢性感染和MS之間存在聯系[8]。新的假說認為,MS的發生可能是由于感染性因子表達的抗原分子模擬CNS細胞表面的糖蛋白和脂多糖,這種分子模擬可能導致自身反應性淋巴細胞的激活,從而誘導CNS的炎癥[9]。許多研究建立起了Cpn與MS之間的可能存在的相關性,并為MS發病機制中感染性因子的影響提供了重要證據(表1)。
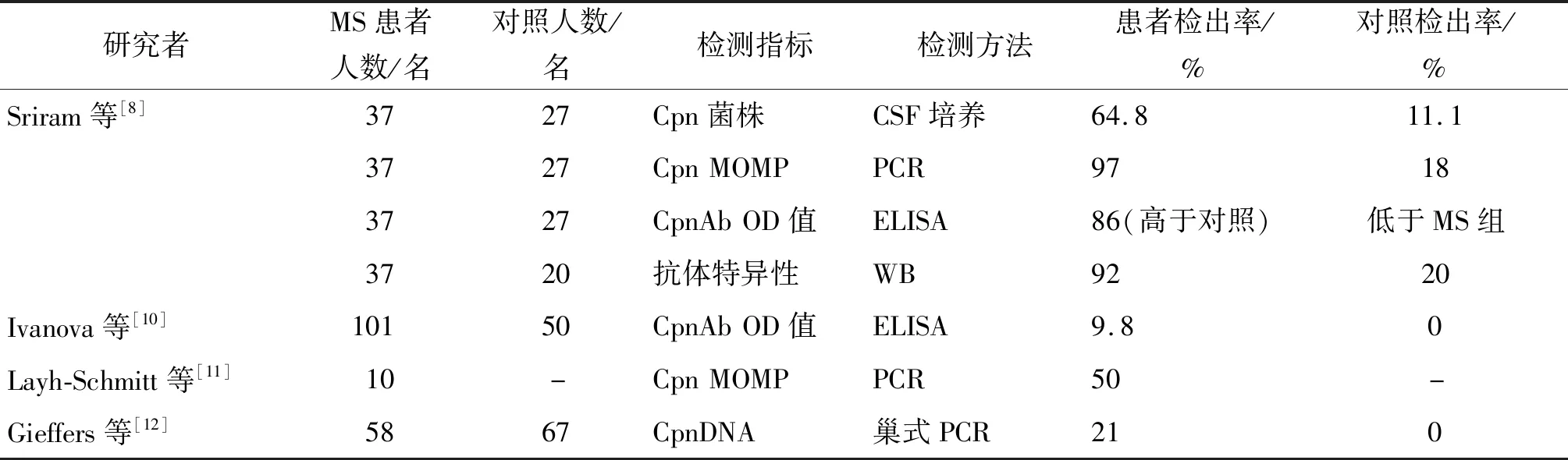
表1 Cpn與MS的相關性研究進展Tab.1 Research progress in correlation of Chlamydia pneumoniae with multiple sclerosis
值得注意的是,不同研究小組關于MS患者衣原體檢測水平的報告存在著極大差異。一項針對85名MS患者和50名對照組受試者的研究證實,對照組和MS組患者的Cpn IgG或IgM均無相關性[13]。另一項研究對MS患者腦脊液進行巢式PCR檢測,MS患者、其他炎癥性神經疾病和非炎癥性神經疾病患者的Cpn檢出率差異無統計學意義[14]。Lindsay等分別檢測了復發-緩解型MS、原發性進展型MS、橫貫性脊髓炎和正常對照者的腦脊液中包括Cpn在內的7種病原體相關DNA,結果均未檢出[15]。這種研究結果的差異可能是由于這些研究均為橫斷面設計,涉及的樣本量小,且未將Cpn檢測與MS的病程有機偶聯起來,不能正確評估感染或感染引起的免疫反應是否在MS癥狀出現之前[16],這提示今后的研究中應區分病程進行相關的大數據研究[17]。
Cpn的一個重要作用是增加Th2的激活,在實驗性過敏性腦炎(一種以Th1和Th2通路激活為特征的MS模型)中,Cpn的存在可加重破壞性的炎癥過程[18]。在評估利福平和阿奇霉素治療Cpn效果的多項臨床試驗中,MS患者在核磁共振釓增強病變、復發率和疾病嚴重程度方面沒有顯示出任何有益的結果;但與接受抗生素治療的患者相比,使用安慰劑的對照組顯示腦實質體積顯著減小,這是全腦萎縮的標志[19]。這些數據表明,Cpn感染不會直接啟動自身免疫過程,而是加重了炎癥或加速了自身免疫狀況的改變從而對疾病的發展產生影響。
3 Cpn與阿爾茲海默病
AD是一種慢性進行性神經退行性疾病,臨床表現是進行性認知功能障礙和行為損害,被認為是導致癡呆癥的最常見原因,目前病因尚不明確。目前的研究表明AD發病有三個主要因素:神經炎癥過程、氧化應激和血管因素[20]。許多假說表明累積感染與AD有關,從而將神經炎癥和感染性病原體在AD病因中的作用聯系起來[21]。Cpn和AD之間的相關性在Balin等的研究中被首次提及,該研究在90%的散發性AD患者的大腦中檢測到Cpn特異性DNA,而對照組均未檢出[22]。此后Gérard等從AD患者的腦組織勻漿中培養出了具有代謝活性的Cpn,免疫組織化學分析表明星形膠質細胞、小膠質細胞和神經元均是AD腦內Cpn的宿主細胞[23]。感染細胞與AD腦組織主要的兩個病理特征:神經炎性淀粉樣斑塊和神經原纖維纏結密切相關。神經炎性淀粉樣斑塊的主要成分是淀粉樣β蛋白(Amyloid-β,Aβ),最新的研究認為Aβ引起的神經毒性啟動了相關的病理過程[24]。Cpn和其他感染的流行病學評估表明,感染與AD之間存在相關性[23, 25-26]。其中一項研究從通過鼻腔接種感染Cpn的BALB/c小鼠腦中分離出了Cpn,并發現了與Cpn感染相關的Aβ沉積發生在典型的AD患者受影響的大腦區域,如海馬、齒狀回和杏仁核。這些沉積斑塊被反應性星形膠質細胞包圍,有時還包圍腦血管,這些與AD相似的病理變化進一步證明了Cpn和AD之間存在相關性[25]。病理性Aβ的沉積增加導致巨噬細胞、小膠質細胞、淋巴細胞和星形膠質細胞的激活,并導致了各種炎癥介質的釋放。淀粉樣斑塊形成所致的腦部炎癥將釋放過多的活性氧,這進一步促進了AD的發展[27]。雖然Aβ產生過多的原因尚不清楚,但CNS的炎癥被認為在AD的病理生理學中起著重要作用[28]。
在Balin等關于AD患者腦組織的神經元、小膠質細胞和星形膠質細胞中鑒定出Cpn的研究發表之后,許多研究小組探究了星形膠質細胞作為Cpn宿主的作用[22,24]。Zein等[24]研究表明Cpn感染星形膠質細胞后,微管相關蛋白tau和微管相關蛋白-2的mRNA水平降低,而磷酸化tau的糖原合成酶激酶3-β(Glycogen synthase kinase 3-β,Gsk3β)的mRNA水平升高。tau蛋白的減少將破壞宿主微管的穩定,淀粉樣斑塊的形成也可導致tau蛋白磷酸化表達上調,從而降低tau蛋白與微管的穩定結合,破壞微管結構[28-29]。Cpn感染的星形膠質細胞中Gsk3β活性的增加可能促進由過度磷酸化的tau蛋白組成的神經原纖維纏結形成,從而促進AD病理發生。這提示Cpn誘導的星形膠質細胞激活tau蛋白的表達和功能失調,促進了淀粉樣斑塊的形成,繼而引起神經炎癥,最終以神經元死亡導致慢性的、不可逆的損傷,從而形成類似于AD患者的病理變化[24]。
盡管許多研究表明Cpn感染與AD相關,但Cpn引起腦炎的流行病學研究和Cpn參與多種CNS疾病的調查結果都否認Cpn作為引起AD的單一病原體[30], Cpn可能扮演著在實驗性過敏性腦炎模型中類似加重炎癥從而影響疾病的進程的重要角色[18]。
4 Cpn與腦血管疾病
動脈粥樣硬化(Atherosclerosis, AS)性血管疾病是具有多年慢性進展性的一組疾病,也可引起急性臨床事件。AS發生在腦部血管時可引起顱內血液循環障礙而造成腦組織損害,可導致的疾病包括臨床常見的腦卒中。最初AS被認為是簡單的脂質堆積損害,有新的研究報道AS是一種慢性炎癥性疾病,這表明慢性感染在AS的發展中起著關鍵作用[31]。已有研究小組在外周血單核細胞、動脈粥樣硬化性心血管組織、腦和其他器官AS病變中分離到高水平的Cpn DNA,證實Cpn與AS之間密切相關,而AS是缺血性腦卒中最常見的危險因素[32-33]。有研究發現急性缺血性腦卒中患者的Cpn IgA、IgG較對照組明顯升高[34],SU等的一項Meta分析也得到類似的結果,Cpn感染與腦梗死風險的增加顯著相關,這進一步說明了Cpn在腦卒中發病機制中可能存在重要作用[32]。AS性血管疾病的形成包括內皮細胞損傷、單核細胞聚集、脂質堆積、斑塊形成、斑塊破裂或侵蝕以及血栓形成等一系列階段,已有證實Cpn在最初感染時進入腦血管系統,直接或間接地加重AS[35]。Cpn脂多糖(Chlamydiapneumoniaelipopolysaccharide,cLPS)和熱休克蛋白-60 (Chlamydiapneumoniaeheat shock protein 60,cHSP60)是兩種與AS形成相關的毒力因子。cLPS能夠通過TLR-4刺激NF-κB和p44/p42MAPK通路觸發關鍵的炎癥反應,從而促進泡沫細胞的形成[36]。慢性持續性Cpn感染可以引起cHSP60大量分泌,在血管內,cHSP60觸發并增強固有免疫和炎癥反應,導致AS的形成[37]。cHSP60和人熱休克蛋白-60(Human heat shock protein 60,hHSP-60)有高度同源性,hHSP-60可誘發低密度脂蛋白的氧化,刺激人外周血單核細胞和單核細胞來源的巨噬細胞,促使其產生促炎細胞因子,如IL-1、IL-6和TNF-β,基質金屬蛋白酶(Matrix metalloproteinase,MMPs)以及人內皮細胞分泌粘附分子[38]。Cpn也可通過TLRs誘導AS,可導致血管細胞功能障礙、巨噬細胞和其他免疫細胞在血管損傷部位的募集、泡沫細胞的形成和斑塊的不穩定[39]。在AS的晚期,促炎細胞因子和MMPs可降解細胞外基質蛋白,使斑塊容易破裂。此外,Cpn通過TLR2/4依賴途徑誘導產生的血管內皮生長因子可以促進斑塊中新生微血管的形成,引發微血管源性斑塊內出血,最終導致心肌梗死或腦卒中[40]。有證據表明,膽固醇從外周組織到肝臟的運輸受到Cpn感染的巨噬細胞的調節。這些巨噬細胞能夠抑制膽固醇外流,導致膽固醇在外周積聚。此外,這些受感染的巨噬細胞可以吞噬和破壞特定的脂蛋白,導致巨噬細胞內脂質堆積,形成泡沫細胞,這是典型的AS病變[41]。有許多的研究證實了Cpn與AS以及與之相關的腦卒中之間的密切相關性,但抗感染的臨床研究并未取得令人滿意的效果,也尚未找到直接相關的致病機制與靶點[39]。感染所引起的炎癥反應似乎通過誘導AS進展、血栓前激活和房顫等機制在卒中的發病機制中起關鍵作用[42]。似乎不只是單一的感染,而是來自多個因素的感染后果影響了卒中的發病[43]。Cpn等病原體感染與腦血管疾病之間的直接作用、交叉反應、具體致病機制和分子基礎仍需深入研究,這有希望為今后AS及相關腦卒中的預防以及臨床治療提供新的有效策略。
5 小 結
隨著Cpn研究的大量開展與不斷深入,關于其作為CNS疾病的可能病因與危險因素的認識日益加深,對其所引起的炎癥和免疫反應之間復雜的相互作用的認知水平也逐步提高。盡管具體致病機制和直接作用尚未明確,但Cpn感染和病因復雜的CNS疾病如阿爾茲海默病、多發性硬化和腦卒中之間存在的聯系是毋庸置疑的。在上述由多種因素影響而病因尚未明確的慢性CNS疾病中,盡管Cpn可能不是疾病的直接病因,但通過加重炎癥過程或誘發及加重免疫反應從而在病程發展中發揮了重要作用。但關于如何進一步明確Cpn感染與CNS疾病之間的關系與作用機制,還有待進一步的深入研究,這對今后CNS疾病在感染方面的預防、治療和預后提供更多可供參考的信息。
利益沖突:無

