通關藤苷G通過ATM-CHK2-p53信號通路抑制結直腸癌細胞增殖
王愷純,徐勤芬,劉 微,胡道德*
1上海交通大學附屬第一人民醫院臨床藥學科;2南京醫科大學附屬上海一院臨床醫學院臨床藥學科,上海200080
結直腸癌(colorectal cancer,CRC)作為常見的惡性腫瘤之一,其發病率位居全球第三,死亡率位居全球第二[1]。雖然診斷與治療的進步延長了部分患者的生命,但是,患者5年生存率仍只有64%[2],這一數據與10年前相比無明顯變化。目前,結直腸癌的主要治療手段為手術結合放化療,其嚴重的副作用使患者生活質量明顯下降。近年來,相關研究發現,天然藥物在抑制結直腸癌增殖、減輕放化療毒副作用方面具有一定優勢,是結直腸癌治療的重要手段之一[3,4]。
通關藤藥材(Marsdeniatenacissima(Roxb.) Wight et Arn)是蘿藦科植物通關藤的藤莖,主要產自云南、貴州等省份。研究發現,通關藤藥理作用較為廣泛,具有抗癌、平喘、免疫調節、降壓、止痛、利尿以及緩解放化療導致的腫瘤患者白細胞下降等作用[5]。此外,臨床上亦將其用于治療胃癌、肺癌、肝癌、白血病等多種腫瘤,療效較為顯著。有研究證明,通關藤總皂苷具有抗肝癌細胞增殖作用[6],是其主要抗癌活性成分。通關藤苷G(tenacissoside G,TG)化學結構式如圖1所示,是通關藤總皂苷中成分之一。有研究報道,TG可能為通關藤中治療非小細胞肺癌的主要活性成分,通過PI3K/Akt等多條信號通路發揮抗肺癌作用[7]。但目前關于TG抗結直腸癌的作用和機制尚未見報道。本實驗以人結直腸癌細胞RKO和LoVo為研究對象,觀察TG對結直腸癌細胞增殖活性的影響,并對其可能的作用機制進行探究。
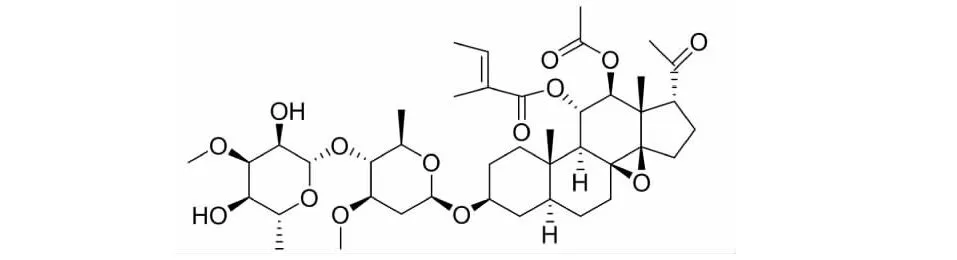
圖1 通關藤苷G的化學結構式
1 材料與儀器
1.1 試驗藥物
通關藤苷G(純度 ≥ 98%,批號HT177497),購自寶雞市辰光生物科技有限公司。
1.2 試劑與儀器
DMEM高糖培養基、F12k培養基、胰蛋白酶、青霉素-鏈霉素溶液、胎牛血清(Gibco公司);CCK-8試劑(MCE公司);細胞裂解液、BCA蛋白定量試劑盒、上樣緩沖液(蘇州新賽美公司);細胞周期檢測試劑盒(美國BD公司);CDK2、CDK4、CDK6、Cyclin D1、Cyclin E1、p21、cleaved Caspase 3、cleaved PARP、ATM、p-ATM、CHK2、p-CHK2、p53、p-p53、GAPDH抗體(美國CST公司);HRP-conjugated Affinipure Goat Anti-Mouse IgG(H+L)、HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)、CoraLite488-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)(Proteintech公司);AL104電子分析天平(梅特勒-托利多儀器有限公司);二氧化碳培養箱(SANYO公司);酶標儀(Bio-Tek公司);ECLIPSETi-5型熒光倒置顯微鏡(日本Nikon公司);BD Accuri C6流式細胞儀(美國BD公司);Tanon-5500型化學發光凝膠成像儀器(中國天能科技有限公司);Power PacTMBasic型電泳儀(美國Bio-Rad公司)。
2 實驗方法
2.1 細胞培養液的配制
將10%胎牛血清(V/V)、1%青霉素-鏈霉素雙抗溶液分別和DMEM高糖培養基或F12k培養基混勻,在4 ℃條件下儲存,備用。
2.2 細胞培養
人結直腸癌細胞RKO(貨號:TCHu116)和LoVo(貨號:TCHu 82)均購自中國科學院典型培養物保藏委員會細胞庫。復蘇RKO和LoVo細胞,置于細胞培養皿中,加入細胞培養液,置于37 ℃、5% CO2的細胞培養箱中培養。1~2天更換一次培養液。取對數生長期的細胞用于實驗,細胞融合度約90%時用胰蛋白酶消化傳代以用于后續實驗。
2.3 細胞增殖活性檢測
取對數生長期的RKO和LoVo細胞,用新鮮培養基重懸,調整細胞濃度為8×104個/mL,按每孔100 μL接種于96孔板,每孔設置6復孔。貼壁后,設置空白組(只加培養液)、對照組(不加藥組)、實驗組(TG濃度為25、50、100、200和400 μM),每孔均設6復孔,分別處理24 h和48 h,結束前吸去藥液,每孔加入10 μL CCK-8試劑和90 μL培養液。培養箱避光培養2 h,置酶標儀上450 nm波長處檢測吸光度A。細胞活性=(A實驗組-A空白組)/(A對照組-A空白組)×100%,實驗重復3次。
2.4 平板克隆檢測不同濃度通關藤苷G對細胞生長增殖的影響
取對數生長期的RKO和LoVo,調整細胞濃度為5×103個/mL,按每孔100 μL接種于6孔板。貼壁后,棄培養液,加入50 μM和100 μM TG,放入培養箱中繼續培養14天。取出6孔板,吸棄培養液,磷酸緩沖鹽溶液(phosphate buffer saline,PBS)潤洗3次,加入多聚甲醛室溫固定30 min后PBS洗3次,每孔加入1 mL結晶紫溶液,室溫染色30 min后PBS清洗3次至肉眼可見紫色細胞集落。記錄集落數,計算試驗組和對照組集落數比值。實驗重復3次。
2.5 流式細胞術檢測細胞周期
取對數生長期的RKO和LoVo,調整細胞濃度為1×106個/mL,按每孔1 mL接種于6孔板。貼壁后棄培養基,設置對照組(不加藥組)、實驗組(TG濃度為50、100和200 μM),繼續培養48 h,棄去藥液,胰酶消化,離心收集細胞,75%預冷的乙醇重懸,4 ℃放置過夜。PBS清洗兩遍,加入500 μL含RNase的碘化丙啶(propidium iodide,PI)染色液,4 ℃避光孵育30 min,過篩,上機檢測,記錄激發波長488 nm處紅色熒光。實驗重復3次。
2.6 彗星實驗檢測細胞DNA損傷程度
取對數生長期的RKO和LoVo,調整細胞濃度為1×106個/mL,按每孔1 mL接種于6孔板。貼壁后棄培養基,設置對照組(不加藥組)和實驗組(藥物組)。給藥后繼續培養48 h,棄去藥液,胰酶消化,離心收集細胞,PBS重懸。將低熔點瓊脂糖凝膠液化,加入稀釋后的細胞懸液,混合均勻后鋪在彗星載玻片透明孔上,保持水平,避光4 ℃放置15 min。將玻片置于裂解緩沖液中避光4 ℃放置30 min,吸去裂解液,PBS清洗后加入預冷的堿性電泳液避光4 ℃放置30 min,20 V,300 mA電泳30 min。將玻片轉移至干凈容器中,去離子H2O清洗3遍,預冷的70%乙醇固定5 min。室溫風干玻片,每個樣品加入100 μL稀釋好的Vista Green DNA染料,室溫孵育15 min。實驗重復3次。
2.7 免疫熒光檢測γ-H2AX水平變化
取對數生長期的RKO和LoVo,以每孔1×104個細胞接種于24孔板中。貼壁后棄培養基,設置對照組(不加藥組)和實驗組(藥物組)。給藥后繼續培養48 h。PBS清洗3遍,預冷的甲醇-20 ℃固定20 min。PBS清洗3遍后,加入0.1%的Triton X-100,室溫孵育15 min。PBS清洗3遍后,加入牛血清白蛋白(bovine serum albumin,BSA)室溫封閉1 h。吸棄BSA后,加入一抗,4 ℃孵育過夜。含吐溫的Tris-HCl緩沖鹽溶液(Tris buffered saline with Tween 20,TBST)清洗4遍后加入二抗,避光室溫孵育2 h。用TBST清洗4遍,再加入4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI),避光室溫孵育30 min。TBST清洗3遍,熒光倒置顯微鏡觀察并拍照。實驗重復3次。
2.8 Western blot檢測DNA損傷及凋亡相關蛋白表達水平變化
取對數生長期的RKO和LoVo,調整細胞濃度為1×106個/mL,按每孔1 mL接種于6孔板。貼壁后棄培養基,設置對照組(不加藥組)和實驗組(藥物組)。給藥后培養48 h。棄培養液,PBS洗3遍,每孔加入200 μL含苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)和磷酸酶抑制劑的RIPA細胞裂解液,冰上裂解30 min,收集至1.5 mL離心管中,離心(4 ℃,15 000 g,10 min)取上清。用BCA比色測定法對細胞裂解液中蛋白含量進行定量后,加入上樣緩沖液,100 ℃金屬浴中變性10 min。用10%~15%聚丙烯酰胺SDS凝膠電泳蛋白樣品,濕轉法轉至PVDF膜上,10%脫脂牛奶室溫封閉1 h。一抗4 ℃孵育過夜,TBST洗4次,每次10 min。二抗室溫孵育1 h,TBST洗4次,每次10 min。增強化學發光法(ECL)進行顯影,ImageJ對條帶進行灰度分析。實驗重復3次。
2.9 統計分析處理
3 結果
3.1 TG抑制結直腸癌細胞增殖
利用CCK-8法檢測TG對結直腸癌細胞株RKO和LoVo細胞生長抑制作用,結果如圖2所示。不同濃度TG分別作用細胞24、48和72 h后,RKO和LoVo細胞活性受到明顯抑制,且抑制效果呈時間和濃度依賴性。平板克隆實驗結果同樣證明TG對細胞的增殖抑制作用,見圖3。根據抑制率結果計算得到,TG作用于RKO細胞24、48、72 h的IC50分別為334.68 μM(24 h)、91.71 μM(48 h)和57.42 μM(72 h);作用于LoVo細胞24、48、72 h的IC50分別為257.72 μM(24 h)、88.34 μM(48 h)和63.69 μM(72 h)。
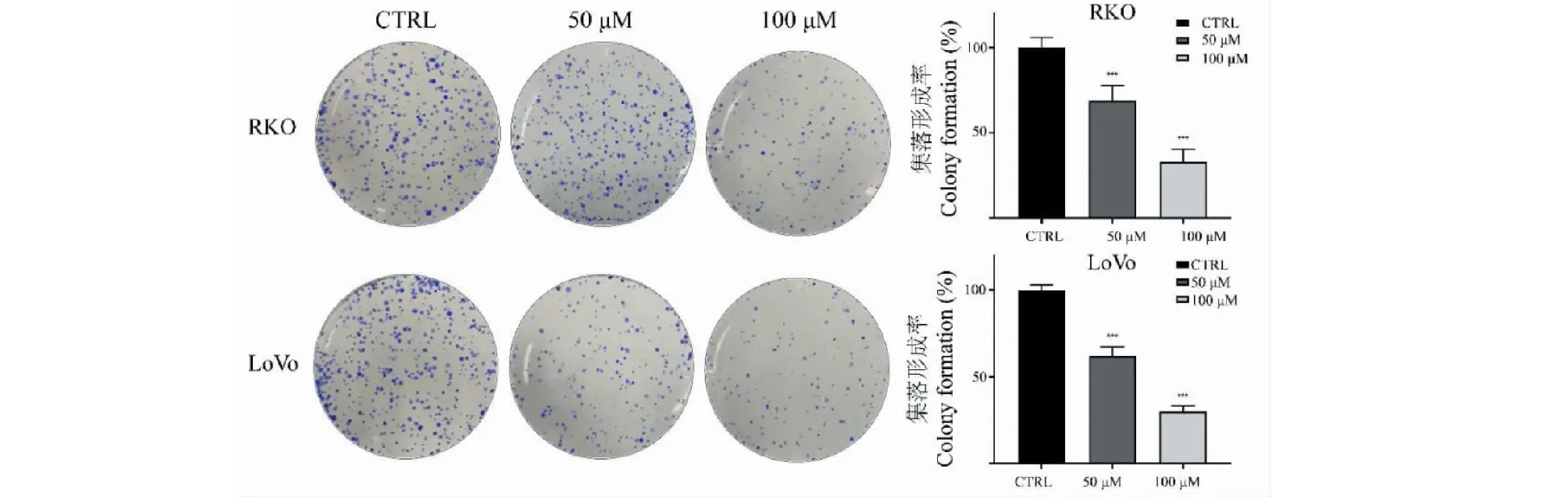
圖3 不同濃度TG對結直腸癌細胞集落形成的影響(n=3)
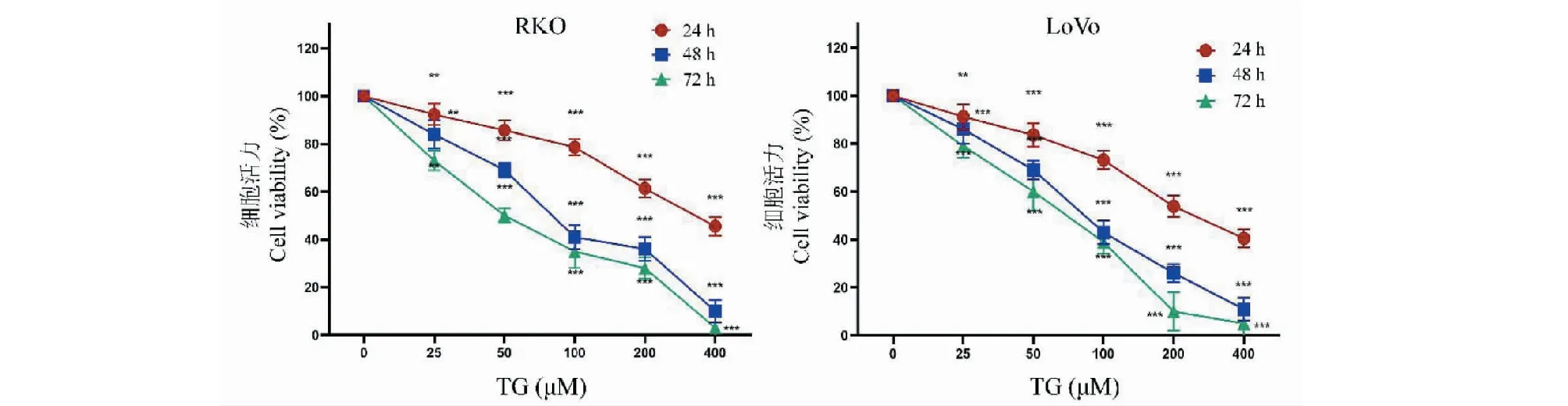
圖2 不同濃度TG對結直腸癌細胞增殖的影響(n=6)
3.2 TG對結直腸癌細胞周期的影響
將RKO和LoVo細胞進行藥物處理,設置TG濃度為50、100和200 μM,利用流式細胞術檢測細胞周期比例變化,結果見圖4和表1。與空白對照組相比較,給藥后RKO細胞G0/G1期細胞由39.01%增至79.89%,LoVo細胞G0/G1期細胞由40.19%增至81.71%,且呈濃度依賴性升高(P< 0.05)。S期細胞比例顯著遞減,而G2/M期細胞比例無明顯變化(P> 0.05)。上述結果提示TG可抑制細胞G1期向S期的轉化,誘導G0/G1期阻滯。
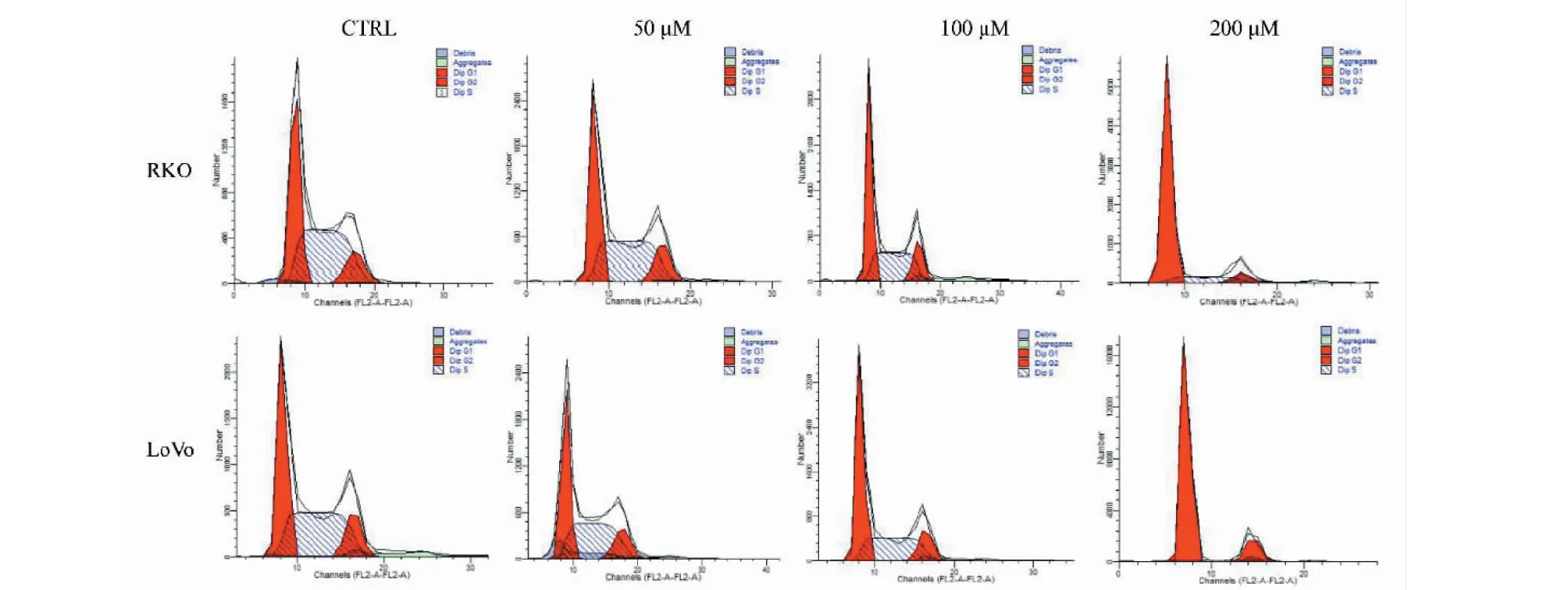
圖4 TG對結直腸癌細胞周期的影響
表1 各組人結直腸癌細胞RKO和LoVo周期比較
利用不同濃度TG處理結直腸癌細胞48 h后,Western blot實驗結果(圖5)顯示,與對照組相比,給藥后細胞內CDK2、CDK4和CDK6、Cyclin D1和Cyclin E蛋白表達水平均顯著下降且細胞周期抑制劑p21的表達水平明顯上升(P< 0.01)。表明TG可通過調控周期相關蛋白表達水平,誘導結直腸癌細胞G0/G1期阻滯作用。
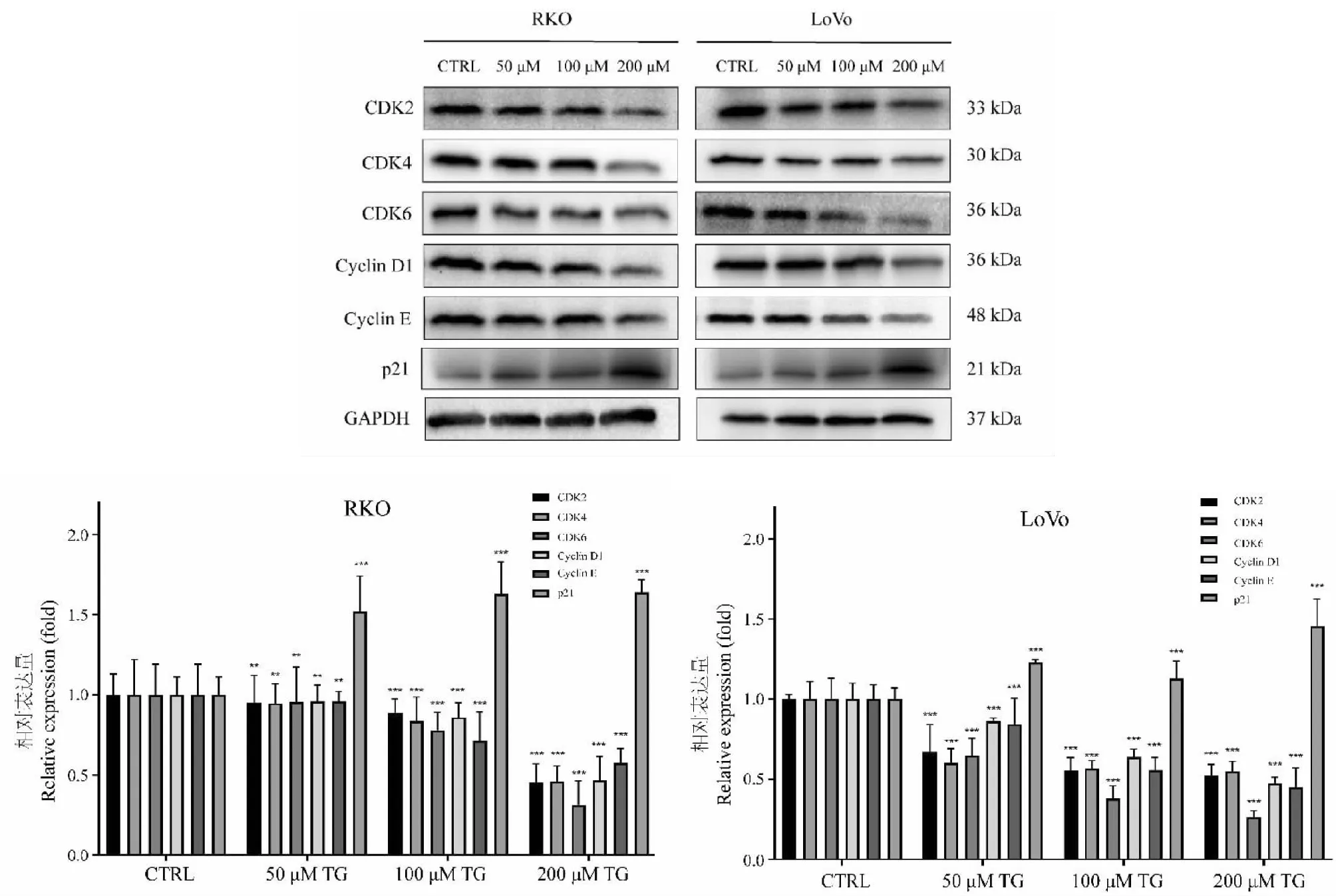
圖5 TG對結直腸癌細胞內周期相關蛋白表達水平的影響(n=3)
3.3 TG誘導結直腸癌細胞DNA損傷
堿性彗星實驗(圖6)顯示,TG可顯著誘導結直腸癌細胞DNA損傷。不同濃度(50、100和200 μM)TG處理48 h后,RKO和LoVo細胞的彗星拖尾顯著增加,且尾部DNA含量由低濃度組的45.76%(RKO)和43.82%(LoVo)上升至高濃度組的90.16%(RKO)和91.21%(LoVo)。與對照組0.01%(RKO)和0.00%(LoVo)的DNA含量相比顯著升高(P< 0.01),表明給藥后細胞DNA單、雙鏈斷裂明顯增多,DNA損傷水平顯著升高。
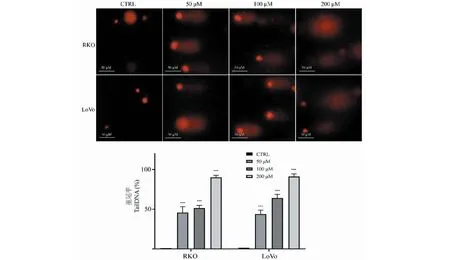
圖6 彗星實驗結果圖及TG對細胞tailDNA含量的影響(n=3)
3.4 TG促進DNA雙鏈斷裂標記蛋白的表達
利用免疫熒光染色觀察給藥48 h后RKO和LoVo細胞內γ-H2AX的分布情況。實驗結果如圖7,與對照組相比,給藥組細胞內γ-H2AX陽性灶點數顯著增加,差異具有統計學意義(P< 0.01),表明TG誘導結直腸癌細胞RKO和LoVo發生DNA雙鏈斷裂。
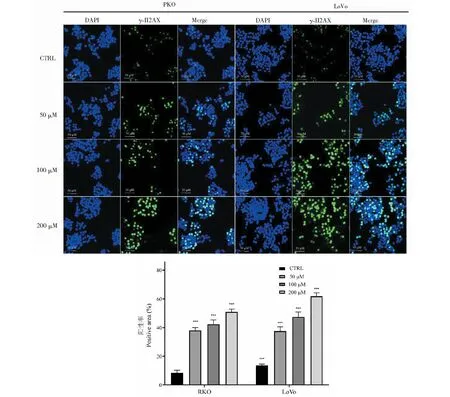
圖7 免疫熒光染色檢測TG對細胞內γ-H2AX表達水平的影響(n=3)
3.5 TG調控ATM-CHK2-p53信號通路誘導結直腸癌細胞凋亡
Western blot實驗(圖8)結果顯示,與對照組相比,給藥48 h后內凋亡標志蛋白cleaved PARP和cleaved Caspase 3表達水平顯著上升(P< 0.001),且呈濃度依賴性。為了進一步闡明TG引起凋亡的分子機制,本研究對DNA損傷應答中的關鍵蛋白ATM表達水平進行檢測。結果(圖8)顯示,藥物處理組細胞內ATM磷酸化水平顯著升高(P< 0.01)。進一步檢測ATM-CHK2-p53信號通路相關蛋白的表達水平后發現,與對照組相比,p-ATM/ATM,p-CHK2/CHK2和p-p53/p53比值均顯著升高,表明TG可能通過激活ATM-CHK2-p53信號通路誘導細胞凋亡。
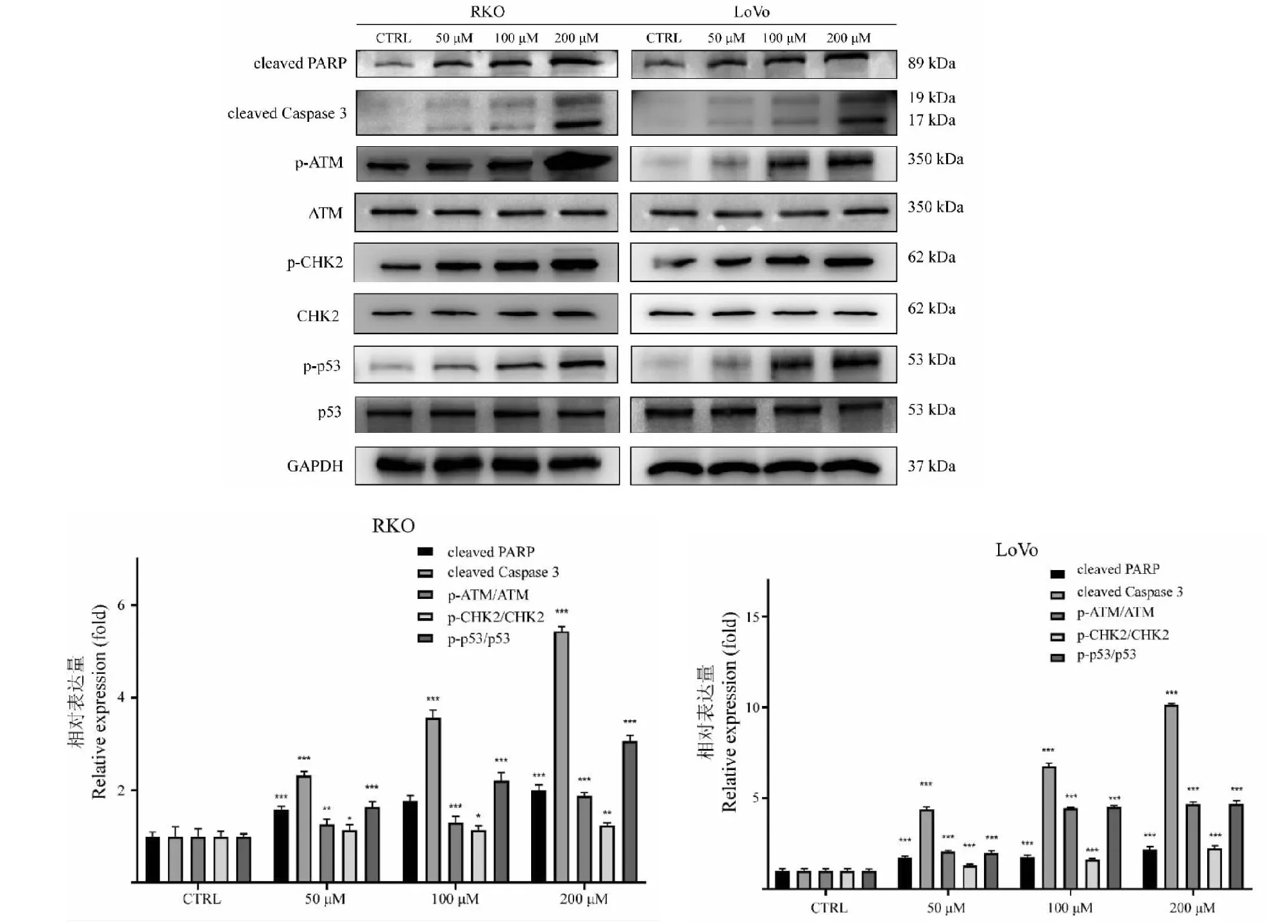
圖8 TG對結直腸癌細胞內DNA損傷及凋亡相關蛋白表達水平的影響(n=3)
4 討論
通關藤作為一種傳統中藥,臨床上具有抗癌的功效。相關研究報道,通關藤提取所得的消癌平制劑對腫瘤細胞增殖有顯著的抑制作用,其總皂苷提取物可誘導細胞凋亡發揮其抗癌活性作用[8]。因此,我們對通關藤的主要有效成分通關藤苷G抗結直腸癌藥理作用及分子機制進行研究。實驗結果顯示,通關藤苷G能顯著抑制結直腸癌細胞增殖,并通過誘導細胞DNA損傷、激活ATM-CHK2-p53通路,引起p53介導的周期阻滯和細胞凋亡。
維持基因組DNA的完整性對細胞的生長增殖具有至關重要的意義,然而細胞可能由于內、外部諸多物理或化學因素導致不同程度的DNA損傷。其中,DNA雙鏈斷裂是最嚴重的一種DNA損傷[9]。當DNA發生雙鏈斷裂時,細胞的DNA損傷應答機制使該DNA周邊的H2AX組蛋白發生磷酸化,形成γ-H2AX[10]。γ-H2AX可在數分鐘內在損傷處簇集形成γ-H2AX焦點,且焦點數量與DNA雙鏈斷裂水平呈正向對應關系,因此被公認為是DNA雙鏈斷裂的敏感性分子標記物之一。我們首先利用彗星實驗對TG給藥后細胞內DNA損傷情況進行檢測后發現,藥物處理組細胞尾部DNA含量顯著升高,證明TG誘導結直腸癌細胞DNA損傷的發生。此外,免疫熒光染色法結果顯示,與對照組相比,藥物處理組細胞內γ-H2AX陽性灶數量顯著升高,γ-H2AX表達水平顯著上升,進一步證明了TG通過誘導DNA雙鏈斷裂引起DNA損傷。
DNA損傷應答,是生物體收到刺激而引起DNA損傷時,機體為保護細胞免受傷害而啟動的DNA修飾;主要包括周期檢查點的激活、DNA損傷修復以及DNA損傷誘導的細胞凋亡[11]。細胞中用于修復DNA損傷的通路復雜多樣。當DNA雙鏈斷裂時,損傷感受器立即進行損傷識別,采取同源重組修復和非同源末端連接的重組修復[12]。其中,ATM蛋白是參與細胞損傷識別和修復的關鍵點之一[13],其通過上述兩種途徑參與DNA損傷應答。當ATM蛋白活化后,下游靶點CHK2發生磷酸化并激活p53[14],引起細胞周期阻滯并誘導細胞凋亡[15]。其中,G1/S周期進程阻滯主要由p53誘導的細胞周期蛋白依靠性激酶抑制劑p21水平升高所造成[16]。流式細胞術及Western blot結果均表明,TG可通過上調p21水平并抑制周期相關蛋白CDK2、CDK4、CDK6、Cyclin D1和Cyclin E的表達,誘導細胞G0/G1期阻滯。
研究證明,ATM-CHK2-p53信號通路在DNA損傷誘導的細胞凋亡中發揮重要作用[17]。結合其DNA損傷誘導作用,我們就TG對ATM-CHK2-p53信號通路的調控作用進行分子機制研究。Western blot實驗結果表明,TG給藥48 h后,細胞內ATM和CHK2磷酸化水平顯著升高,且p53蛋白表達及其磷酸化水平也顯著上調。同時,我們對細胞內凋亡標志蛋白cleaved PARP及cleaved Caspase 3進行檢測后發現,兩者細胞內表達水平隨給藥濃度增大而顯著升高,證明TG對結直腸癌細胞具有凋亡誘導作用。由此可以推測,TG處理后細胞內活化的ATM可能通過誘導其下游蛋白CHK2磷酸化,并進一步激活p53,引起p53介導的細胞凋亡。
細胞周期抑制在抗結直腸癌細胞增殖中發揮重要作用[18]。細胞周期蛋白(Cyclin)和細胞周期蛋白依賴性激酶(CDK)在細胞周期進程中通過形成CDK-Cyclin復合物,磷酰化目標蛋白實現細胞周期的調控[19]。其中,CDK2-Cyclin E和CDK4/6-Cyclin D1對于細胞由G1期轉入S期具有重要作用,而p21對于這一周期轉化進程具有抑制作用[20]。由于TG可通過ATM-CHK2-p53信號通路上調p53活性,活化后的p53可能通過激活p21從而啟動G1/S期監測點,誘導 G0/G1期細胞周期阻滯。
綜上所述,本研究發現,TG對結直腸癌細胞具有增殖抑制作用且誘導細胞G0/G1期阻滯與凋亡。此外,TG可引起細胞DNA損傷,激活ATM-CHK2-p53信號通路。因此提示TG可能通過調控ATM-CHK2-p53信號通路,誘導p53介導的周期阻滯與細胞凋亡,抑制結直腸癌細胞增殖。本研究為通關藤苷G治療結直腸癌提供了一定理論基礎,其他相關作用機制有待進一步的研究。

