Rochow-Müller反應制備甲基氯硅烷單體工藝的研究進展
鄺 澎,李 晶
(1.北京新時代環球進出口有限公司,北京 100027;2.中國科學院過程工程研究所,北京 100190)
有機硅或聚硅氧烷化合物是現代新興工業崛起的一門類產品,以Si—O鏈為骨架,同時在Si上引入甲基、乙基、苯基和甲氧基等有機基團側鏈的化合物。雙重鍵合賦予有機硅化合物無機和有機雙重屬性[1-4]。其中無機特性體現的是良好的生理惰性,因此能夠抗紫外輻射、抗老化、耐化學腐蝕和耐高溫等。在有機特性中,其與碳基聚合物相比,分子鏈更加開放,比碳碳鍵更加牢固、更穩定、更能忍耐惡劣環境、低溫更柔軟和高溫不損壞[5]。有機硅因此可以呈現出幾乎毫無限制范圍的適用性,廣泛應用于汽車工業、建筑行業、電子行業、醫療保健行業、電力行業、造紙行業、涂料行業、太陽能產業、紡織產業、美容與個人護理產業,被譽為“工業維生素”[6-7]。有機硅化合物基本結構如圖1所示。

圖1 有機硅化合物基本結構Figure1 Basic structure of organosilicon compound
有機硅產品通過一系列反應工藝獲得。首先單體通過縮聚反應進行水解和低聚形成環狀或短鏈狀硅基低聚物,然后將其進一步縮合或開環,獲得最終有機硅產品[8]。其中,最廣泛使用、用量最大的單體二甲基二氯硅烷通過“直接法”合成。“直接法”是由一氯甲烷直接與金屬硅接觸并反應,一步得到甲基氯硅烷的工藝過程[9]。該反應于1941年9月由E G 羅喬(Rochow)在美國首先申請了專利[10]。隨后,由Richard Müller于1942年6月在德國獨立申請了專利。因此,這種反應被廣泛稱為“Rochow-Müller過程”[11-12]。在此之前,Kipping在溶劑中通過格氏試劑(有機鹵化鎂)與四氯化硅反應,制備了二甲基二氯硅烷單體(M2)。由于格氏試劑成本高、使用大量溶劑的高危險性和副產物組分的分離困難,造成了單體規模化生產的失敗[13]。Rochow-Müller工藝的出現使單體合成工藝簡單化和高選擇性,極大改善了有機硅單體的生產困境。后來,通用電氣公司開發了第一臺直接法合成甲基氯硅烷的流化床,奠定了有機硅大規模工業化生產的基礎。到目前為止,這種“直接合成”仍然被認為是生產有機硅單體的最便捷、經濟的方法,這種方法占生產有機硅單體原料的90%以上[14-16]。
Cu基催化劑是Rochow-Müller反應的經典催化劑。該反應是以一定粒度的冶金Si粉與氣態MeCl接觸,并利用銅基催化劑在一定溫度下進行催化反應,得到甲基氯硅烷[17]。首先,引入氣相CH3Cl前,先在反應器中混合Cu基催化劑和固相Si粉,形成新鮮的“觸體”[18]。Cu基催化劑與Si粉之間的界面作用非常復雜,部分Si粉在完全轉化為產物前被鈍化失活,不能再產生M2,因此反應后的觸體被稱為“廢觸體”[19-20]。因此,銅基催化劑的催化性能,即M2選擇性和產率仍然有待提升。國內采用的催化劑大多形貌不規整,缺乏系統的構效研究和反應過程體系變化的直觀數據,至今催化機制仍然不夠清晰,且反應產物組成非常復雜。盡管Rochow-Müller工藝距今已有70多年,仍然具有巨大的挑戰值得我們去解決。本文圍繞Rochow-Müller工藝,綜述熱力學過程、銅基催化劑及助催化劑的應用、反應機制及動力學過程和反應器優化。
1 Rochow-Müller反應熱力學過程
1.1 Rochow-Müller反應選擇性
Rochow-Müller反應的復雜性涉及到很多方面,因此難以真正理解其催化過程的本質。反應冶金Si粉雜質成分多、催化活性相的形成難以捕捉、反應產物復雜均使得對反應的深入探究產生了阻礙。一方面,與典型的催化反應不同,反應前加入的Cu基催化劑并不是該反應的催化活性中心,而Si和Cu組分在熱催化作用下結合形成的Cu—Si合金中間體,特別是η相的Cu3Si被認為是反應的催化活性相。固相金屬Si粉既是反應物,又是形成催化活性相的關鍵組分[17-23]。另一方面,Rochow-Müller反應在實際工業過程中的復雜體系,即使嚴格控制工藝條件,產物組成也不止M2一種,同時會生成一定量的四氯化硅(SiCl4)、一甲基三氯硅烷[M1,(CH3)SiCl3]、甲基氫氯硅烷[M1H,(CH3)HSiCl2]、三甲基氯硅烷[M3,(CH3)3SiCl]、二甲基氫氯硅烷[M2H,(CH3)2HSiCl]、高沸產物(HBR)和低沸產物(LBR)等多種副產物,如圖2所示。

圖2 Rochow-Müller反應及其反應產物Figure 2 Rochow-Müller reaction and products
1.2 Rochow-Müller工藝熱力學過程
通過熱力學分析,不僅可得到平衡產物組成以及工藝條件對反應過程的影響規律,還可以判斷產物之間的競爭情況。羅務習等[24]基于最小能量函數法計算了包括主要硅烷產物的反應體系。認為整個反應體系包括3個相互競爭的平行反應:CH3Cl熱裂解生成含氫硅烷(HSiCl3),CH3Cl吸附解離生成主產物M2,CH3Cl催化裂解生成非M2等甲基氯硅烷副產物。相比較而言,熱力學優勢產物是HSiCl3,目標產物M2的生成在熱力學上處于劣勢。提高M2選擇性,必須使用Cu基催化體系改變反應體系的動力學過程。
J?rgAcker和Klaus Bohmhammel基于總反應體系Gibbs最小自由能對直接合成的反應體系進行了系統的熱力學計算[25]。通過抑制或排除某些實際反應產物,對剩余產物進行平衡計算,其計算的產物分布與實驗結果基本相符。如果抑制SiC、C和C-H化合物,則可以得到89.2%的M2、5.4%的甲基三氯硅烷(CH3SiCl3,M1)和5.4%的三甲基氯硅烷[(CH3)3SiCl,M3)]的混合產物,接近實驗觀察到的結果[26]。300 ℃得到的放熱焓為-277.3 kJ·mol-1,在這種情況下,熱傳遞會顯著影響產物分布。此外,熱力學計算表明3個動力學確定的反應途徑:(1) 當排除碳和烴時,甲基中的C—H鍵持續存在。(2) 僅抑制SiCl4形成時才形成甲基氯硅烷。(3) 僅存在H或HCl(兩者均通過CH3Cl的甲基分解形成)時才形成含氫的甲基氯硅烷。
Rochow-Müller過程的抑制平衡受到熱力學限制,因此可作為評估實驗結果的基準。但是,通過選擇性阻斷某些反應途徑的計算方法過于僵化,且副反應對產物分布的影響很大。因此,應該開發更準確的方法來深入了解這個復雜的反應體系。
2 Rochow-Müller反應催化體系
合理的Cu基催化體系使得M2在Rochow-Müller反應的產物中占據絕對的主導。不同的Cu基催化劑,結合不同的助催化劑與Si粉形成觸體,共同作用改善催化性能,使得該反應在較低活化能下向高Si粉轉化率、高M2選擇性和低副產物選擇性方向進行[27]。
2.1 Cu基催化劑
到目前為止,Cu基催化劑的催化效果仍然最佳。研究者已探索了各種類型Cu基催化劑,如Cu[28-29]、CuCl[30-31]、Cu2O[32-33]、CuO[34-36]和Cu-Cu2O-CuO[35,37-39]來催化Rochow-Müller反應。Cu或其化合物被稱為“Cu基催化劑”,但是Rochow-Müller反應中其體現的卻是催化劑前驅體的形式。這是由于Cu或其化合物在反應過程中將轉變為Cu-Si合金和Cu單質,而Cu-Si合金又是催化反應的活性相。目前,研究者將此反應中合成的Cu單質及其化合物仍稱為Cu基催化劑,而活性相認定為“Cu-Si合金”。
研究者研究了各種Cu基催化劑及其結構對催化性能的影響。發現催化劑的形貌、組成和結構均影響M2選擇性和Si轉化率。表1為最近幾十年來研究的Rochow-Müller催化劑。現有納米技術的蓬勃發展為設計高效催化劑提供了有效手段。與工業塊狀催化劑相比,納米級Cu基催化劑具有較高的表面積、更多的CH3Cl吸附活性位點密度,與冶金Si粉具有更多的接觸界面,從而提高了M2選擇性和Si轉化率。
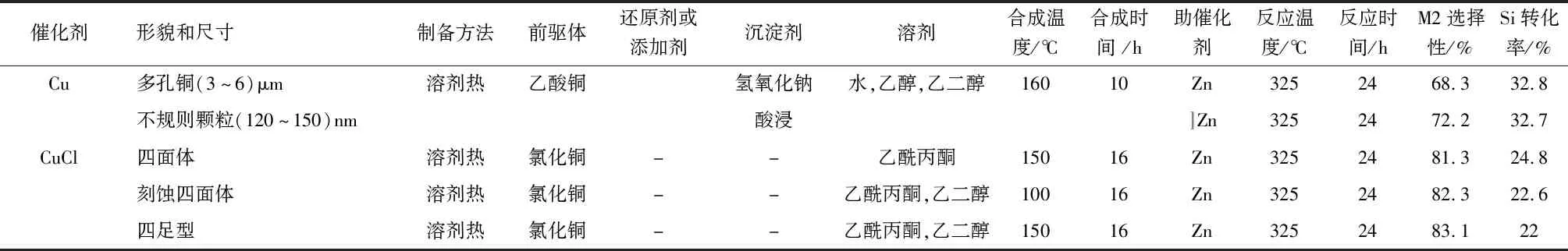
表1 Rochow-Müller催化劑的催化性能與制備方法Table 1 Catalytic performance and synthesis methods ofRochow-Müller catalysts
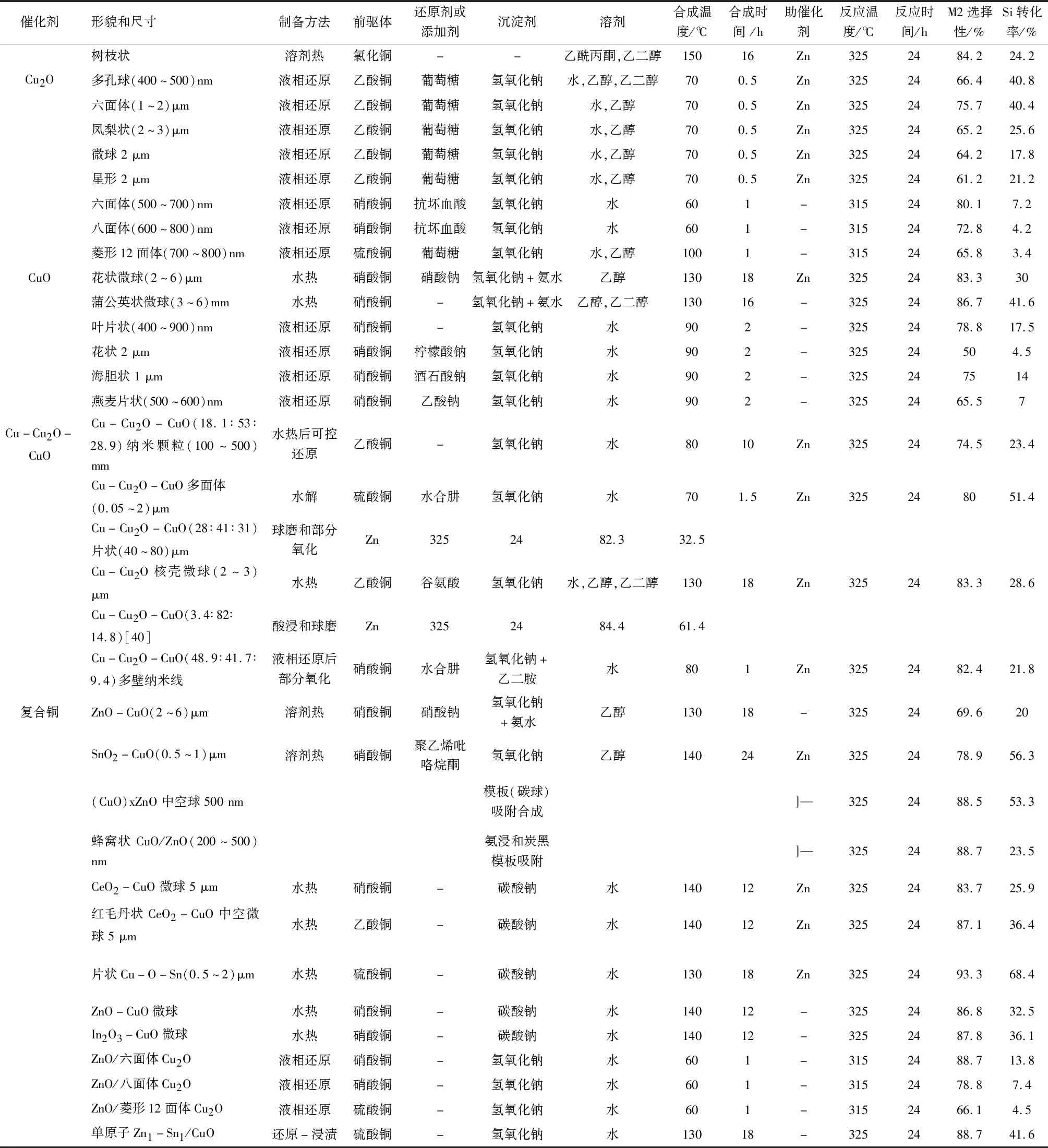
續表
2.1.1 金屬Cu
Cu是Rochow E G發現的第一種催化劑,這是由于當時所用的Si原料中因為冶煉的原因含有部分Cu組分。研究發現,金屬Cu單獨作為催化劑的反應性能較差。相同反應條件下,與其他Cu基氧化物相比,Cu表現出最低的M2選擇性和Si轉化率,因此關于金屬Cu的催化性能和機理研究較少[28,35,37-43]。Zhang Z等[29]報道,一種多孔立方Cu在Rochow-Müller反應中活性更高,因為微粒內的孔隙率大大增強了氣體的擴散和活性Cu3Si的形成。多孔立方銅顆粒上的M2選擇性僅為68.3%,遠低于可用于工業化生產的目標。工業上,由于其性能較差,金屬Cu很少單獨用作催化劑。
2.1.2 CuCl
CuCl是Rochow-Müller反應的有效催化劑,20世紀許多研究者經常將CuCl作為模型催化劑來研究直接合成的機理[44-50]。CuCl與其他催化劑相比,具有誘導期短和選擇性較好等優點。Chen X等[31]發現,暴露(111)、(200)和(220)晶面的樹枝狀CuCl的催化活性高于其他晶面的CuCl,其M2選擇性達84.2%,因為前者可以實現最快的Cu原子擴散速率。Juergen K H[51]采用專門的工藝制備了高松散的薄片狀CuCl,使得其在Rochow反應中的M2質量分數提高到約80%,且Si粉轉化率及MeCl氣體轉化率也提高明顯。羅務習等[52]利用分散劑制備了一種高比表面積的薄片狀CuCl,其在Rochow反應中的M2質量分數提高到約90%,效果顯著。然而,CuCl在工業上依然有其局限性,首先,反應初期生成SiCl4副產物,這增加了產物組分的分離難度;其次,CuCl自身穩定性較差,易吸水變潮或被氧化為堿式氯化銅[Cu4(OH)6Cl2]。因此,CuCl催化劑幾乎被許多工業應用所放棄。
2.1.3 Cu基氧化物
銅氧化物(如Cu2O或CuO)是有效的催化劑。較高的比表面積、孔隙率,較小的粒度和適當暴露的晶面均有助于增強催化性能。Li J等[53]研究了不同晶面Cu2O對Rochow-Müller反應中活性相形成的影響。結果表明,暴露于(100)晶面的立方體Cu2O具有最高的M2選擇性和Si產率,而暴露于(110)菱形十二面體的Cu2O則具有最低的選擇性和產率。密度泛函理論(DFT)計算表明,CH3Cl在Cu2O(100)面上較強的解離吸附作用,極大促進了Cu2O向Cu3Si活性相轉化,有利于M2選擇性和Si產率的提高。Zhang Y等[54]基于螯合配體經過簡單沉淀法制備了不同形貌的CuO,其中制備得到的葉片狀L-CuO表現出最佳的催化性能,首先是由于其高比表面積有利于CH3Cl吸附和與Si接觸;另外暴露于O2-終端的(001)面是最活躍的晶面,具有更強的吸附能力和還原性,有助于形成更多的Cu3Si物種。
2.1.4 多元Cu基催化劑
目前,工業上主流采用的工藝是采用Cu粉部分氧化得到Cu-Cu2O-CuO三元銅催化劑,三者之間具有協同作用。在常規反應條件下,除Cu-Cu2O-CuO外,Cu、Cu2O和CuO都不能單獨獲得較優的催化性能[32-33,35,37-39]。美國SCM公司在約200 ℃下,通入含有低氧分壓的氮氣對Cu粉進行處理,能夠得到合適比例的高活性Cu-Cu2O-CuO三元銅系催化劑,粒徑(0.7~35)μm、質量比為14.5%、40.1%和41.4%,M2選擇性達85.5%[55]。Liu W等[35]報道,還原得到的質量比為18.1∶53.0∶28.9的納米粒子,其M2選擇性為74.5%和Si轉化率為23.4%。Liu S等[37]報道了片狀Cu-Cu2O-CuO達到了82.3%的M2選擇性和32.5%的Si轉化率。Li J等[38]發現,部分氧化得到的多壁Cu-Cu2O-CuO納米線達到了82.4%的M2選擇性和21.8%的Si轉化率。但是,Cu、Cu2O和CuO之間真正的協同作用尚不清楚。根據先前的研究,可能部分歸因于在界面上產生更多的氧空位,從而提升了反應催化性能[41]。
2.2 助催化劑
助催化劑是一種本身沒有催化活性或者活性很小,但以較小比例添加到催化劑中可以提高催化性能[40]。目前在Rochow-Müller反應中已發現Zn、Sn和P等可協助銅催化劑提高M2選擇性和Si粉轉化率,由于含量非常低,因此其作用機制仍不清楚[56-68]。這可能由于反應條件復雜,包括反應器的類型、Si粉與催化劑和助催化劑的比例、操作溫度均不相同;另外,催化過程復雜,包括反應動力學過程[59-60]、熱力學過程[64-65]、催化劑體系本身的電子結構或相互作用[32, 55-58]等。
目前為止,Zn或ZnO是效果最好,且使用最為廣泛的一種助催化劑。1949年Gilliam提出,如果在Rochow反應體系中加入質量分數0.03%~0.75%的Zn,可以改善催化反應選擇性。Ward W J等[69]發現,適量Zn在反應前加入時會促進Cu3Si活性相的形成,進而提高M2選擇性。Frank T C 等[70]認為,Zn是通過抑制M3選擇性來提高M2選擇性。Lewis K等[71]認為,Zn通過晶間擴散進入Cu3Si活性相的晶格中,促使體相Si向表面富集,從而加速Si向界面的擴散傳遞,增加催化性能。Gasper-Galvin L D 等[60]認為,Zn作為一種甲基化促進劑提高了M2選擇性。Wang C等[65]研究發現,硅片表面氧化層能很大程度上抑制Cu在Si中的擴散,而Zn的添加可能是去除了硅片的表面氧化層而顯著提高了M2選擇性。Zhang C等[72]研究發現,在Rochow反應體系中加入ZnO可調整CuO中Cu核的電子密度,兩者協同效應形成了有效的電荷轉移界面,從而有利于增加M2選擇性。Li J等[73]發現ZnO納米顆粒沉積到立方Cu2O晶體上,表現出最佳的M2選擇性和Si轉化率,這主要歸因于ZnO存在有效改善界面價電子的轉移能力,有利于增強CH3Cl的吸附能力,并形成更多的Cu3Si活性中間相。
Gasper-Galvin L D等[60]認為,Sn對合成甲基氯硅烷有不利影響,然而在反應體系中Sn的添加量降到Cu的(200~5 000)×10-6時,催化反應速率明顯加快。文獻[56,58]表明,Sn通過降低Cu3Si的熔點和表面張力,與Zn發生協同作用,增加Cl的表面轉移并加速活性SiClx位點的形成。Shi Q等[74]發現,原子分散的Sn和Zn協同作用,導致CuO催化劑的電子結構發生變化,促進了反應物MeCl的吸附和CuxSi活性相的形成,提高了催化性能。Sn的加入可以增加表面甲基的濃度,相應的反應產物中甲基硅烷的比例會提高[57]。Sn協同CuCl可以促進Cu3Si的消耗[65]。將Sn摻雜到CuO晶格中是提高催化活性的有效策略。Zou S等[75]研究發現,Sn在CuO表面發生偏析,并且化學吸附的氧種類和陽離子空位的數量與催化劑活性密切相關。
P及其化合物是Rochow-Müller反應的有效助催化劑。與Sn相似,P的含量必須降低到Cu含量的萬分之幾才能體現其助催化的作用[56,76]。在CuCl中添加PCl3可以更快地形成Cu3Si和提升M2選擇性[63]。另有研究發現,CuP可以促進觸體表面的甲基斷裂[57],從而促進反應進行。
In作為助劑元素對Rochow-Müller反應也有促進作用,Zhang Y等[77]認為ZnO、SnO2、P2O5和In2O3等助催化劑全部屬于N型氧化物。N型氧化物的添加增加了Cu核周圍的電子密度,導致Cu2+正電性降低,改變CH3·和Cl·的吸附能,從而導致M2選擇性改變[18,77]。
3 Rochow-Müller反應動力學和機理
Rochow-Müller反應周期可以分為誘導期、穩定期和失活期。誘導期是在CH3Cl氣體存在下,Si和Cu基催化劑相互作用逐漸形成Cu3Si薄層的時期[78-80]。之后在Cu3Si表面連續穩定生成M2,表明已進入穩定期。當M2選擇性明顯降低時,反應進入失活期,在該失活期中催化劑通過炭沉積逐漸失活。Zhang Y等[18]研究了含ZnO-CuO催化劑在整個Rochow-Müller反應的Cu-Si互擴散過程。Si顆粒表面消耗,并形成凹坑式刻蝕,并在刻蝕區域表面生成Cu3Si,引發了Rochow-Müller反應。Li J等[53]發現,廢Si觸體表面為類似“珊瑚狀”的溝壑刻蝕,且正方體Cu2O催化劑變成表面為無定型SiO2的空心結構,證實了Cu-Si互擴散過程。
不同條件下,人們對Rochow-Müller反應的動力學進行了廣泛研究。Voorhoeve R J H等[81-83]發現,該反應可能是非均相催化過程,其中最初在活性表面發生CH3Cl解離吸附,之后在化學吸附層中發生速率確定的反應。Agarwala J P等[59]測試了含Zn的Cu3Si合金的動力學過程,顯示Zn在低濃度時才能作為提高選擇性的促進劑。Frank等測量了純Si和Cu3Si合金上的硅烷形成速率。純Si不含Cu,達到穩定期,僅可檢測到HSiCl3和M1H。Cu3Si合金提供了生成M2的活性表面,同時抑制其他硅烷的生成[70]。Kim J P等[66]報道,Zn促進CH3Cl的解離吸附,使得甲基連接到Si、Cl基連接到Zn上,從而增加了甲基化硅烷M2選擇性。目前關于甲基硅烷形成路徑的爭論仍然存在,需進一步確定在不同表面結構上形成甲基硅烷的差異性,進而確定其催化機制。
目前普遍認為有效的催化活性中心是反應過程中形成的Cu3Si合金,且與塊體Cu-Si合金不同[84-86]。但是,關于Cu3Si合金活性相與M2選擇性高的關聯性,目前還存在廣泛爭論[70,83,85,87,88]。研究人員發現了合金化Si與CH3Cl或與甲醇反應中形成的甲硅烷中間體的現象。Clarke M P等[89]通過丁二烯捕集實驗,發現甲硅烷基中間體∶SiCH3Cl和∶SiCl2,兩者與觸體表面結合并與CH3Cl反應分別生成M2和M1。Wanandi P W等[90]證明,Cu3Si表面形成的金屬鍵合的亞甲硅烷片段中,富電子中心與路易斯酸性的硅烯配體協同促進CH3Cl的解離。Lorey L等[84]提出CH3Cl吸附在Cu3Si表面可生成甲硅烷基團,后續氧化加成可得到主產物M2。
4 Rochow-Müller反應工藝條件的影響
反應過程中影響反應速率的因素并不是一成不變,而是隨條件改變而變化。工藝條件主要包括反應溫度和反應壓力等,這些操作條件對實際生產非常重要。
Rochow-Müller反應是一個強放熱反應,控制溫度是最為首要的因素[91-92]。冶金Si粉為熱的不良導體,在固定床情況下,反應物表面容易被碳覆蓋,從而被鈍化,而且熱量不宜排放。攪拌床比固定床更有利于熱量的移出。而工業上一般采用具有傳熱性能好、溫度均勻和停留時間短的流化床反應器來進行有機氯硅烷單體的生產[78, 91,93-94]。
Rochow-Müller反應是一個分子減小的反應。從熱力學理論來看,提高壓力有利于向甲基氯硅烷生產方向移動。Voorhoeve R J H等[81]認為,在壓力較低情況下,反應速率隨壓力的升高而增大,有利于縮短反應誘導期。壓力超過一定值后,由于增加了產物的解吸阻力,反應速率反而會下降。合理的壓力范圍(0.1~0.5) MPa有利于選擇性的提高。李書兵等[95]認為,壓力0.23 MPa時,CH3Cl空床線速率較高,反應溫度更易實現平穩控制,同時可獲得更高的Cu-Si合金轉化率及CH3Cl單級轉化率。
5 結 語
甲基氯硅烷是制備有機硅材料最重要的單體原料,Rochow-Müller催化反應工藝則是整個有機硅產業的基礎核心。回顧了幾十年來Rochow-Müller催化反應工藝的研究進展,包括反應熱力學、催化劑、動力學過程和反應機理,以及工藝條件的影響。目前人們對Rochow-Müller反應的真實反應路徑的探究仍然存在各種問題和爭議。主要是(1) 催化劑的種類,主助催化劑的協同機制;(2) 反應原料的影響,如Si粉的粒徑和質量;(3) 操作工藝條件,包括反應溫度、壓力和空速等各種因素的不確定性都會對產物分布和產率造成影響。因此,更大的挑戰是理解Rochow-Müller反應的催化本質,尋找最合適的催化反應工藝體系,進而提升M2選擇性和收率。隨著有機硅工業的蓬勃發展,未來Rochow-Müller反應催化工藝將具有更廣闊的應用前景。

