重組腺病毒Ad-DDAH2轉染大鼠脂肪干細胞的可行性
李學峰 周世豪 王新花 龐益偉 王雁林 李清春 刁興華 劉海燕
1 濱州醫學院附屬醫院生殖醫學科 山東 濱州 256603;2 濱州醫學院附屬醫院消化內科 山東 濱州 256603
一氧化氮(nitric oxide,NO)是內皮細胞分泌的一種介導血管舒張的主要神經遞質,與陰莖勃起功能障礙密切相關[1]。一氧化氮合酶(nitric oxide synthase,NOS)是調節NO濃度的關鍵酶。非對稱性二甲基精氨酸(asymmetric dimethylarginine,ADMA)是NOS的內源性抑制物,因而ADMA是體內NO合成的抑制性調節物,90%以上的內源性ADMA由二甲基精氨酸-二甲胺水解酶(dimethylarginine-dimethylamine hydrolase,DDAH)水解代謝,因而體內NO的濃度與DDAH的活性含量有關。DDAH有DDAH1和DDAH2兩種亞型,DDAH1主要分布在腎小管、肝臟,而DDAH2主要分布在血管內皮細胞,與內皮型NOS表達的組織一致[2-4]。利用干細胞治療可以明顯改善勃起功能障礙動物的勃起功能,脂肪干細胞(adipose-derived stem cells,ADSCs)取材于睪丸附睪周圍的脂肪組織,操作簡單,技術成熟,分離成功率高,并發癥少,是理想的載體[5-6]。本研究應用基因工程技術將DDAH2基因導入干細胞基因組中,使DDAH2在ADSCs持續表達,降低ADMA生成,提高NO生成,改善修復血管內皮細胞,從而期望在以后的臨床應用上達到改善勃起功能的目的。
1 材料與方法
1.1 實驗動物與試劑 雄性SD大鼠,體質量為(100±30)g,購自上海斯萊克實驗動物有限公司,許可證號為SCXK(滬)2017-0005。Ad-DDAH2-GFP(上海吉凱生物有限公司),低糖DMEM培養基(Hyclone公司),胎牛血清、胰酶(Gibco公司),DDAH2抗體(H-85)(santa cruz biotechnology公司,No. sc-32859),β-Actin抗體(Epitmics公司),PCR試劑盒(TaKaRa公司)。培養板及培養瓶(Corning公司)。
1.2 方法
1.2.1 SD大鼠ADSCs的分離培養 3月齡雄性SD大鼠,頸椎脫臼法處死,75%酒精浸泡30 min,超凈工作臺內將大鼠固定。取雙側腹股溝區切口,充分分離切取皮下脂肪組織,將脂肪組織剪成盡可能小的組織小塊,加入2倍體積0.1%Ⅰ型膠原酶,37℃震蕩消化30~45 min;加入DMEM完全培養基混勻后1 000 r/min離心10 min。棄除上層脂肪組織消化液,加入2倍體積DMEM完全培養基,充分吹打混勻,并將液體于200目不銹鋼篩網過濾;1 000 r/min離心10 min,棄除上清,用DMEM完全培養基充分懸浮細胞沉淀,細胞計數后接種至培養瓶內,于37℃、5%CO2培養箱內培養換液。待細胞培養融合至80%~90%時,棄除培養瓶內培養基,滅菌PBS輕輕漂洗2次,加入1.5~2.0 mL 0.25%胰蛋白酶細胞消化液(含0.02% EDTA),并于倒置顯微鏡下觀察細胞形態變化,待細胞形態變圓且開始從培養瓶壁脫落時即可終止消化;輕輕拍打瓶壁,加入1.5~2.0 mL完全培養基終止消化,并沿培養瓶壁順序充分吹打混勻制成單細胞懸液,以1∶3比例傳代培養。
1.2.2 Ad-DDAH2-GFP對ADSCs轉染效率的測定 根據重組腺病毒感染復數(multiplicity of infection,MOI)將實驗分為MOI=0、MOI=20、MOI=40、MOI=60、MOI=80和MOI=100轉染組,每個轉染組又分為空白對照組(未轉染組)和實驗組(Ad-DDAH2-GFP轉染組)2個亞組,每組同時設3個復孔。將生長狀態良好的第4代大鼠ADSCs種于24孔培養板。待細胞融合至60%~70%,將病毒原液滴度稀釋為1.0×108PFU/mL,棄除孔內培養基,轉染孔內依次加入病毒稀釋液和無血清DMEM培養基,充分混勻,培養24 h后,將孔內培養基更換為1ML DMEM完全培養基,并觀察細胞生長狀態。轉染48 h后,0.25%胰蛋白酶消化細胞,1 000 r/min離心10 min,250 mL PBS重懸細胞后,熒光顯微鏡觀察各MOI值轉染效率,根據各MOI值轉染效率及細胞狀態選取最佳MOI值。
1.2.3 DDAH2基因在ADSCs中的表達 在最佳MOI值轉染前提下,轉染ADSCs 48 h后,提取細胞mRNA、總蛋白,通過RT-PCR、Western Blot技術檢測DDAH2表達情況。實驗分為空白對照組(未轉染組)、陰性轉染組(Ad-NC-GFP轉染組)和實驗組(Ad-DDAH2-GFP轉染組)3個組,每組同時設立2個復孔。
2 結果
2.1 大鼠ADSCs的分離和培養 原代細胞培養72~96 h后,大部分細胞貼壁生長,隨著傳代次數的增加,細胞多呈多角形、短梭形,偶見長梭形細胞(圖1)。
2.2 大鼠ADSCs的生長曲線 第4代大鼠ADSCs的生長曲線呈“S”形(圖2)。細胞于第1~2天生長較緩慢,第3天后呈對數生長,第8天后生長速度減慢,并進入平臺期,第9天后細胞生長速度呈下降趨勢。
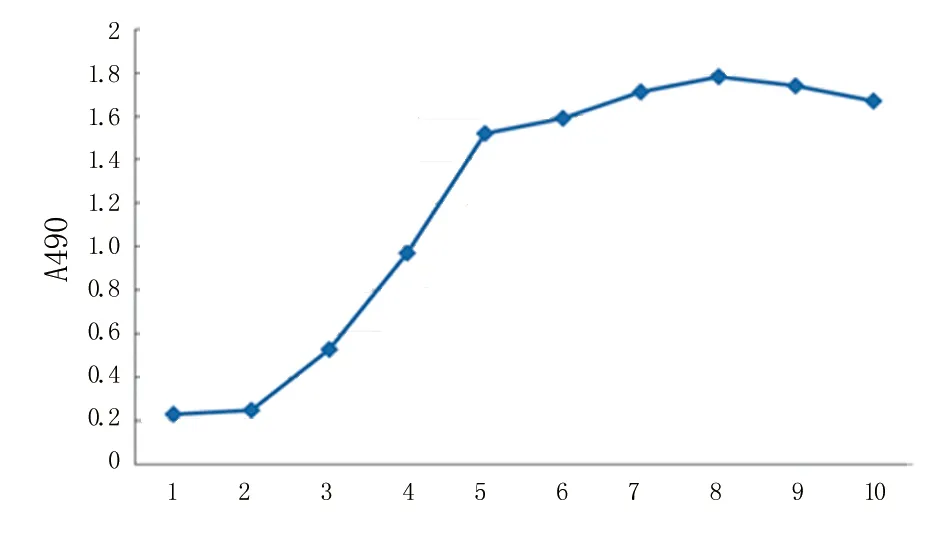
圖2 第4代ADSCs的生長曲線
2.3 大鼠ADSCs的免疫表型鑒定 流式細胞術檢測結果顯示,第4代ADSCs的CD29、CD90表達呈陽性,表達率分別為(95.83±0.53)%、(91.32±0.27)%,而造血干細胞表面標志CD45表達呈陰性,表達率為(1.59±0.06)%,符合ADSCs免疫表型特征,這表明所培養的細胞為ADSCs(圖3)。
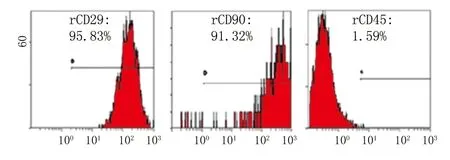
圖3 第4代ADSCs的免疫表型檢測結果
2.4 Ad-DDAH2載體質量檢測 pH值判定:腺病毒保存液pH值范圍在6.4~7.0之間。粘稠度判定:用20~200 μL規格移液器緩慢吸取50 μL腺病毒保存液體,無明顯粘稠感或吸液滯后現象。無菌檢測:將腺病毒加入HEK293細胞驗證,正常培養24 h后鏡檢,無任何細菌及真菌污染情況,同時參照空白細胞組,細胞間隙無明顯顆粒存在,培養基澄清透明。腺病毒滴度測定:以 10-6~10-12稀釋比病毒液轉染HEK 293細胞10 d后,致細胞病變效應(cytopathic effect,CPE)嚴重程度隨稀釋倍數的增加而減弱,Ad-DDAH2病毒滴度為2×1010PFU/mL,可滿足后續研究需求(圖4)。
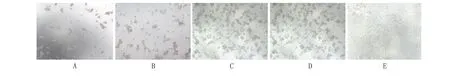
A. 病毒液稀釋比為10-6;B. 毒液稀釋比為10-8;C. 毒液稀釋比為10-10; D. 毒液稀釋比為10-12;E. 空白對照組。圖4 腺病毒的滴度測定(倒置顯微鏡,×100)
2.5 Ad-DDAH2-GFP轉染ADSCs的效率 腺病毒轉染24 h后,轉染孔細胞漿內開始表達GFP,且陽性率隨MOI值增大而增加,48 h后GFP表達顯著增強。Ad-DDAH2-GFP轉染效率隨MOI值的增大而增加,MOI=80~100時轉染效率雖然達到90%以上,但細胞CPE陽性率隨著MOI值增大而逐漸增加。MOI=80對ADSCs的生長無顯著影響,為Ad-DDAH2-GFP轉染ADSCs的最佳MOI值(圖5)。
2.6 DDAH2在ADSCs中的表達 通過PCR對DDAH2基因進行擴增,1%瓊脂糖凝膠電泳結果顯示,Ad-DDAH2-GFP轉染ADSCs 24 h后,DDAH2基因在mRNA水平顯著上調,見151bp陽性條帶(圖6A),與空白對照組及陰性對照組相比,差異有統計學意義。這表明,腺病毒介導的DDAH2基因在大鼠ADSCs中有效表達。轉染48 h后,通過Western Blot技術于第3泳道130~250 kDa處檢測到約為25 kDa的條帶(圖6B)。這表明,DDAH2蛋白在ADSCs中有效表達,從而證實Ad-DDAH2-GFP構建成功,并在ADSCs中穩定表達。
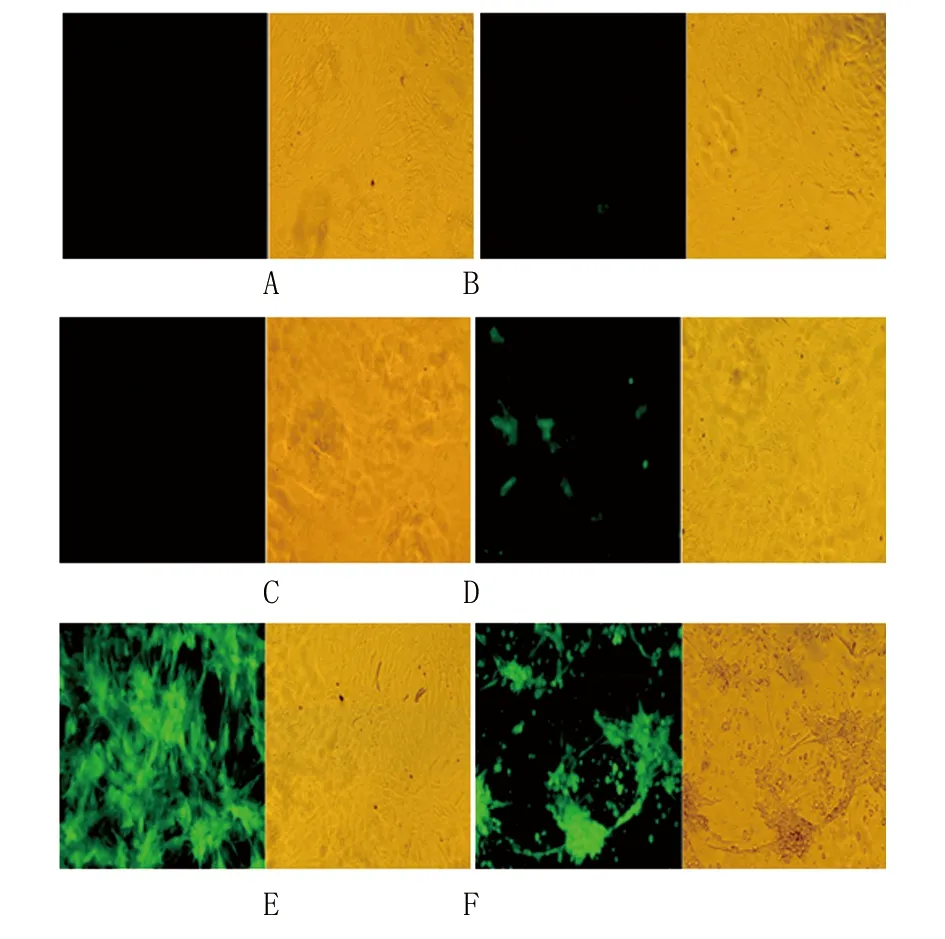
A. MOI=0;B. MOI=20;C. MOI=40;D. MOI=60;E. MOI=80;F. MOI=100。圖5 不同MOI情況下Ad-DDAH2-GFP轉染ADSCs的效率(倒置顯微鏡,×200)
3 討論
NO是血管內皮細胞分泌的一種介導血管舒張的主要神經遞質,NO的濃度與DDAH的活性含量呈正相關。DDAH2對NO-cGMP通路的完整性具有重要的意義,因此,DDAH2基因治療是治療糖尿病、勃起功能障礙、慢性腎病的潛在可行方法[7-9]。
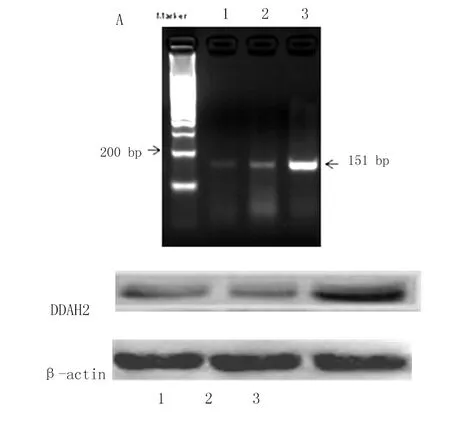
A. DDAH2mRNA在ADSCs中的表達;B. DDAH2蛋白在ADSCs中的表達。1. 空白對照組(PBS);2. Ad-null-GFP組;3. Ad-DDAH2-GFP組。圖6 DDAH2在ADSCs中的表達情況
干細胞具有自我更新和分化的能力,一直是生物學研究的熱點,其中ADSCs由于取材方便,增殖能力較強,干細胞性狀穩定,受到廣大研究者的普遍認可,基因修飾干細胞治療需要載體將目的基因轉移到干細胞內,使干細胞在基因水平上發生改變,但不影響細胞的正常功能,再通過體內回輸達到治療疾病的目的。腺病毒作為雙鏈DNA病毒,轉染率高,既可以轉染分裂期細胞,也可以轉染靜止期細胞,對靶細胞病理性損害小,轉染后的基因,尤其是大片段基因能表達數天到數周,因此作為基因載體廣泛應用于治療研究中[10-12]。
在本研究中,腺病毒載體在最佳MOI=80條件下,轉染效率高達90%以上,且干細胞毒性較小。DDAH2基因導入ADSCs基因組后,使DDAH2在ADSCs中持續表達,然后將轉染后的ADSCs注射到體內。利用ADSCs能夠特異性遷移到損傷器官/組織,在不同條件下分化成不同的細胞類型,導入的基因可長期穩定表達,植入體內無免疫反應等特點,可以修復損傷組織細胞。此外,DDAH2在基因水平上提高了NO生成,改善修復血管內皮細胞,增強局部抗氧化應激的能力[13-16]。本研究成功將干細胞治療和基因治療結合起來,為臨床DDAH2基因修飾ADSCs治療提供指導意義。

