高羊茅FaFT基因表達、蛋白互作及生物學功能分析
羅維 牟瓊 舒健虹 吳佳海,3 王小利
(1. 貴州大學動物科學學院 高原山地動物遺傳育種與繁殖教育部重點實驗室,貴陽 550025;2. 貴州省農業科學院草業研究所,貴陽 550006;3. 貴州省農業科學院果樹科學研究所,貴陽 550006)
開花是植物從營養到生殖階段的關鍵時刻,是一個復雜的發育調控過程,并受內外因素的影響。植物需要適當的外界環境條件,如適宜的光周期和溫度,在一定時間內刺激開花[1]。溫度、光照等條件適宜時,植物葉片產生的成花物質或信號傳遞到莖尖的生長點,在頂端分生組織內(shoot apical meristem,SAM)啟動開花基因的表達,促使植物進入成花決定態[2]。
基于對模式植物擬南芥的研究表明,在植物的成花轉變中有多種途徑,包括赤霉素途徑、自發途徑、春化途徑及光周期途徑[3]。不同途徑能感受不同的外界信號刺激,共同調控植物開花過程。FLOWERING LOCUS T(FT)是重要的開花促進因子,研究證明 FT基因編碼的蛋白質產物是長距離轉運的成花素,屬于磷脂酰乙醇胺結合蛋白基因(phosphatidylethanolamine binding protein,PEBP)家族,該家族成員在植物中是高度保守的調控因子,在被子植物和裸子植物中發現PEBP家族進化出開花抑制子和活化子。在適宜的光照下,FT基因受光周期誘導在葉片中表達,其表達產物經維管束轉移到莖頂端分生組織調控下游基因表達促進開花。FT蛋白到達SAM后,與bZIP轉錄因子FLOWERING LOCUS D(FD)相互作用,FT /FD復合系統激活了許多MADS盒基因,包括APETALA1(AP1),FRUITFULL(FUL) 和 SUPPRESSOR OF OVEREXPRESSION OF CONSTANS 1(SOC1)過度表達CONSTANS(CO)刺激花器官的啟動[4]。FT基因位于開花促進基因CO基因的下游,在光周期途徑中,CO基因受到光周期節律GIGANTEA(GI)基因的誘導,CO基因表現出節律變化,從而激活 FT基因的轉錄和表達[5]。春化途徑中,FLOWERING LOCUS C(FLC)基因是春化途徑的關鍵基因,它是一個開花抑制子,既能在葉片中抑制 FT 基因的表達,也在莖頂端生長點抑制 FD 和 SOC1基因的表達,能影響莖頂端分生組織對來自葉片 FT蛋白信號的應答能力。但春化后,FLC基因的表達被抑制,這時在長日照條件下,CO基因通過上調 FT基因表達,進而促進SOC1和AP1基因 mRNA的積累而啟動開花[5-6]。在甜菜(Beta vulgaris)中,春化涉及到兩個相互拮抗作用的FT基因,BvFT1抑制BvFT2基因的表達,BvFT2 基因促進植物開花。春化后,BvFT1 基因的表達被抑制,BvFT2 基因表達促進植物開花[7]。在小麥(Triticum aestivum)和大麥(Hordeum vulgare)中,春化作用調控開花抑制子[8],使得 VERNALIZATION1(VRN1)基因表達上調,VERNALIZATION2(VRN2)基因表達下調,進而使得 FT基因表達促進植物開花[9-10]。FD基因同樣參與調控植物開花進程,研究發現喪失功能的擬南芥fd突變體表現出晚花,當FD過量表達時可以幫助植物正常開花。FD基因能促進FT發揮作用,表現為fd突變體過量表達FT基因并沒有早花表型[11]。
目前FT基因已經在多種植物中被分離出來,如擬南芥(Arabidopsis thaliana)[12]、水稻(Oryza sativa)[13]、洋蔥(Allium cepa)[14]、二穗短柄草(Brachypodium distachyon)[1]、 陸 地 棉(Gossypium hirsutum)[15]等,而在高羊茅的成花機制研究甚少。高羊茅由于耐熱性好、抗逆性強,現已廣泛應用于草坪種植和牧草栽培,對草坪業和畜牧業有重要意義。本研究從前期高羊茅轉錄組數據中克隆出FaFT基因并對其進行生物信息學和亞細胞定位分析;運用qRT-PCR分析該基因在不同光照處理下及不同發育時期下的表達情況;應用酵母雙雜交方法對互作蛋白FD進行探究,為進一步探討高羊茅的成花機制提供依據。
1 材料與方法
1.1 材料
本實驗選用的“黔草1號”高羊茅為貴州省農業科學院草業研究所2005年培育品種(國審:299)。TRIzol購自美國Invitrogen公司,cDNA合成試劑盒購自TaKaRa公司,所用相關載體由實驗室保存,其他試劑為國產分析純。
1.2 方法
1.2.1 FaFT基因在高羊茅基因組中擴增與序列分析 所取樣品參照TRIzol說明書提取總RNA,cDNA第一鏈合成參照TaKaRa試劑盒。根據“黔草1號”基因組,用Primer 5.0設計擴增引物FaFT-F1/FaFT-R1進行目的序列擴增(表1),PCR反應程序:4 μL dNTP Mixture(0.0025 mol/L)、5 μL 10×PCR Buffer(Mg2+)、2 μLcDNA、3 μL MgCl2(0.025 mol/L)3 μL、0.25 μL TaKaRa Taq 酶、上下游引物FaFT-F/FaFT-R 各 2 μL, 補 ddH2O 至 50 μL。 反 應條件為預變性94℃ 2 min,35個循環(94℃ 10 s,55℃ 30 s,72℃ 30 s),72℃ 延伸 10 min。待反應結束后用1%的瓊脂糖凝膠檢測PCR擴增產物,并膠回收試劑盒收回目的片段,篩選純化后送寶生物工程(大連)有限公司測序,測序結果用Blast數據庫分析。

表1 引物信息Table 1 Primer sequence
1.2.2 FaFT基因表達分析 篩選大小相近的高羊茅種子經消毒后平鋪在1/2MS固體培養基上,待長出子葉后移栽至裝有蛭石和土壤的小花盆中(蛭石和土壤比例為1∶1),將小花盆放入不同光照培養箱。長日照(22℃,16 h/8 h)、短日照(22℃,8 h/16 h),最后分別在長日照和短日照基礎上轉入光照/黑暗與黑暗/光照循環模式轉入黑暗/光照循環模式。以GAPDH(glyceraldehyde-3-phosphate dehydrogenase)為內參基因,將保存好的cDNA稀釋20倍用于qRT-PCR分別檢測高羊茅葉片中FaFT基因在長日照和短日照、長日照轉、短日照轉連續黑暗和連續光照、晝夜顛倒處理下以及長日照下不同生長發育階段的表達量。每個樣品3個技術重復,3個生物學重復,采用2-ΔΔCt方法分析數據。
1.2.3 亞細胞定位分析 利用雙酶切將FaFT的編碼區克隆到1300-GFP表達載體上,構建FaFT-1300-GFP重組質粒。將FaFT-1300-GFP重組質粒轉化到農桿菌感受態細胞GV3101,篩選陽性菌落接種于LB(含 100 μg/mL Rif)28℃培養基震蕩培養 24 h,離心后收集菌體。再加入0.1 mol/L的乙酰丁香酮2 μL和 0.5 mol/L MES 100 μL,28℃搖床培養OD值約1.0左右。4 000 r/min常溫離心10 min,15 min收集菌體,用含0.01 mol/L MgCl2重懸菌體至OD值為1.0,以每毫升菌液加入2 μL 0.1 mol/L AS,靜置3 h以上。將侵染液裝入5 mL注射器內,用拇指按壓注射器反板將液體從葉片下表皮注射到煙草葉片內,72 h后,取樣通過激光共聚交熒光顯微鏡檢測熒光信號。GFP激發光為488 nm,DAPI激發光為405 nm。
1.2.4 酵母雙雜交 構建FaFD-pGADT7和FaFTPGBKT7載體,利用PEG/LiAc介導法將陰性對照pGBKT7和pGADT7、陽性對照pGADT7和pGBKT7-53和實驗組FaFD-AD和FaFT-BD同時轉入酵母菌株AH109。將轉化后的酵母細胞加入0.9%NaCl溶液懸浮后的菌液涂布于SD/-Leu/-Trp(缺陷型-亮氨酸-色氨酸)培養基,待SD/-Leu/-Trp培養基上長出克隆后,挑取克隆至SD/-Ade/-His/-Leu/-Trp(缺陷型腺嘌呤-組氨酸-亮氨酸-色氨酸)上。30℃恒溫箱培養3-5 d后進行X-α-Gal檢測。
1.2.5 雙分子熒光互補驗證(bimolecular fluorescence complementation,BiFC) 將 FaFT基因的編碼區構建至pSPYCE-35S載體,所用引物為FaFTC-F :5′-GCCTGGCGCGCCACTAGTGGATCCA-3′,FaFT-C-R:5′-CATCCCGGGAGCGGTACCCTCGAG-3′;同樣將FD基因編碼區構建至pSPYNE-35S載體。將FaFT-pSPYCE-35S和FD-pSPYNE-35S轉入農桿菌GV3101中,將攜帶表達載體的農桿菌菌株注入煙草葉片,培養72 h后激光共聚焦顯微鏡下觀察黃色熒光蛋白(YFP)信號。
1.2.6 FaFT基因生物學功能驗證 FaFT基因表達載體構建:構建pCAMBIA1300-35S-FaFT 過量表達載體:根據終載體pCAMBIA1300-35S的圖譜設計Kpn I-XbaI為插入位點并合成引物并擴增,操作步驟按試劑盒說明書進行。PCR反應體系及條件:2×PCR Buffer for KOD FX Neo 25 μL,0.01 mol/L dNTP Mix 1 μL,KOD FX Neo(1U/μL)1 μL,cDNA 第 一鏈 5 μL,primer F(10×)1.5 μL,primer R(10×)1.5 μL,PCR-Grade Water 15 μL ;預變性 98℃ 5 min,35個循環(98℃ 10 s,55℃ 30 s,68℃ 30 s),68℃ 延伸10 min。經檢測合格后與pCAMBIA1300-35S載體進行體外連接轉化,再將轉化出來的單菌落通過搖菌后用空載體的通用引物進行菌液PCR鑒定,最后將經過菌液PCR鑒定的陽性菌液進行測序。
農桿菌介導的擬南芥遺傳轉化:常規方法種植野生型擬南芥Ler和突變體ft擬南芥:選取飽滿的野生型擬南芥種子,先用70%的無水乙醇消毒,震蕩離心后用無菌水沖洗,重復5次。再用0.7%的次氯酸鈉溶液震蕩混勻后靜置15 min,離心吸除上清液,繼續用無菌水沖洗3次。消毒完畢后將種子晾干,均勻點播在MS培養基上,封口。將MS培養基置于光照培養箱中(光照16 h/d,黑暗8 h/d,溫度22℃)。待生長一周后,擬南芥幼苗轉移到營養土與蛭石比為1∶1的花盆中。定期澆水。將農桿菌菌液擴大培養60 mL。4 500 r/min,10 min離心菌體,用侵染液重懸菌體并使得菌體的OD600到達0.8左右。將pCAMBIA1300-35S-FaFT過量表達載體轉化野生型擬南芥Ler和突變體ft獲得FaFT基因過量表達植株和FT基因功能補償轉基因植株。取生長狀況良好的野生型擬南芥(花序較多的植株,未結莢)的花序浸入到菌體侵染液中3 min。結束后讓侵染株系在暗環境下處理1 d。次日轉移到正常生長條件下。相隔一周后侵染第2次。正常生長澆水等待收獲T0代種子。每個處理及對照各9株,記錄轉基因株和對照株開花時間,蓮座葉數量。
教師在寫英語作文評價時要有針對性,應該因人而異,因材施教。學生的英語基礎不一樣,衡量的標準也應不同,教師一定要把握好評價的尺度。做到既要糾正學生的錯誤,也要鼓勵學生繼續寫作。不同水平的學生也應該采取不同的評價標準,對于英文寫作水平較高的學生,要表揚中有指正,對于中等水平的學生,教師要以鼓勵為主,對于那些不擅長寫英語作文的學生,要盡量從內容或者形式上,找出其閃光點,比如對幾個準確的詞語,幾句符合語法規則的句型做出標識,并加以贊揚,激起學生寫作的興趣。
轉基因植株的陽性初步篩選:收獲的T0代種子經過烘干無菌消毒洗滌后均勻鋪具有潮霉素抗性(40 mg/L)的MS培養基上,春化3 d后轉移到正常條件下生長。觀察根的生長。一般陽性株會正常發芽、生根、葉片舒展,而非轉基因株系只有發芽,無根、無葉片。挑取選擇培養基上的正常生長的幼苗轉移到不加抗性的MS培養基上,待植株生長3-5 d左右可移栽到小花盆土中篩選T1代植株種子,常規種植T1代轉基因擬南芥種子,繼續篩選獲得T2代植株。每個處理及對照各9株都置于培養箱中培養(光照16 h/d,黑暗8 h/d,22℃),記錄轉基因株和對照開花時間和蓮座葉數量。
2 結果
2.1 FaFT基因的序列
測序結果(圖1)顯示,高羊茅FaFT基因有完整的cDNA序列,全長1 073 bp,有長度為537 bp的開放閱讀框,編碼178個氨基酸殘基。

圖1 FaFT基因的核苷酸序列及氨基酸序列Fig. 1 Nucleotide sequence and amino acid sequence of FaFT
2.2 高羊茅開花FaFT基因的表達分析
2.2.1 FaFT基因在長日照和短日照條件下晝夜表達節律分析 從圖2-A可知,FaFT基因在長日照(Long-day,LD)條件下具有規律的晝夜震蕩且周期約為24 h。2個光周期內,在開燈后ZT4-ZT8這一階段表達量上升,到ZT8達最大值隨后逐漸下降。FaFT基因在短日照(short-day,SD)下的表達與LD下表達模式基本相似,表達高峰出現的時間都在ZT8,但表達量較LD低(圖2-B)。
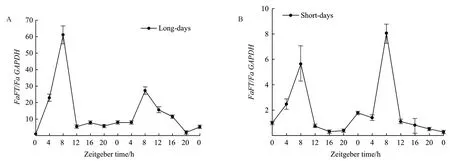
圖2 長日照(A)、短日照(B)下高羊茅FaFT基因的表達水平Fig. 2 Expression level of FaFT gene in tall fescue under long day (A) and short day (B)
2.2.2 長日照和短日照條件下轉入連續光照和連續黑暗條件下FaFT基因的晝夜表達分析 與LD相比,把高羊茅從長日照轉入連續光照后(LD-LL),FaFT基因的表達量急劇下降,在第1個光周期內ZT4-ZT12表達量很低,幾乎檢測不到,但仍維持一定的晝夜節律。不同的是表達峰值出現在ZT0,2個光周期內的表達模式基本維持一致(圖3-A)。轉入連續黑暗(LD-DD),與(LD-LL)的表達模式基本相近,FaFT基因表達量下調,表達節律減弱,2個光周期內表達峰值同樣出現在ZT0(圖3-B)。短日照轉入連續光照SD-LL下(圖3-C),FaFT基因表達的晝夜節律不明顯。第1個光周期的表達量高于第2個光周期且有2個表達峰值,分別是ZT4和ZT20。第2個光周期的表達峰值出現在ZT12,時間晚了4 h。SD-DD(圖3-D)下,FaFT基因表達模式與SD相似,但表達峰值出現時間較之晚了4 h,出現在ZT12,且表達量也基本相近。
2.2.3 光照/黑暗與黑暗/光照循環模式轉入黑暗/光照循環模式FaFT基因的晝夜表達分析 由圖可知,光照/黑暗處理(圖4-A),高羊茅FaFT基因在第一個光周期有2個表達高峰,分別是ZT8和ZT20,第2天的表達量有所上調,但在兩個光周期的變化趨勢相似。由光照/黑暗處理轉入黑暗/光照后(圖4-B),其表達量急劇降低,兩個光周期的表達高峰出現的時間分別在ZT16和ZT20。D/L下(圖4-C),FaFT在兩個周期的表達形式相似,第1個光周期ZT0-ZT8表達量很小,幾乎檢測不到,但都在ZT20達到表達高峰。由D/L轉入L/D后(圖4-D),FaFT的表達高峰在ZT4,較其他3種情況早。
2.2.4 不同生長發育階段FaFT基因的晝夜表達節律分析 長日照條件下,FaFT基因在不同發育時期葉片中的表達模式基本相同,在各個發育時期葉片中都有表達。苗期(圖5-A)、分蘗期(圖5-B)、孕穗期(圖5-D)3個時期的表達規律基本一致,表達量相近,并且2個光周期內表達高峰出現的時間都出現在ZT4。抽穗期(圖5-C)FaFT基因在孕穗期葉片中的表達量高于其他3個時期,2個光周期內表達高峰出現在ZT12、ZT16,比其他3個時期的表達高峰出現的時間晚。總的來說,FaFT基因在長日照條件下4個不同時期的表達模式基本相同,呈現一定的晝夜節律性。
2.3 FaFT的亞細胞定位分析
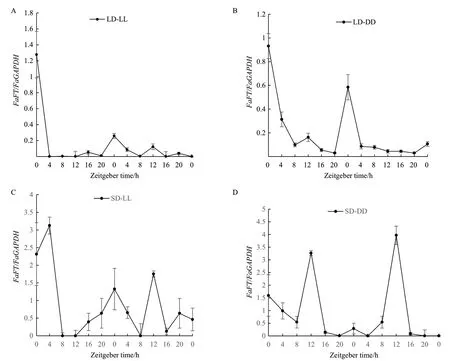
圖3 長日照轉連續光照(A)和連續黑暗(B)、短日照轉連續光照(C)和連續黑暗(D)高羊茅FaFT基因的表達水平Fig.3 Expression level of FaFT gene of tall fescue from sunlight to continuous light (A) and continuous darkness (B) based on long day, continuous light (C) and continuous darkness (D) based on short day
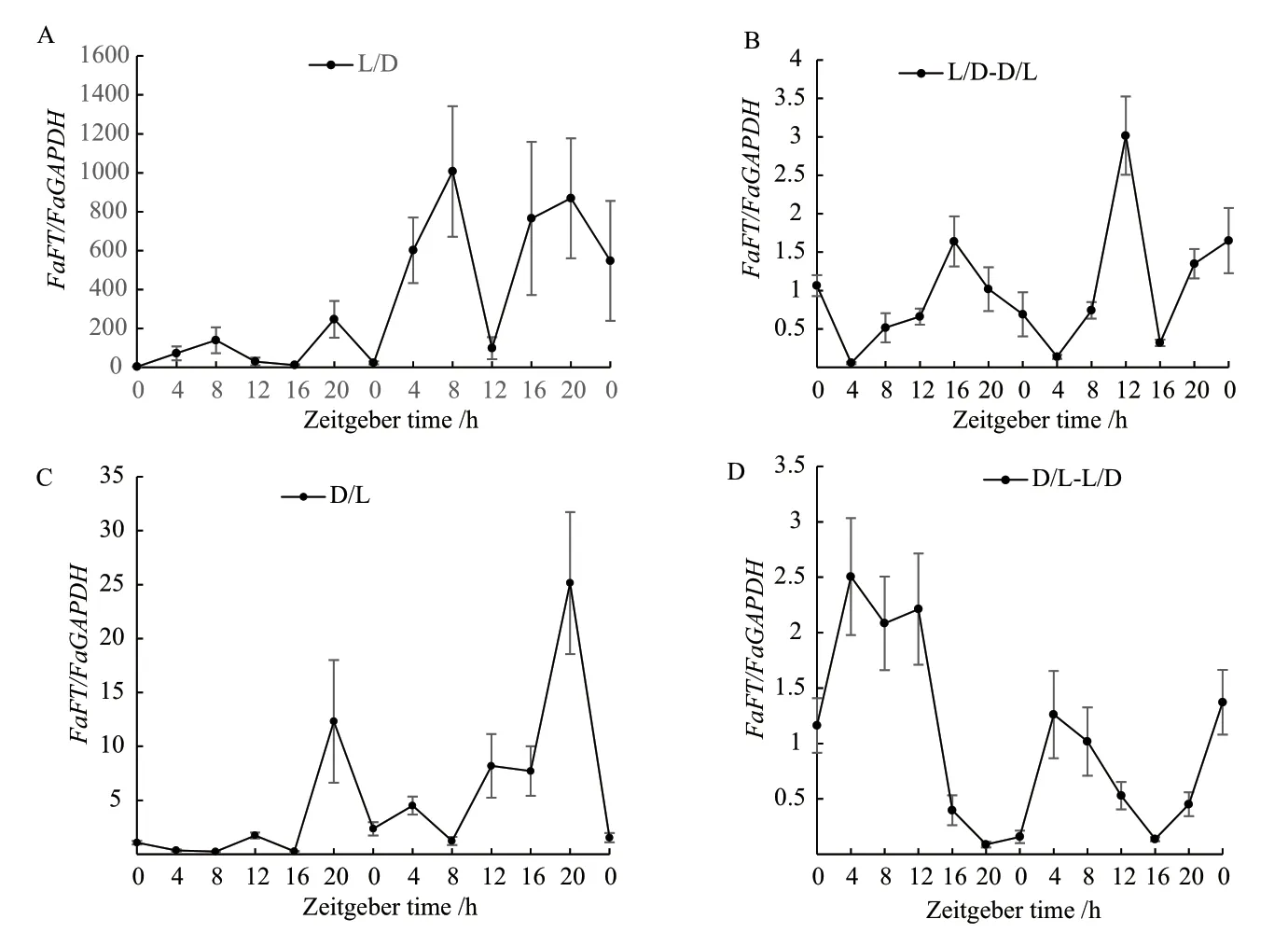
圖4 高羊茅在光照/黑暗(A)、光照/黑暗-黑暗/光照(B)、黑暗/光照(C)、黑暗/光照-光照/黑暗(D)下FaFT基因的表達水平Fig.4 Expression level of FaFT gene in tall fescue under light/dark (A), light/dark-dark/light (B),dark/light (C), dark/light-light/dark (D)
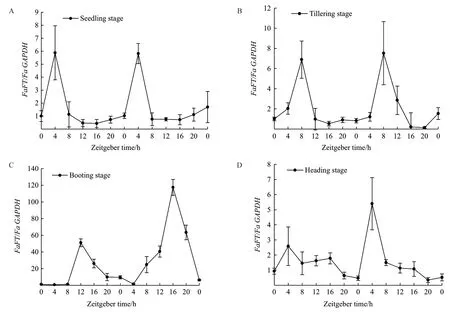
圖5 高羊茅FaFT基因在苗期(A)、分蘗期(B)、孕穗期(C)、抽穗期(D)的表達分析Fig. 5 Expression analysis of the FaFT gene of tall fescue at the seedling stage (A), tillering stage(B), booting stage (C) and heading stage (D)
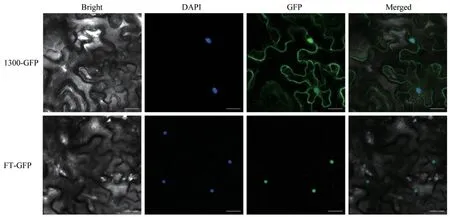
圖6 FaFT在煙草表皮細胞中的表達Fig.6 FaFT expression in tobacco epidermal cells
2.4 FaFT互作蛋白FD的初步驗證
FT一般與FD形成復合物發揮作用,利用酵母雙雜交技術探索FT與FD之間的相互作用,并用相應的培養基來檢測是否轉化成功。如圖7所示,酵母雙雜交結果顯示所有共轉BD和AD載體的AH109菌株在二缺培養基上都長出了克隆,說明共轉化成功;將SD/-Leu/-Trp培養基上的克隆挑取至SD/-Ade/-His/-Leu/-Trp平皿中培養發現,除了共轉化陽性對照質粒的AH109長出克隆外,而FaFD/FaFT實驗組也長出克隆;將SD/-Leu/-Trp上的克隆挑取至含有 X-α-Gal的 SD/-Ade/-His/-Leu/-Trp 上培養發現除了共轉化陽性對照質粒變藍,FaFD/FaFT實驗組也變藍,此實驗結果說明FaFD蛋白和FaFT蛋白有潛在互作。
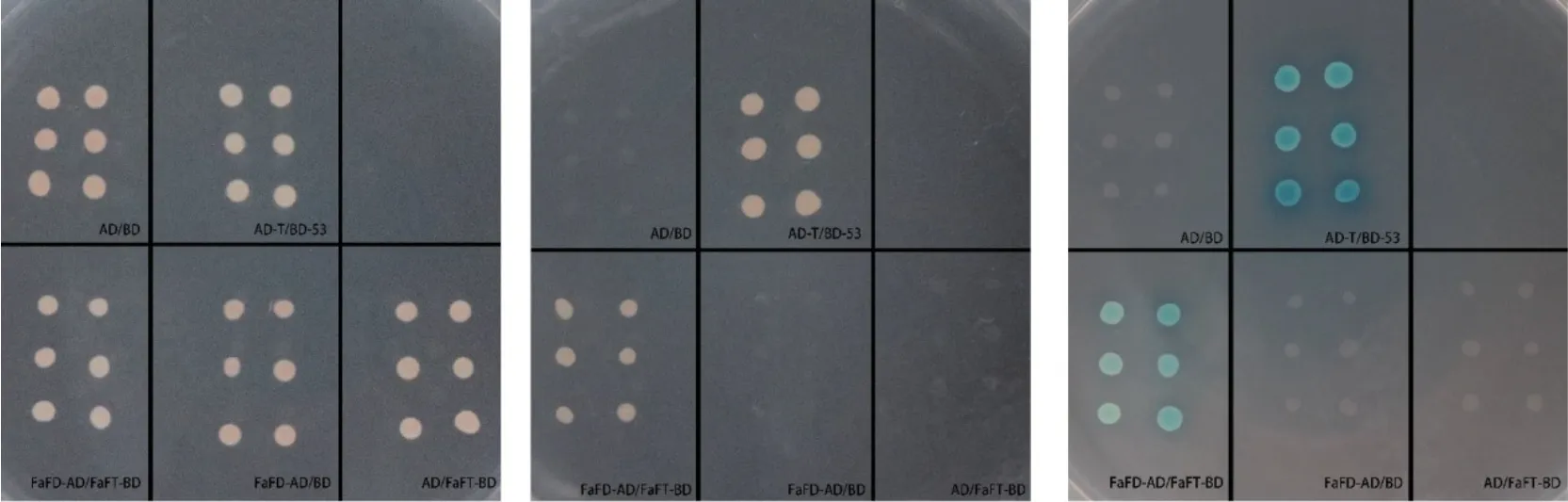
圖7 FaFT與FD相互作用的篩選Fig.7 Screening of interaction between FaFT and FD
2.5 BiFC驗證
利用BiFC技術進一步驗證FaFT與FD互作的真實性。將FaFT-pSPYCE-35S與YFP的N-端片段(1-155aa)融合,將FD-pSPYNE-35S與YFP的C-端片段(156-239aa)融合,通過農桿菌介導轉化在煙草表皮細胞表達。結果如圖8所示,當FaFT與FD共表達時,在表皮細胞中可觀察到黃色熒光信號,僅有FaFT或FD時并未檢測到黃色熒光信號,說明FaFT蛋白和FD蛋白能發生相互作用。該結果與酵母雙雜交結果一致。
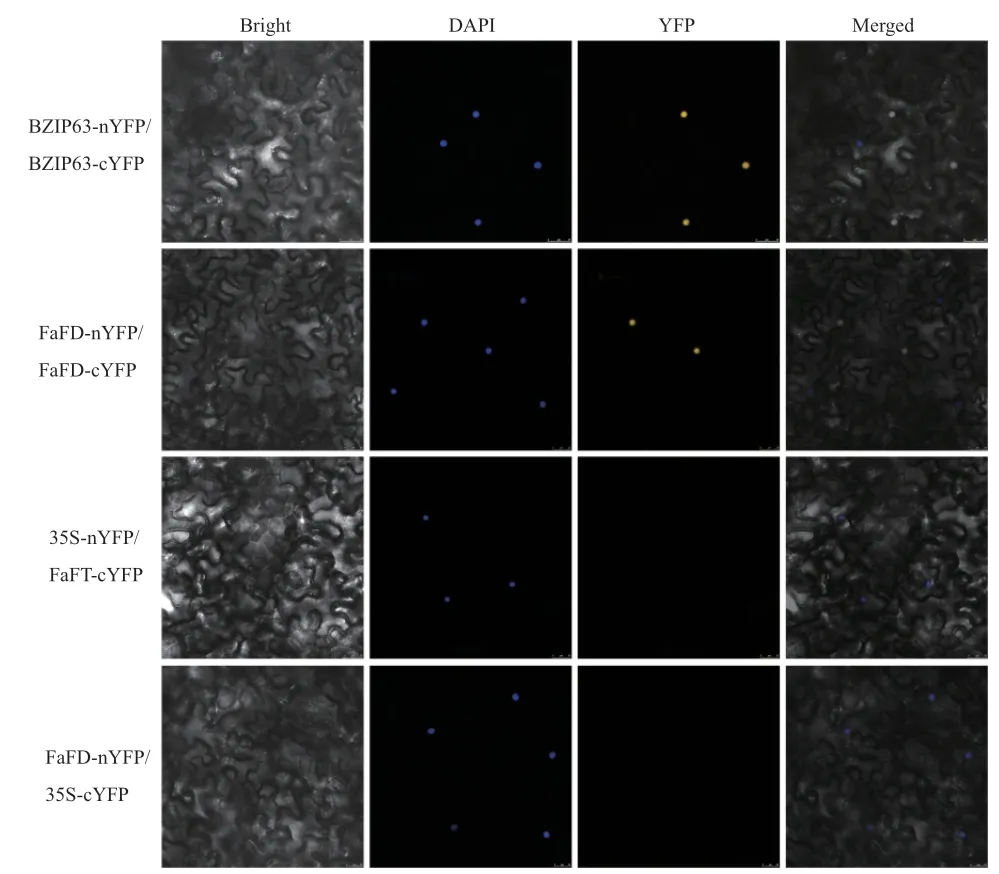
圖8 FaFT與FD的BiFC實驗驗證Fig. 8 BiFC experimental verification of FaFT and FD
2.6 高羊茅FaFT基因促進擬南芥開花
構建pCAMBIA1300-35S-FaFT過量表達載體,轉化擬南芥野生型Ler和突變體ft,長日照條件下,FaFT基因過量表達擬南芥植株表現出早花,功能補償后的突變體ft則恢復了野生型的開花表型,突變體ft本身沒有開花現象,一直停留在營養生長期,這表明FaFT基因促進擬南芥提前開花,恢復了ft突變體的晚花表型。
將擬南芥野生型和轉基因植株種植在長日照條件下,結果(圖9)顯示:在長日照條件下,轉FaFT基因擬南芥比野生型Ler開花提前約4 d,比ft突變體功能補償植株早3 d左右;與野生型蓮座葉9.89±1.7相比,過表達FaFT基因擬南芥蓮座葉數量為11.2±1.41,轉基因突變體ft蓮座葉數達到9.1±0.73植株開花。這也表明FaFT基因能促進擬南芥開花。
3 討論
FT蛋白是促進植物由營養生長到生殖生長轉變的關鍵因子,能夠整合多條開花途徑。學者對擬南芥[16]、水稻[17]、二穗短柄草[18]和小麥[2]開花基因FT的研究發現,FT蛋白的基本功能非常保守,主要參與植物開花的誘導。高羊茅FT基因cDNA全長1 073 bp,開放閱讀框537 bp,編碼178個氨基酸殘基,其與黑麥草、節節麥等禾本科牧草的氨基酸序列相似性較高,有很近的親緣關系[19]。通過亞細胞定位得出高羊茅FT基因編碼的蛋白定位在細胞核,在細胞核中發揮生理作用,也說明FaFT基因進化保守,與黑麥草、節節麥等禾本科牧草FT基因同源,可能有相似的功能。

圖9 轉基因擬南芥的開花時間、蓮座葉數量及表型Fig.9 Flowering time, rosette leaf number and phenotype of transgenic Arabidopsis
光照是影響植物開花轉變的重要因素,在合適的光照下FT基因受CO基因的誘導在葉片中表達。擬南芥在LD下能啟動開花機制,長日照下FT基因的mRNA的表達量隨著發育時間而逐漸增加,Kong等[20]在大豆中克隆了10個FT同源基因,其中GmFT2a和GmFT5a的表達量最高且受生物鐘調控,表現出一定的晝夜節律。這兩個基因在短日照條件下光照后ZT4時表達量最大,長日照開花時間晚于短日照,但二者都能促進開花。在小麥中,存在3個春化基因,VNR1、VRN2和VRN3,VRN3是與擬南芥FT基因同源,受春化和長日照的誘導從而促進開花;水稻Hd3a是擬南芥FT的同源基因,在LD下的表達量隨著春化時間逐漸上升[2]。本研究對高羊茅不同光照處理下的轉錄水平分析得出,FaFT基因在長日照、短日照下的表達量不同,長日照下表達量高于短日照,但表達高峰都出現在有光照時期;在LD-LL和LD-DD兩種條件下,FaFT基因的表達量相比LD、SD下有所降低,但表達高峰出現的時間一致(ZT0);SD-LL下,FaFT基因的表達出現2個表達高峰(ZT4和ZT0),SD-DD下的表達高峰延遲在ZT12;L/D、L/D-D/L、D/L、D/L-L/D晝夜顛倒后,雖然FaFT基因的表達高峰出現的時間不一致,但都能維持一定的規律,表現為“雙峰型”。這也說明高羊茅FaFT基因受光周期的調控。同樣,LD下,FaFT基因在不同發育時期的葉片中都有表達,在孕穗期葉片中的表達量最高。如果改變光照時間,FaFT基因葉片中的表達情況是否一致,這有待于進一步研究。
FT蛋白在葉片合成后經葉脈到達頂端分生組織(SAM)與bZIP轉錄因子FD相互作用,FT/FD復合物激活許多MADS盒基因啟動開花。14-3-3蛋白是動植物中保守的一個調節分子家族,可以與水稻頂端芽中的FT同源Hd3a直接相互作用,形成功能性復合物,轉運至細胞核[21]。因此,14-3-3蛋白可以充當支架蛋白,從而將FT與FD結合以觸發開花。本研究為驗證FT蛋白FD的作用,用酵母雙雜交和BiFC驗證了高羊茅FaFT蛋白和FD蛋白發生相互作用的真實性。
蔡宇鵬[22]在大豆中發現ft2a突變體無論是長日照還是短日照均表現為晚花,過表達GmFT2a植株開花時間都比野生型和突變體植株早,ft2a突變體的表達模式與野生型相似呈“雙峰型”,只是表達量很低。當把野生型植株先置于短日照13 d后轉入長日照,野生型植 株開花時間比LD下早,晚于SD,即短日照誘導產生的開花促進物質能在長日照下促進開花。同樣光照處理的突變體植株并未恢復晚花表型。為驗證FT基因的功能,本文成功構建FaFT基因過表達載體并轉入野生擬南芥Ler和突變體ft,均成功獲得轉基因植株。LD下,FaFT基因過量表達擬南芥植株表現出早花,突變體ft恢復了野生型的開花表型,這表明FaFT基因促進擬南芥提前開花,恢復了ft突變體的晚花表型,成功驗證了該基因的功能。
4 結論
從高羊茅轉錄組數據中成功克隆得到FaFT基因,該基因在不同光照處理下的表達能維持一定的晝夜節律,受光周期的調控。亞細胞定位發現FaFT基因編碼的蛋白定位在細胞核;通過酵母雙雜交和雙分子熒光互補實驗得出高羊茅FaFT蛋白能和FD蛋白發生相互作用;FaFT基因過表達在長日照下能促進擬南芥提前開花,且恢復突變體擬南芥開花。

