芝麻渣中蛋白提取方法的比較研究
焦曉波 王高楊 李錦紅 王曉藝 孟國慶 崔建東
(1. 天津科技大學(xué) 省部共建食品營養(yǎng)與安全國家重點實驗室,天津 300457;2. 菏澤學(xué)院農(nóng)業(yè)與生物工程學(xué)院,菏澤 274015)
作為重要的油料作物之一,芝麻營養(yǎng)成分齊全,含量豐富,主要包含蛋白質(zhì)、脂質(zhì)、碳水化合物和礦物質(zhì)[1]。其含18%-25%的蛋白質(zhì)[2],水代法制油后的副產(chǎn)物為芝麻渣,其中蛋白質(zhì)含量為38%-50%[3]。每加工1 t芝麻產(chǎn)生1 t左右的濕芝麻渣。當(dāng)前,濕麻渣大部分被當(dāng)成飼料或肥料使用[3],甚至作為廢料被丟棄,不僅易污染環(huán)境,而且造成蛋白資源的嚴(yán)重浪費(fèi)。芝麻蛋白中富含蛋氨酸和色氨酸[4],作為優(yōu)秀的植物蛋白來源,從芝麻渣中提取的芝麻蛋白可以廣泛用于食品、醫(yī)藥和化妝品等領(lǐng)域[5]。因此,將芝麻渣中的蛋白提取出來加以綜合利用,不僅能提高蛋白利用率,而且可以變廢為寶,具有廣闊的應(yīng)用前景和重要意義。
植物蛋白提取技術(shù)主要包括酶法[6]、超聲[7]和微波輔助萃取[8]等方法。由于芝麻蛋白中主要是球蛋白(約占80%)[3],水溶性較佳,但是在堿性條件下溶解度較大,所以芝麻蛋白提取方法基本采用堿溶酸沉法。雖然此法操作簡單,但由于生產(chǎn)中使用大量強(qiáng)酸、強(qiáng)堿溶液,不僅對設(shè)備造成了一定的損害,而且會產(chǎn)生大量酸堿廢水污染環(huán)境,同時強(qiáng)堿強(qiáng)酸溶液也會產(chǎn)生美拉德反應(yīng),從而使芝麻蛋白的營養(yǎng)質(zhì)量降低[9-10]。因此,需要尋找一種綠色環(huán)保、簡便且高效的提取芝麻蛋白的方法。
低共熔溶劑(Deep eutectic solvent,DES)作為一類新型的環(huán)境友好的綠色溶劑,具有合成簡單、純度高、制備成本低、毒性低和可生物降解等優(yōu)點[13-14],被認(rèn)為是傳統(tǒng)溶劑的替代品[11-12]。DES 是由氫鍵受體和氫鍵供體通過氫鍵組合而成[15],可用作多種不同溶質(zhì)的萃取溶劑,其萃取效果取決于黏度、密度、可混溶性和極性等物理性質(zhì),通常選擇低黏度的溶劑混合,便于分離[16]。隨著對DES研究的不斷深入,DES在多種生物活性分子萃取方面表現(xiàn)出很好的應(yīng)用前景[17],如 DNA 提取[18]、木質(zhì)素提取[19]、蛋白質(zhì)的提取和酚酸的萃取等[20]。Xu等[21]合成了4種DES用于提取牛血清白蛋白,并選擇了氯化膽堿-甘油作為提取溶劑,考察了DES用量、鹽濃度、蛋白質(zhì)質(zhì)量、時間、溫度和pH值等因素對萃取效果的影響,通過單因素實驗,在優(yōu)化的提取條件下,提取率達(dá)到98.16%。Bai等[22]設(shè)計合成了6種DES,并選擇氯化膽堿-草酸為最佳提取溶劑,提取鱈魚皮中的膠原蛋白肽發(fā)現(xiàn),氯化膽堿-草酸的摩爾比、提取溫度、時間和液固比對膠原蛋白肽提取率和純度有顯著影響。在最佳提取條件下,膠原蛋白及其多肽的提取率分別為91.57%和96.01%,純度分別為93.14%和100%。但利用DES從芝麻渣中提取芝麻蛋白的研究尚未見報道。本研究利用幾種DES提取制備芝麻渣中的芝麻蛋白,通過單因素實驗首先篩選出適合用于提取芝麻蛋白的DES,同時優(yōu)化了提取條件,并對比DES法和堿溶酸沉法對芝麻渣中蛋白的提取效果。
1 材料與方法
1.1 材料
1.1.1 試劑 新鮮的濕芝麻渣由河北多祥益植物油有限責(zé)任公司提供,氫氧化鈉(分析純)博歐特(天津)化工貿(mào)易有限公司;氯化膽堿(ChCl,分析純)上海晶純生化科技股份有限公司;考馬斯亮藍(lán)G-250(分析純)索萊寶生物科技有限公司;牛血清蛋白標(biāo)準(zhǔn)品 索萊寶生物科技有限公司;無水乙醇(分析純)天津市津東天正精細(xì)化學(xué)試劑廠;三水合醋酸鈉(SAT,分析純)薩恩化學(xué)技術(shù)(上海)有限公司;其他常規(guī)試劑均為分析純。
1.1.2 儀器與設(shè)備 DF-Ⅱ集熱式磁力加熱攪拌器江蘇金怡儀器科技有限公司;UV-5100紫外可見分光光度計 上海元析儀器有限公司:全自動杜馬斯定氮儀 德國Elementa公司。
1.2 方法
1.2.1 脫脂芝麻渣的制備 將濕芝麻渣放置在在陰涼、干燥通風(fēng)處自然風(fēng)干,再用粉碎機(jī)將其粉碎,過 60目篩。篩下物用正己烷脫脂。脫脂條件為固液比1∶2,溫度 55℃,攪拌時間 4 h,間歇性攪拌。冷卻至室溫,4 000 r/min離心15 min,得到的沉淀在通風(fēng)櫥晾干后再用粉碎機(jī)將其粉碎,過60目篩,即得到脫脂芝麻渣粉。
1.2.2 不同DES的制備 以ChCl為氫鍵受體,乙酸、尿素和葡萄糖為氫鍵供體的DES制備方法為:將干燥的ChCl與不同的氫鍵供體按一定的摩爾比混合,于90℃水浴中磁力攪拌至形成均一、澄清、透明的溶液。SAT-尿素的制備方法為:將醋酸鈉和尿素按照1∶2的摩爾比混合于90℃水浴中磁力攪拌至形成均一、澄清、透明的溶液。得到4種DES,分別為 ChCl-乙酸、ChCl-尿素、ChCl-葡萄糖和SAT-尿素。
1.2.3 四種DES提取芝麻蛋白 稱取粉碎的脫脂芝麻渣4份,各0.100 g置于錐形瓶中,加1 mL水溶解,分別向其中加入5 mL制備好的DES,在75℃水浴下磁力攪拌3 h,離心后,利用考馬斯亮藍(lán)法測定上清液蛋白質(zhì)的含量。
1.2.4 利用不同的有機(jī)溶劑從DES中析出蛋白質(zhì) DES蛋白浸提液中蛋白分離采用有機(jī)溶劑沉淀法。本實驗采用的有機(jī)溶劑為乙醇、甲醇和丙酮。取蛋白浸提液1 mL,分別加入不同的有機(jī)溶劑4 mL,靜置30 min,離心,收集芝麻蛋白沉淀。
1.2.5 SAT-尿素體系提取條件對芝麻蛋白提取率的影響
1.2.5.1 固液比對芝麻蛋白提取率的影響 稱取粉碎的脫脂芝麻渣5份,各0.100 g置于錐形瓶中,加1mL水溶解均勻,按照不同的固液比(1∶30、1∶50、1∶80、1∶100和1∶150)向其中加入一定體積(3 mL、5 mL、8 mL、10 mL和15 mL)SAT-尿素,在75℃水浴條件下磁力攪拌180 min,6 000 r/min離心10 min后,得到芝麻蛋白浸提液,利用考馬斯亮藍(lán)法測定浸提液蛋白質(zhì)的含量。
1.2.5.2 提取時間對芝麻蛋白提取率的影響 稱取粉碎的脫脂芝麻渣5份,各0.100 g置于錐形瓶中,加1 mL水溶解均勻,向其中加入5 mLSAT-尿素,在75℃水浴條件下磁力攪拌(120 min、180 min、240 min、300 min和 360 min),6 000 r/min離心 10 min后,得到芝麻蛋白浸提液,利用考馬斯亮藍(lán)法測定浸提液蛋白質(zhì)的含量。
1.2.5.3 提取溫度對芝麻蛋白提取率的影響 稱取粉碎的脫脂芝麻渣5份,各0.100 g置于錐形瓶中,加1 mL水溶解均勻,向其中加入5 mL SAT-尿素,在一定溫度(45、55、65、75和85℃)下水浴條件下磁力攪拌180 min,6 000 r/min離心10 min后,得到芝麻蛋白浸提液,利用考馬斯亮藍(lán)法測定浸提液蛋白質(zhì)的含量。
1.2.5.4 提取次數(shù)對芝麻蛋白提取率的影響 稱取粉碎的脫脂芝麻渣5份,各0.100 g置于錐形瓶中,加1 mL水溶解均勻,再加入5 mL SAT-尿素,在75℃水浴條件下磁力攪拌180 min,6 000 r/min離心10 min后得到芝麻蛋白浸提液,利用考馬斯亮藍(lán)法測定浸提液蛋白質(zhì)的含量。利用乙醇析出芝麻蛋白后,剩余的芝麻渣以上述的提取方法進(jìn)行二次提取。
1.2.6 SAT-尿素體系在芝麻蛋白提取過程中的重復(fù)使用性 稱取粉碎的脫脂芝麻渣0.100 g置于錐形瓶中,加1 mL水溶解均勻,向其中加入5 mL SAT-尿素,在75℃的磁力攪拌水浴鍋中攪拌3 h,冷卻至室溫后離心,向蛋白浸提液中加入4倍體積的無水乙醇,混合均勻后靜置、離心,將得到的沉淀物用蒸餾水洗滌后離心、凍干,得到芝麻蛋白。將離心后得到的SAT-尿素/乙醇混合溶液收集,利用旋轉(zhuǎn)蒸發(fā)儀將其中的乙醇和蒸餾水蒸出,收集SAT-尿素和乙醇。利用回收的SAT-尿素和乙醇對首次提取后的芝麻渣進(jìn)行再次提取,具體方法為:將提取過的芝麻渣用1 mL蒸餾水混合均勻,置于錐形瓶中,再加入5 mL回收的SAT-尿素,在75℃的磁力攪拌水浴鍋中攪拌3 h,冷卻至室溫后離心,將浸提液中加入4倍體積的乙醇,靜置30 min后離心,將得到的沉淀用蒸餾水洗滌后凍干,得到芝麻蛋白。重復(fù)上述提取過程,再次回收的SAT-尿素用于提取新的芝麻渣,考察SAT-尿素的重復(fù)利用性。
1.2.7 堿溶酸沉法提取芝麻蛋白
1.2.7.1 單因素考察堿溶酸沉法提取芝麻蛋白的效果 稱取粉碎的脫脂芝麻渣0.100 g置于錐形瓶中,加入一定量的NaOH和蒸餾水,在一定溫度的水浴中磁力攪拌一段時間,使蛋白充分溶出。冷卻至室溫后,5 000 r/min 離心10 min,所得上清液即為芝麻蛋白質(zhì)提取液。取上清液用0.1 mol/L HCL溶液調(diào)節(jié)pH值至等電點使蛋白沉淀,5 000 r/min離心10 min,收集沉淀,調(diào)pH至7.0,經(jīng)真空冷凍干燥后,即得芝麻蛋白。分別考察加入NaOH的量(4%、7%、10%、13%、16%、19%和22%),固液比(1∶10、1∶15、1∶20、1∶25和 1∶30),提取溫度(50、55、60、65、70、75和 80℃)和提取時間(0.5 h、1 h、2 h、3 h、4 h和5 h)對芝麻蛋白提取率的影響。
1.2.7.2 利用等電點法沉淀芝麻蛋白 取堿提后的芝麻蛋白提取液50 mL,用 0.l mol/L HCL調(diào)節(jié)pH為7.5,取上清液調(diào)至不同pH值(2.5、3、3.5、4和4.5)以沉淀蛋白質(zhì),5 000 r/min離心10 min后,測定上清液中蛋白質(zhì)含量,上清液中蛋白質(zhì)濃度最低時的pH即為蛋白質(zhì)的等電點。
1.2.8 浸提液中蛋白質(zhì)含量測定 采用考馬斯亮藍(lán)法測定浸提液中的蛋白質(zhì)含量,以牛血清白蛋白為標(biāo)準(zhǔn)品,繪制標(biāo)準(zhǔn)曲線,建立的回歸方程為 A =7.308 6 C + 0.021 6(R2= 0.996 5),其中 A 為考馬斯亮藍(lán)在595 nm處的吸光度,C為蛋白質(zhì)質(zhì)量濃度(mg/mL)。通過計算可得浸提液中蛋白質(zhì)含量,用以計算蛋白提取率。蛋白提取率按照下式進(jìn)行計算:

式中,樣品中蛋白含量利用杜馬斯燃燒定氮法測得。
1.2.9 蛋白純度的測定 利用杜馬斯燃燒定氮法測定芝麻渣及其蛋白成品中的蛋白含量[23]。
2 結(jié)果
2.1 四種DES的制備及提取芝麻蛋白的效果
按照表1的制備條件,分別制備了ChCl-乙酸、ChCl-尿素、ChCl-葡萄糖和SAT-尿素,均為均一、透明、澄清液體。利用這4種DES從芝麻渣中提取芝麻蛋白,結(jié)果如圖1所示。
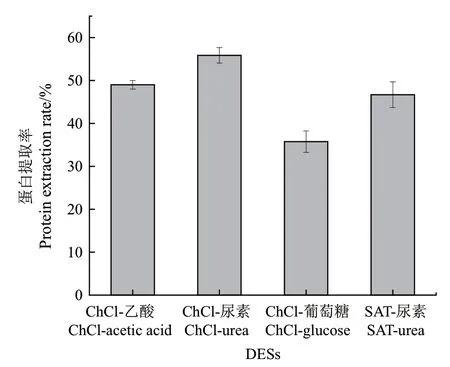
圖1 四種低共熔溶劑提取芝麻渣中的芝麻蛋白Fig. 1 Extraction of sesame protein from sesame residue with 4 deep eutectic solvents
ChCl-乙酸、ChCl-尿素、ChCl-葡萄糖和SAT-尿素均可以提取出芝麻渣中的芝麻蛋白,蛋白提取率分別為49%、55.86%、35.75%和46.69%。由結(jié)果可知,4種DES提取芝麻蛋白的提取率大小為ChCl-尿素>ChCl-乙酸>SAT-尿素>ChCl-葡萄糖。
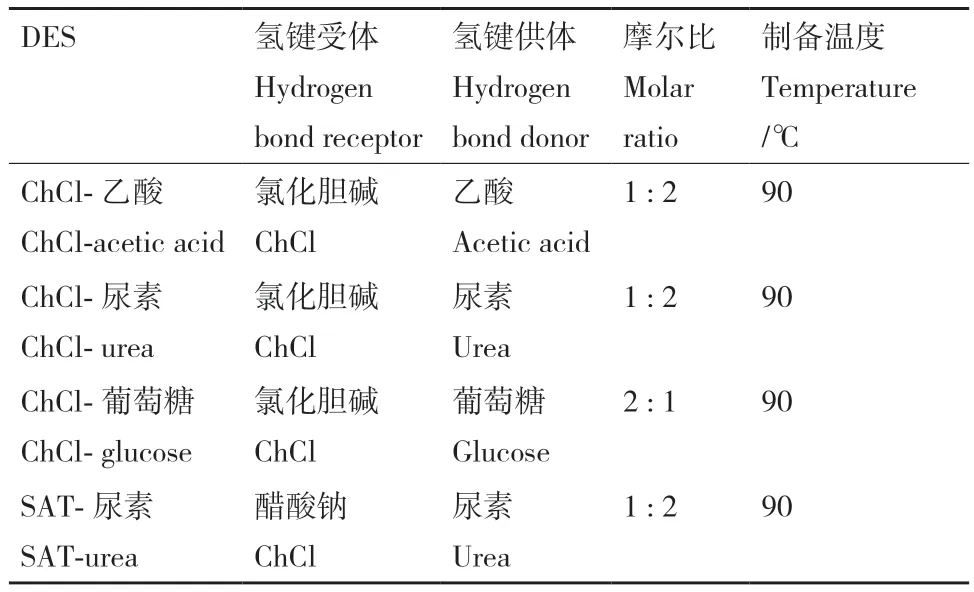
表1 不同低共熔溶劑的制備條件Table 1 Preparation conditions of different deep eutectic solvents
2.2 利用有機(jī)溶劑從DES中析出蛋白質(zhì)
分別向ChCl-乙酸、ChCl-尿素、ChCl-葡萄糖、SAT-尿素蛋白浸提液中加入甲醇、乙醇、丙酮后,均可互溶。但是實驗結(jié)果表明,使用有機(jī)溶劑不能將ChCl-乙酸、ChCl-尿素、ChCl-葡萄糖蛋白浸提液中的蛋白析出,只有SAT-尿素體系蛋白浸提液加入乙醇后,有大量絮狀沉淀產(chǎn)生,但加入甲醇或丙酮卻不能析出蛋白。
2.3 DES法提取芝麻蛋白的單因素實驗結(jié)果
2.3.1 固液比對芝麻蛋白提取率的影響 如圖2所示,SAT-尿素體系在不同固液比(1∶30、1∶50、1:80、1∶100和1∶150)下蛋白提取率分別為24.15%、50.00%、46.43%、44.24%和 33.00%, 因此選擇最佳固液比為1:50。
2.3.2 提取時間對芝麻蛋白提取率影響 如圖3所示,隨著提取時間增加,蛋白提取率呈現(xiàn)先上升后下降,然后趨于穩(wěn)定的趨勢,在180 min時達(dá)到最大,因此選擇最佳提取時間為180 min。
2.3.3 提取溫度對芝麻蛋白提取率的影響 如圖4所示,SAT-尿素體系在不同溫度(45、55、65、75和85℃)下蛋白提取率隨著溫度的升高,蛋白質(zhì)提取率逐漸增大,當(dāng)提取溫度達(dá)到75℃時蛋白質(zhì)提取率達(dá)到最大(49.54%),之后降低,因此,初步確定最佳提取溫度為75℃。
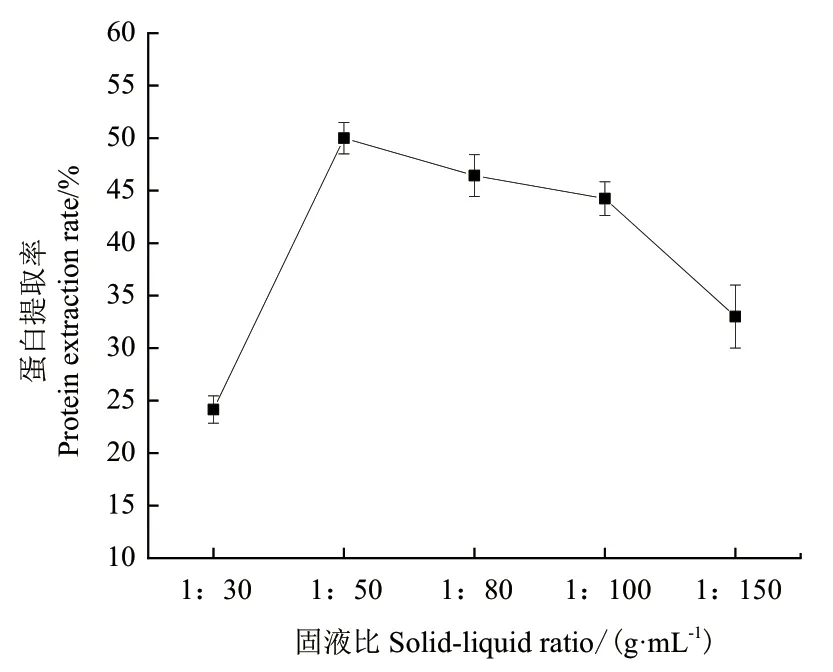
圖2 不同固液比對SAT-尿素體系提取芝麻渣中蛋白的影響Fig. 2 Effect of different solid-liquid ratios on the extraction of protein from sesame residue by SAT-urea system
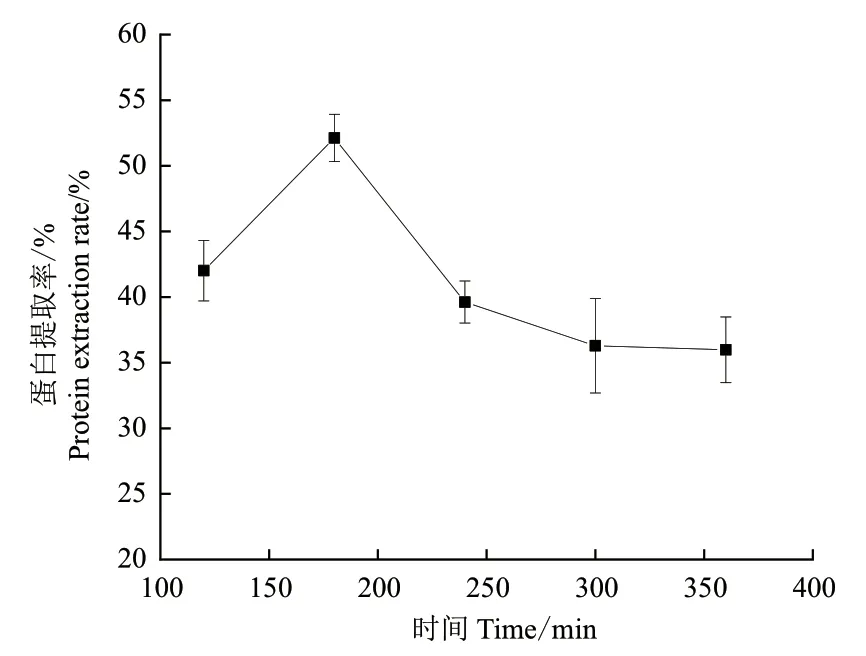
圖3 不同提取時間對SAT-尿素體系提取芝麻渣中蛋白的影響Fig. 3 Effect of different extraction time on the extraction of protein from sesame residue by SAT-urea system
2.3.4 提取次數(shù)對提取率的影響 如表2所示,一次提取芝麻蛋白的提取率在50%左右,為了將芝麻渣中剩余蛋白提取出來,從而增加原料的利用率,我們利用新鮮的SAT-尿素體系將一次提取后的芝麻渣廢渣進(jìn)行二次提取。
2.3.5 SAT-尿素的重復(fù)利用性 重復(fù)3次DES提取芝麻蛋白實驗步驟,共提取3.000 g芝麻渣中的芝麻蛋白(圖5),單次提取3.000 g芝麻蛋白的提取率為49.54%。重復(fù)利用第1次提取1.000 g芝麻渣中蛋白的提取率為49.23%,第2次提取剩余芝麻渣中蛋白,即二次蛋白提取率為17.73%;第3次提取1.000 g芝麻渣中蛋白的提取率為43.60%,第4次提取剩余芝麻渣中蛋白的提取率為11.93%;第5次提取1.000 g芝麻渣中蛋白的提取率為33.76%,第6次提取剩余芝麻渣中蛋白提取率為7.99%。重復(fù)使用6次SAT-尿素提取芝麻蛋白的總提取率為54.74%。
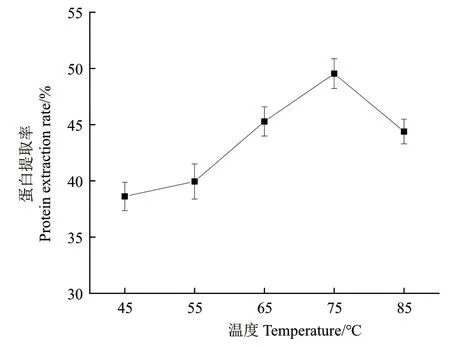
圖4 不同溫度對SAT-尿素體系提取芝麻渣中蛋白的影響Fig. 4 Effect of different temperatures on the extraction of protein from sesame residue by SAT-urea system
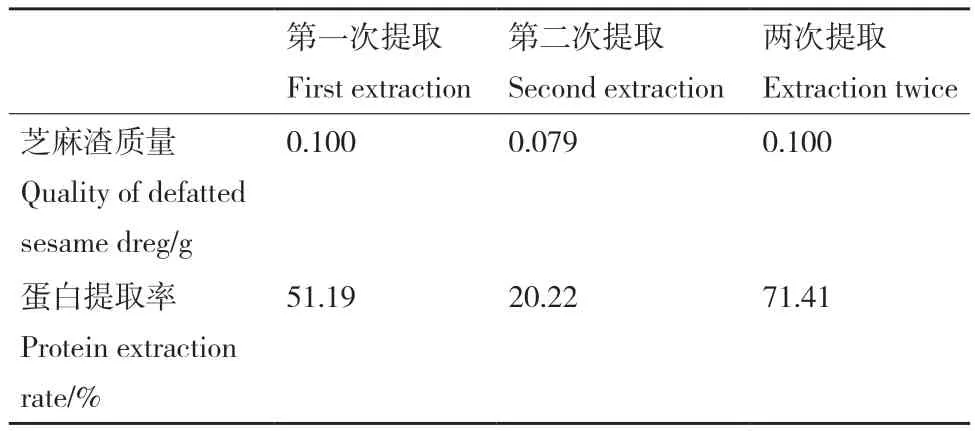
表2 提取次數(shù)對提取率的影響Table 2 Effect of extraction times on extraction rate
2.4 堿溶酸沉法提取芝麻蛋白的條件優(yōu)化
2.4.1 氫氧化鈉含量對蛋白提取率的影響 由圖6可知,氫氧化鈉添加量在4%-19%時,蛋白提取率隨氫氧化鈉添加量的增大而提高,當(dāng)氫氧化鈉添加量為19%時,蛋白提取率達(dá)到最大;此后隨著加堿量的繼續(xù)增大,蛋白質(zhì)提取率有降低趨勢,而且過高的加堿量對芝麻蛋白的生物活性有一定的影響,因此選擇加堿量為19%作進(jìn)一步優(yōu)化。
2.4.2 溫度對芝麻蛋白提取率的影響 當(dāng)提取溫度在50-70℃時,芝麻蛋白提取率隨溫度的增加而提高。當(dāng)溫度在70℃時,蛋白提取率達(dá)到最高為73.07%(圖7),故選擇溫度為70℃作進(jìn)一步優(yōu)化。
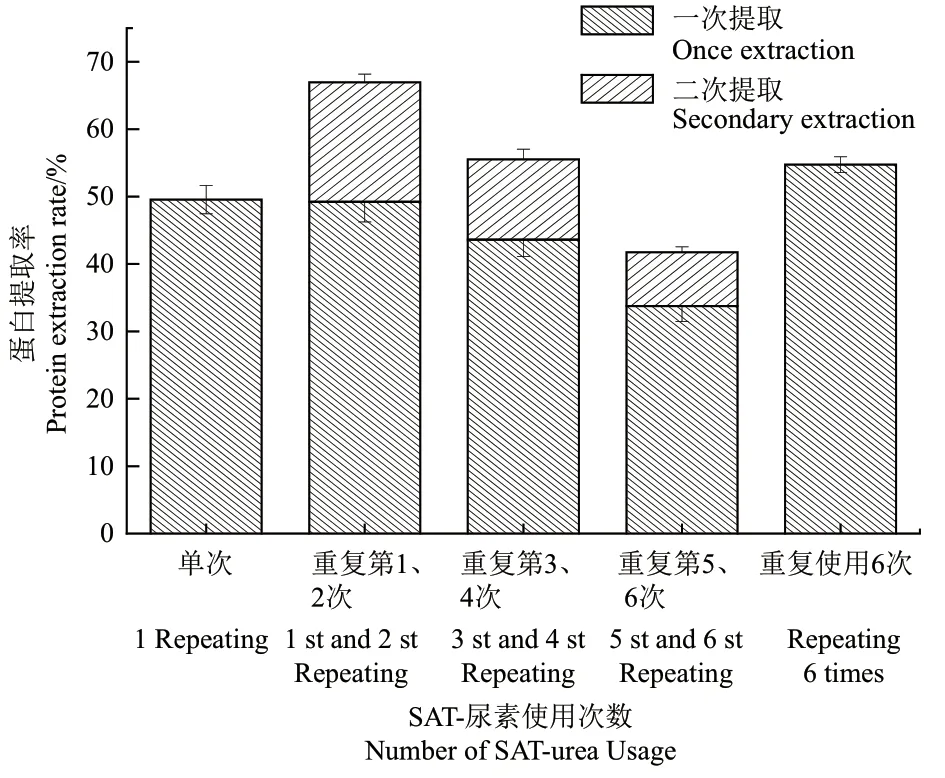
圖5 SAT-尿素體系重復(fù)使用對提取芝麻渣中蛋白的影響Fig. 5 Effect of the reusability of SAT-urea system on the extraction of protein from sesame residue
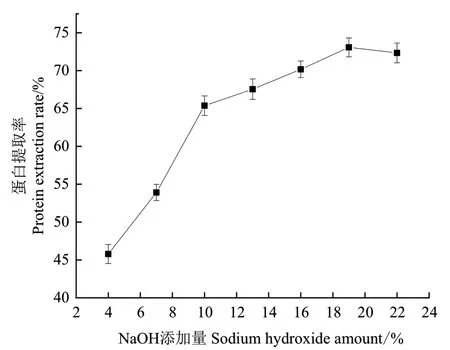
圖6 氫氧化鈉添加量對蛋白提取率的影響Fig. 6 Effect of sodium hydroxide addition amount on protein extraction rate
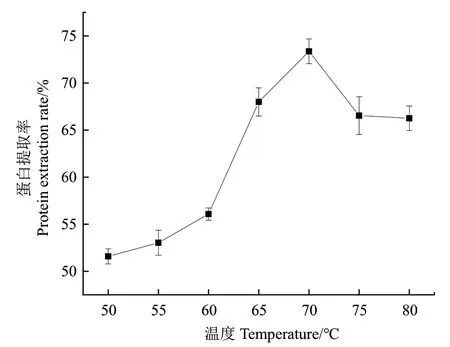
圖7 溫度對蛋白提取率的影響Fig. 7 Effect of temperature on protein extraction rate
2.4.3 提取時間對蛋白提取率的影響 由圖8可以看出,當(dāng)提取時間為0.5 h-3 h時,芝麻蛋白提取率隨時間的增加而提高。在3 h時,蛋白提取率最大。當(dāng)提取時間延長為3 h-5 h時,芝麻蛋白提取率隨時間變化不大,因此選擇提取時間為3 h作進(jìn)一步優(yōu)化。
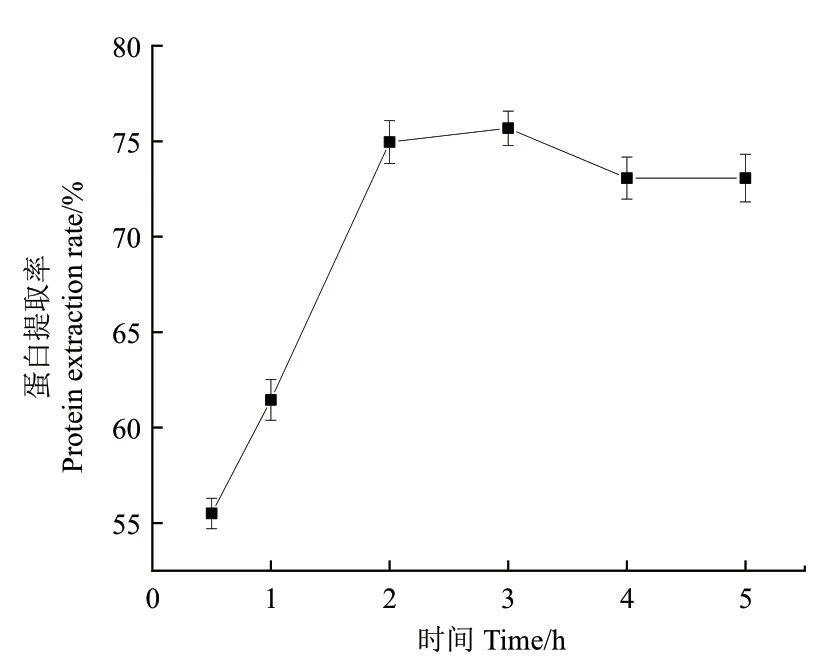
圖8 不同提取時間對蛋白提取率的影響Fig. 8 Effect of different extraction time on protein extraction rate
2.4.4 不同固液比對蛋白提取率的影響 由圖9可知,固液比在1∶10-1∶30時,蛋白提取率隨固液比的增大而提高,當(dāng)固液比為1∶30時,蛋白提取率達(dá)到最大,為78.17%。但是與固液比為1∶25時的提取率(75.27%)相差較小。考慮到過大的固液比會造成后續(xù)分離蛋白較大的負(fù)擔(dān),且廢液量也會隨著固液比的提高而增加。因此選擇固液比為1∶25作進(jìn)一步優(yōu)化。
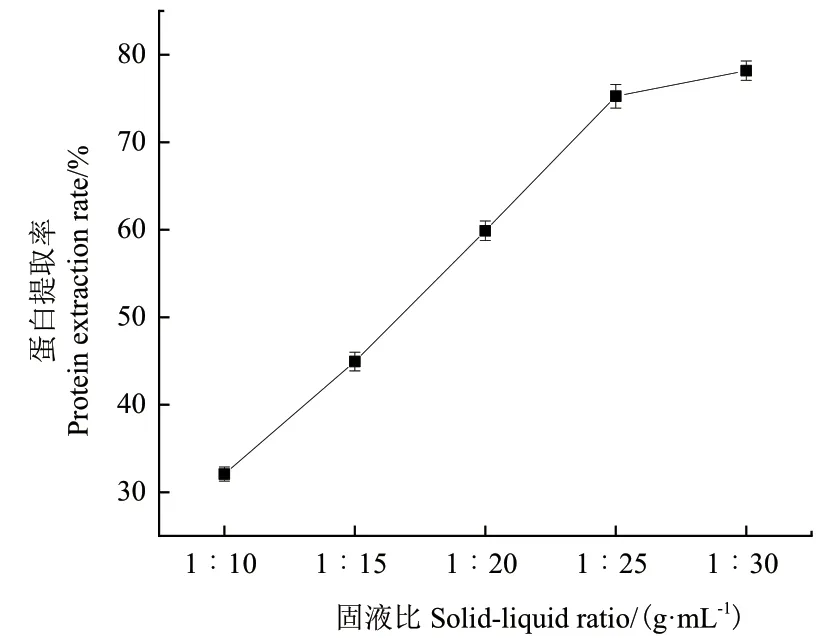
圖9 不同固液比對蛋白提取率的影響Fig. 9 Effect of different solid-to-liquid ratios on protein extraction rate
2.4.5 利用等電點法沉淀芝麻蛋白 由圖10可以看出,芝麻蛋白在pH 3.5時溶解度最小,最易形成沉淀物,因此確定蛋白質(zhì)等電點為3.5。
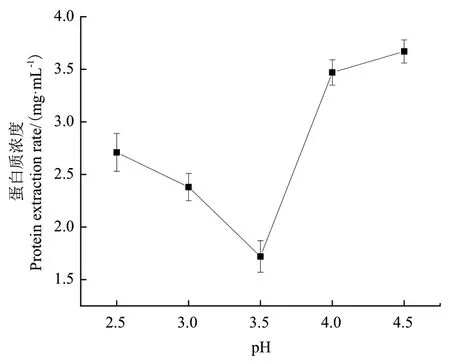
圖10 芝麻蛋白等電點測定Fig. 10 Isoelectric point determination of sesame protein
以芝麻加工后的副產(chǎn)物芝麻渣為原料,利用堿溶酸沉法提取芝麻蛋白。通過單因素試驗,考察了氫氧化鈉添加量、提取溫度、提取時間和固液比對蛋白提取率的影響,確定了堿溶酸沉法最佳工藝條件:氫氧化鈉添加量19%、溫度70℃、時間2 h、固液比1∶25、酸沉pH為3.5。在此條件下,芝麻蛋白提取率為73.86%,蛋白純度為83.375%。
2.5 兩種芝麻蛋白提取方法的比較
在各自最優(yōu)提取條件下,比較了兩種芝麻蛋白提取方法的提取率和蛋白純度,結(jié)果見表3。堿溶酸沉法蛋白提取率比低共熔溶劑法高2.45%,但是后者提取蛋白的純度比前者高6.058%,并且在相同干燥條件下后者提取的蛋白顏色較深。可以看出,由于芝麻蛋白中大多為堿溶性蛋白,在最佳提取條件下,堿提效果較好;但該方法局限于堿溶性蛋白的提取,不適合提取酸溶性蛋白,其雖然操作簡單,但提取過程中使用大量強(qiáng)堿、強(qiáng)酸溶液,不僅腐蝕設(shè)備,而且處理不當(dāng)還會對環(huán)境造成污染。相比之下,低共熔溶劑法作為一種綠色環(huán)保的蛋白提取方法,在蛋白提取率和提取蛋白的純度等方面都表現(xiàn)出很好的效果,并且SAT-尿素具有較好的重復(fù)利用性,因此,低共熔溶劑法總體上優(yōu)于堿溶酸沉法。
3 討論
3.1 DES和有機(jī)溶劑的選擇
ChCl-乙酸、ChCl-尿素、ChCl-葡萄糖和SAT-尿素均可以從芝麻渣中提取出芝麻蛋白,其中ChCl-尿素蛋白提取率最高,然后利用有機(jī)溶劑將芝麻蛋白進(jìn)行沉淀分離。有機(jī)溶劑的加入使溶液的介電常數(shù)降低,溶質(zhì)分子之間的靜電引力增加,聚集成沉淀[24]。向4種DES蛋白浸提液中分別加入有機(jī)溶劑后,蛋白質(zhì)在DES浸提液中的溶解度變小,從而使蛋白以沉淀的形式析出[25]。
Xu等[21]研究發(fā)現(xiàn)DES對牛血清蛋白的提取率很高,他們認(rèn)為在DES萃取牛血清蛋白過程中的主要作用力是DES/蛋白質(zhì)簇集物的形成,但是通過改變體系的離子強(qiáng)度來對蛋白質(zhì)進(jìn)行反萃取的效率并不高。SAT-尿素體系蛋白浸提液加入乙醇后,有大量絮狀沉淀產(chǎn)生,原因可能是乙醇可以破壞SAT-尿素/蛋白聚集體,同時使芝麻蛋白之間的靜電引力增加,溶解度降低,從而析出芝麻蛋白。經(jīng)離心、洗滌后可得到芝麻蛋白沉淀,因此選擇SAT-尿素體系作為最佳DES用于提取芝麻蛋白。乙醇具有毒性小、氣味較小等優(yōu)點,適合用于食品加工生產(chǎn)[26-27],因此選擇乙醇作為最佳有機(jī)溶劑用于析出芝麻蛋白。
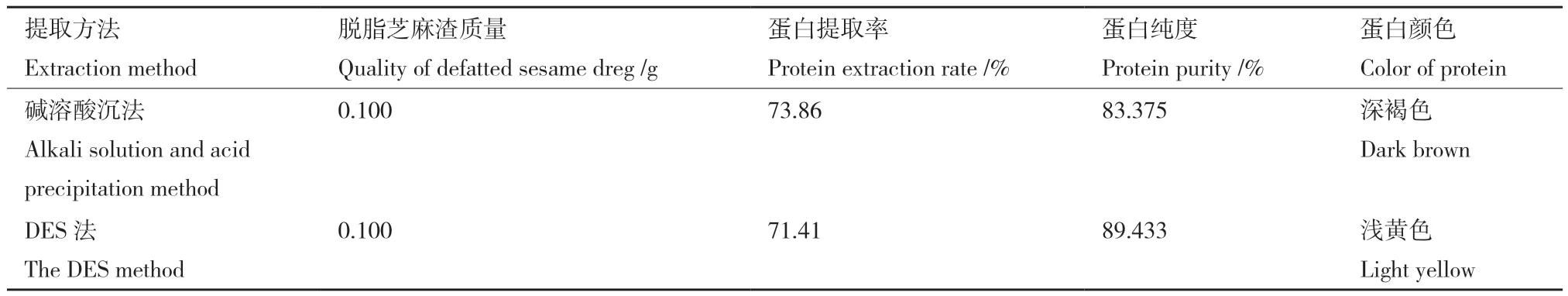
表3 兩種芝麻蛋白提取方法的比較Table 3 Comparison of two extraction methods of sesame protein
3.2 不同提取條件對DES提取芝麻蛋白的影響
3.2.1 固液比對芝麻蛋白提取率的影響 固液比會影響芝麻渣與溶劑的接觸面積,當(dāng)溶劑的體積增加時,溶劑和溶質(zhì)的接觸面積將會增大,芝麻蛋白浸出率增加;當(dāng)SAT-尿素的體積過大時,由于纖維素、半纖維素和木質(zhì)素等物質(zhì)的溶出,影響了芝麻蛋白的提取,導(dǎo)致提取率降低。并且當(dāng)溶劑體積較大時,不利于之后利用有機(jī)溶劑法析出蛋白。
3.2.2 時間對芝麻蛋白提取率的影響 在DES中較長時間地提取,會使蛋白質(zhì)分子中疏水基團(tuán)暴露于分子表面,從而發(fā)生部分聚集[28],導(dǎo)致蛋白質(zhì)在DES中的溶解度降低,使蛋白提取率降低,并且其他雜質(zhì)的溶出影響了芝麻蛋白的提取。
3.2.3 溫度對芝麻蛋白提取率的影響 溫度升高時,SAT-尿素黏度降低,溶解蛋白的能力增強(qiáng),但在提取溫度較高條件下,其他雜質(zhì)的溶出影響了芝麻蛋白的提取。隨著溫度繼續(xù)增加,蛋白提取率開始下降,而且溫度過高也會影響蛋白質(zhì)的結(jié)構(gòu),導(dǎo)致蛋白質(zhì)變性,同時在高溫條件下可能會使其他雜質(zhì)的溶出,影響了芝麻蛋白溶出率和純度。
3.3 SAT-尿素的重復(fù)利用性
DES作為一種新型、綠色環(huán)保的低共熔溶劑,如果能將其回收重復(fù)使用將有利于降低生產(chǎn)成本。基于SAT-尿素體系具有較低的揮發(fā)性,我們采用旋蒸的方式將SAT-尿素/乙醇混合物中的乙醇從SAT-尿素分離出來,得到的SAT-尿素和乙醇分別可以再次用于芝麻蛋白的提取和沉淀,這樣不僅能降低成本,且可以提高芝麻蛋白提取率。
SAT-尿素在重復(fù)使用6次的過程中,芝麻蛋白提取率逐漸降低,但總提取率高于單次提取效果,并且單次提取芝麻蛋白所需要的SAT-尿素的體積為重復(fù)使用提取的3倍。雖然在萃取蛋白質(zhì)的重復(fù)使用過程中會導(dǎo)致SAT-尿素的蛋白萃取效率下降,但較好的重復(fù)使用性、和蛋白提取率,以及較低的使用量對于降低工業(yè)化應(yīng)用成本是有利的。
3.4 DES法和堿溶酸沉法的比較
研究了兩種從芝麻渣中提取芝麻蛋白的方法:堿溶酸沉法和DES法,堿溶酸沉法是目前比較常見的植物蛋白提取方法,該方法操作簡單,有較好的蛋白提取效果,但提取過程中使用強(qiáng)酸、強(qiáng)堿溶液,不僅對設(shè)備造成了一定的損害,對環(huán)境造成污染,而且強(qiáng)堿、強(qiáng)酸溶液也會造成芝麻蛋白的生物活性降低甚至失活。因此,提出并優(yōu)化了一種利用低共熔溶劑提取芝麻蛋白的方法,該工藝表現(xiàn)出較好的芝麻蛋白提取效果。芝麻蛋白提取率可達(dá)71.41%,所制備的芝麻蛋白純度為89.433%,提取的芝麻蛋白純度比堿溶酸沉法高6.058%,并且SAT-尿素表現(xiàn)出較好的重復(fù)利用性,無廢液的產(chǎn)生,相比于堿溶酸沉法,DES法更高效和環(huán)保。因此,這些結(jié)果表明DES法是一種新型綠色的植物蛋白提取方法。該研究為植物蛋白的綠色提取提供了新思路。
4 結(jié)論
堿溶酸沉法最佳工藝條件:氫氧化鈉添加量19%、溫度70℃、時間2 h、固液比1∶25、酸沉pH為3.5。在此條件下,芝麻蛋白提取率為73.86%,蛋白純度為83.375%。通過單因素實驗得到SAT-尿素提取芝麻蛋白的最佳條件為:溫度為75℃,提取時間180 min、固液比為1∶50、利用乙醇沉淀蛋白、提取兩次,此條件下芝麻蛋白提取率可達(dá)71.41%,所制備的芝麻蛋白純度為89.433%,提取的芝麻蛋白純度高于堿溶酸沉法。

