RNA聚合酶II動態調控及其成像技術的研究進展
錢虹萍 陳博 林金星 崔亞寧
(1. 北京林業大學林木分子設計育種高精尖創新中心,北京 100083;2. 北京林業大學生物科學與技術學院,北京 100083)
轉錄是基因表達的關鍵步驟,也是真核生物生長發育和生命活動中必不可少的過程。該過程是以雙鏈DNA中的一條鏈為模板,以A、U、C、G四種核糖核苷酸為原料,在RNA聚合酶的催化作用下轉錄形成mRNA。轉錄過程又可以被分為轉錄起始、延伸、終止3個階段,首先RNA聚合酶與基因上的啟動子[1]結合誘導轉錄的開始,在調控因子的協助下進一步完成延伸,直至遇到終止信號完成特定基因的轉錄。所以,轉錄是將遺傳信息從DNA流向RNA的過程,這對生物的多樣性及生命的存在均有重要的意義。
前期的研究展示,真核生物的細胞核內的轉錄主要由3種RNA聚合酶介導,分別是RNA聚合酶I,RNA聚合酶II,以及RNA聚合酶III。其中RNA聚合酶I主要定位在細胞核仁,負責催化合成核糖體RNA(rRNA)中的18S rRNA、28S rRNA和5.8S rRNA;RNA聚合酶III則主要定位于細胞核基質,負責指導轉運RNA(tRNA)、5S rRNA以及一些非編碼RNA的合成;RNA聚合酶II也定位在細胞核基質中,負責催化核糖核酸的轉錄,來合成信使RNA(mRNA)及大多數snRNA、hnRNA。近期對植物體的研究發現,植物細胞核內除了上述3種RNA聚合酶外,還包含兩種特異性的RNA聚合酶,即RNA聚合酶 IV和RNA聚合酶 V。RNA聚合酶IV和RNA聚合酶V能夠促進非編碼RNA的產生,并且這些非編碼RNA通過DNA甲基化(RdDM)途徑[2]對基因沉默發揮重要的調控作用。
RNAP II在轉錄過程中發揮的作用最大,所以關于RNAP II轉錄調控的研究較多,這對于揭示真核生物生命活動的分子基礎具有重要的生物學意義[3]。RNAP II在進行高水平的轉錄調控過程中,通常需要一組轉錄因子(general transcription factors,GTFs), 包 括 TFIIA、TFIIB、TFIID、TFIIE、TFIIF和TFIIH來協調進行[4]。在過去的幾十年里,人們針對這些轉錄因子的主要功能做了大量的研究,發現這些轉錄因子都是以一種動態結合和解離的方式來調控轉錄的發生[5]。那么RNAP II在轉錄過程中的動態變化又是怎樣呢?隨著單分子成像和標記技術的不斷發展和應用,活細胞內單個RNAP II分子的動態研究得以實現并不斷的推進。在活體胚胎干細胞內,Cho等[6]觀察到RNAP II可以形成穩定存在的、或者短暫存在的clusters團簇結構。同時,孫育杰課題組[7]也在哺乳動物的活細胞核內,首次原位觀察到了RNAP II clusters的動態組裝和解聚過程。然而植物中關于RNAP II的活體動態研究比較少,因此本文主要對真核生物RNAP II結構和功能的研究進行綜述,并重點總結動物活細胞內RNAP II的動態標記和成像技術的研究進展,以期為植物活細胞內觀察RNAP II動態轉錄研究提供參考。
1 RNA聚合酶II的結構
RNAP II被認為是真核細胞RNA聚合酶家族中最活躍、最復雜的成員,它存在于細胞核的核質內,分子質量為550 kD,由12個亞單位組成,并分別由RPB1-RPB12基因編碼[8]。這12個亞基在真核細胞中高度保守,并能分解成一個由10個亞基組成的核心酶和一個由Rpb4和Rpb7組成的二聚體。其中按照進化的保守性以及在轉錄過程中的作用,又可以分為3類:一類是3種RNA聚合酶共同含有的亞基Rpb5、6、8、10和12;第二類是與細菌RNA聚合酶高度保守的核心亞基Rpb1、2、3;第三類是Rpb11以及Pol II特有的并且是轉錄起始所必需的亞基 Rpb4、7 和 9[9]。
Rpb1是RNAP II 的最大亞基,由于其具有催化活性,因此成為RNAP II 發揮轉錄功能的主要執行者,它的羧基末端有一段特殊的結構域CTD(carboxyl-terminal domain),在執行轉錄過程中發揮關鍵調控作用[10]。CTD具有高度保守的一致序列(Tyr-Ser-Pro-Thr-Ser-Pro-Ser),是一段基本上無結構的多肽鏈,并且在不同物種中的重復次數各不相同,如酵母中為26個重復,動物和人類中為52個重復,而植物中則有39個重復[11]。CTD的這種重復特性,能夠增加與之結合的蛋白數目,這對其功能的發揮產生直接的影響[12]。例如,在mRNA加工修飾的過程中,CTD結構通過與加帽酶、剪接因子以及諸多聚尾因子的結合,從而直接參與調控這些復雜的加工反應[13]。另外,CTD也會發生一系列修飾作用,譬如當外界病原菌入侵時,擬南芥RNAP II的CTD上3個氨基酸殘基發生快速而短暫的磷酸化,為植物激活初級免疫應答提供了一種快速途徑[14]。
2 RNA聚合酶II的功能
在真核生物中,RNAP II主要負責合成mRNA及大多數非編碼RNA[15]。在轉錄開始時,RNAP II通過識別DNA上的核心啟動子來決定轉錄的起始位點,同時轉錄因子也通過結合啟動子中的順式元件來協同激活轉錄的起始[16]。在轉錄的過程中,每一步都有轉錄輔激活因子的調節,也受到一些共同激活或抑制因子的調節,共同保證轉錄的正確延伸直到轉錄的結束[17]。植物中的轉錄過程(圖1)主要包括3個階段:轉錄起始、轉錄延伸和轉錄終止,具體的過程及RNAP II 在其中的作用如下。
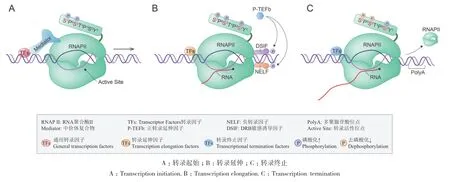
圖1 RNAP II介導的轉錄過程Fig. 1 RNAP II mediated transcription
2.1 RNA聚合酶II與轉錄調控起始
轉錄起始是一個動態協調的過程,也是轉錄發生過程中最關鍵的一個步驟[18]。在轉錄因子和中介體復合物(mediator complex)[19]的協助下,未經任何修飾的RNAP II 被招募到啟動子附近,形成轉錄預起始復合物(pre-initiation-complex,PIC)[20]。在ATP的作用下,DNA雙鏈被打開,其中一條DNA模板鏈進入RNAP II的活性位點,形成開放復合物來激活轉錄的起始。緊接著在RNAP II酶的催化作用下,核苷三磷酸(NTPs)作為底物開始合成mRNA的前體,標志著轉錄起始的正常進行[21]。通過單分子熒光成像技術觀測RNAP II—PIC的組裝過程發現,參與組裝的轉錄因子是通過一種短暫的、動態的方式來參與轉錄的起始[22]。因此,轉錄起始是由RNAP II和多種轉錄因子共同參與的動態調控過程。
在轉錄起始過程中,RNAP II的CTD磷酸化修飾起到了“開關”的作用。在轉錄初期,轉錄因子TFIIH使CTD的兩個氨基酸殘基(Ser5和Ser7)發生磷酸化修飾[23]。與動物不同的是,CDKF;1(CYCLIN-DEPENDENT KINASE F;1)是植物中特有的激酶,它可以特異性地磷酸化氨基酸殘基(Ser7)[24]。其中Ser5的磷酸化狀態會解除RNAP II和轉錄因子之間的結合,使RNAP II成功離開啟動子區域,從而進入轉錄延伸的階段[25]。因此,未經修飾的RNAP II主要參與轉錄初始階段,而磷酸化的RNAP II主要在轉錄延伸階段發揮作用。
2.2 RNA聚合酶II與轉錄延伸
RNAP II離開啟動子并開始合成RNA時,即進入了轉錄延伸階段[26]。在早期延伸過程中,RNAP II在啟動子的轉錄起始位點(transcription start site,TSS)下游20-100 bp處會發生轉錄暫停。轉錄暫停現象既是轉錄過程中的限速步驟,也是發生在早期延伸和生產性延伸之間的過渡階段。當負轉錄延伸因子(negative elongation factor,NELF)和DRB敏感誘導因子(DRB-sensitivity-inducing factor,DSIF)與RNAP II結合時,會引起RNAP II 的轉錄暫停;而當正轉錄延伸因子B(positive transcription elongation factor b,P-TEFb)[27]磷 酸 化 NELF 和DSIF時,負轉錄延伸因子轉化為正轉錄延伸因子,就會觸發RNAP II 轉錄的再次啟動[28]。
轉錄延伸過程中RNAP II的CTD氨基酸殘基Ser2可以被P-TEFb磷酸化,來招募其他轉錄延伸因子和染色質修飾因子,并且CTD的另外兩個氨基酸殘基Ser5和Ser7在磷酸酶的作用下會逐漸脫磷酸化。總之,在RNAP II的CTD氨基酸殘基Ser2的磷酸化狀態和Ser5、Ser7的去磷酸化狀態的共同作用下,轉錄的延伸過程進入生產性延伸階段[29]。因此,RNAP II的CTD磷酸化狀態明顯影響轉錄延伸的進程,但反過來轉錄延伸的過程是否也會影響CTD的磷酸化修飾,以及CTD狀態的轉變為什么發生在轉錄的特定延伸階段,這些問題仍需進一步的研究來解釋。
2.3 RNA聚合酶II與轉錄終止
當轉錄延伸遇到終止子時,RNAP II在解旋酶的作用下從DNA模板上解離,發生轉錄終止[30]。RNAP II介導的轉錄終止是一個極其復雜的過程,大多數mRNA轉錄終止依賴于多聚腺苷酸(Poly A)位點,并且受到RNAP II的CTD磷酸化狀態的調控[31]。在轉錄終止時,RNAP II的CTD氨基酸殘基Ser2的磷酸化水平達到最高,而另一個氨基酸殘基Ser5的磷酸化水平逐漸降低。因此,RNAP II的CTD磷酸化狀態的轉變,會促使Poly A位點上招募到新的轉錄因子,導致RNAP II轉錄復合物的構象發生變化[32],而從RNA-DNA雜合鏈上解離下來,至此一次完整的轉錄過程發生終止。另外在轉錄終止時,RNAP II在磷酸酶的作用下發生去磷酸化[33],產生非磷酸化修飾的RNAP II,從而可以參與到下一輪的轉錄循環反應中。
3 RNA聚合酶II標記及成像技術
RNAP II的結構和功能已經被廣泛研究,然而關于活細胞內是如何調控轉錄過程,以及它的動態特征是怎樣的,這些問題目前仍不清晰。近年來,隨著活體熒光標記技術和超分辨率成像技術的發展,研究人員可以實時的追蹤RNAP II的動態過程,能夠實現對RNAP II的高時空動態成像與觀察[34]。下面對這些標記和成像技術進行介紹。
3.1 RNA聚合酶II標記技術
熒光標記技術是指將不同的熒光探針特異性地連接到目標分子上的一種技術,常用的熒光探針包括:有機染料、熒光納米晶體和熒光蛋白等[35]。其中熒光蛋白指的是帶有熒光基團結構的蛋白質,它通過對目標分子進行特異性地標記[36],是目前熒光標記中最常用的手段。綠色熒光蛋白(green fluorescent protein,GFP)[37]及其他顏色的熒光蛋白[38]由于穩定性強和亮度高的優點,受到了研究人員的青睞并實現了廣泛的應用。但新型超高分辨率技術的發展,對熒光蛋白的選擇產生了更高的需求,亟需更亮、更穩定的熒光蛋白作為標簽。光激活(photoactivatable fluorescent proteins,PAFPs)、光轉 化(photoconvertible fluorescent proteins,PCFPs)、光開關(photoswitchable fluorescent proteins,PSFPs)熒光蛋白等的出現,不僅提高了顯微觀察的精準性,也極大地推動了活細胞成像技術的發展[39]。
之前對轉錄調控的研究中,研究者通常選擇熒光原位雜交技術(fluorescence in situ hybridization,FISH)[40]來進行,它能夠同時識別特定的基因和轉錄位點并進行標記。但是這一技術需要將細胞固定,而固定后的“死細胞”獲得的結果與活細胞中的結果有很大的不同,固定后的“死細胞”不能反映植物細胞感受外界信號后的真實轉錄情況,因而無法獲取動態變化的準確信息。在這個過程中,基因編輯技術如CRISPR/Cas9(clustered regularly interspaced short palindromic repeats-CRISPR-associated protein 9)和自我標記蛋白(self-labeling proteins,SLPs)技術是目前非常有用的技術手段。
CRISPR/Cas9是一種基因靶向編輯技術,它可以將編碼熒光蛋白的基因序列插入到基因組的特定位置,來實現基因轉錄的可視化[41]。CRISPR/Cas9技術由Cas9核酸酶和單鏈引導RNA(single guide RNA,sgRNA)兩部分組成,Cas9核酸酶在sgRNA的指導下,可以靶向切割目的基因,再利用同源DNA修復技術完成對該目的基因的編輯和重組。研究者通過CRISPR/Cas9技術,利用光轉換熒光蛋白(Dendra2)對小鼠胚胎細胞的內源性RNAP II進行特異性標記,觀察到活細胞核內RNAP II團簇的存在,并且其壽命非常的短暫(約為8 s)[42],這一結果與之前標記外源性RNAP II的觀察結果相一致。因此,CRISPR/Cas9是一種強大且精細的工具,通過基因工程技術將熒光蛋白敲進內源基因以使融合蛋白在生理相關水平上表達。同時由于該技術具有易于設計、載體構建簡單、實施快捷和成本低的優點,在生物學領域里的多個物種中[43]都得到了廣泛的應用,但CRISPR/Cas9方法在應用的過程中仍然存在脫靶[44]的問題,還需不斷改進。
SLPs技 術( 如 Halo-Tag和 SNAP-Tag)[45]通過一種共價結合的方式讓目標蛋白攜帶上熒光標簽,共價鍵具有不可逆、穩定性強、特異性高等特點,是研究活細胞蛋白追蹤的首選技術。常用的一些標簽包括 HaloTag、SnapTag、CLIPtag和TMPTag,都可以通過遺傳編碼的方法與目標蛋白進行融合表達,并且這些標簽可以催化有機染料標記的小分子底物共價連接到目標蛋白[46]。在小分子透膜染料中,janelia fluor(JF)系列的染料表現最佳[47],如JF549、JF646、PA-JF549及PA-JF646等,在近期的單分子成像領域被廣泛應用。例如在一項最近的研究中,Cho[6]等分別用 JF646-Halotag和Dendra2來標記轉錄因子Mediator和RNAP II,雙色光片顯微成像顯示活體細胞核內有大量聚集的雙色亮點,并且通過量化分析發現,Mediator和RNAP II團簇共定位比例達到90%。另外,在植物研究應用方面,利用一種新開發的Halo-Tag可編輯技術[48],來探索轉錄因子和蛋白之間的相互作用,這使得許多新的轉錄因子被識別和研究(圖2)。

圖2 CRISPR/Cas9和SLPs技術標記目標分子的示意圖Fig. 2 The schematic of CRISPR/Cas9 and SLPs
3.2 RNA聚合酶II成像技術
自20世紀以來,超高分辨顯微技術的快速發展使光學成像有了很大突破,能將衍射極限達到200 nm以下,并且實現了三維、高速的活體成像[49],可以在單分子水平上直接觀察目標蛋白的動態特征。與傳統的光學顯微鏡相比,超高分辨率技術能夠將分辨率提高近10倍,這就使亞細胞的結構細節得到前所未有的可視化[50],但不同的研究問題需要不同的成像技術作為最優的解決方案。因此,為了方便研究者技術的選擇,我們概述了幾種目前可用于生命科學研究的顯微技術[51],并總結了不同顯微技術的主要優缺點,如表1所示。
下面對這幾種技術在RNAP II動態研究中的應用進行介紹。
單分子定位的顯微技術,如光激活定位(photo activated localization microscopy,PALM)和隨機光學 重 構(stochastic optical reconstruction microscopy,STORM)顯微技術,能夠實現30 nm的空間分辨率和10 μm的成像深度,設備價格也中等,并且它們成像原理基本相同,都是利用熒光分子的特性和單分子定位的精準度,通過獲取多張圖片進而重構出一幅超分辨圖像;區別在于STORM技術是利用熒光探針等技術來標記目標蛋白[52],而PALM技術則是利用融合表達的熒光蛋白來進行標記的,因此PALM技術更適合于活細胞內的蛋白成像。在活體胚胎細胞核內,研究者就利用PALM超分辨成像技術揭示了RNAP II的動態特征,表明內源性的RNAP II是以瞬時的團簇形式存在的[42]。同樣通過PALM技術,Cisse等[34]觀察到了RNAP II團簇的組裝過程,但對于RNAP II團簇是否發生解聚過程仍不清楚。但無論是STORM還是PALM技術,都是利用“時間換空間”的方法來提高成像分辨率,這也就限制了它們的時間分辨率,不適合應用于分子的長期動態觀察。

表1 不同顯微技術的主要優缺點Table 1 Major merits and demerits of different microscopic technique
受激發射損耗技術(stimulated emission depletion,STED)及其它衍生方法,它作為共聚焦顯微裝置的附加模式,通常是比較容易操作的一項技術。STED的原理是利用兩束光源,其中激發光照射目標區域發出熒光,而損耗光則會將目標樣品以外的熒光淬滅,從而達到有效熒光發光面積的最小化[53],所以STED技術將光學顯微鏡的分辨率提高了近10倍。另外,Wildanger等[54]通過引入3D STED,又實現了3個方向上超分辨率的提升。在最近的一項研究中,Li等[55]利用3D STED技術來實時成像、追蹤和定量分析活細胞內的RNAP II分子,觀察其在轉錄周期中的動態變化,從而為揭示RNAP II的動力學與轉錄調控之間的聯系奠定基礎。但是,STED技術也有很多缺陷,如STED技術不適用于大的樣品,并且會對樣品產生光毒害等,最重要的是設備的價格非常昂貴等。
光片熒光顯微鏡(light sheet fluorescence microscopy,LSFM)是一種適用于大型樣品成像的新型顯微系統[56]。LSFM雖然局限于傳統的分辨率,但通過與其他超高分辨率技術的結合,如LSFM與結構光照明(structured illumination microscopy,SIM)顯微技術結合而發展出的貝塞爾光束照明技術(bessel beam illumination microscopy)和晶格光片顯微術(lattice Light-Sheet Microscopy,LLS),成為一種廣受歡迎的成像顯微技術。該顯微技術采用薄片光進行側向照明,并在垂直方向上探測成像,不僅成像速度非常快、光毒性低、信噪比高,而且可以對活體樣本進行長時間的三維成像[57]。Zhao等[58]利用LSFM技術觀測了哺乳動物活細胞核中RNAP II分子的動態,結果顯示大多數(>70%)的轉錄位點來源于單個RNAP II分子,并且未檢測到RNAP II分子之間發生顯著的聚類反應。而在Cho等[36]研究中,通過LSFM成像顯示小鼠胚胎干細胞核內出現大量RNAP II聚集的現象,進一步分析顯示這些RNAP II分子有兩種存在形式,分別可以形成小的、瞬時的團簇和較大的、穩定的團簇。當然,LSM也有其自身的局限性,如設備價格非常昂貴、橫向分辨率較低,后期的大數據處理也比較困難等[59]。如何與其它超高分辨率顯微技術更好的融合,將是LSFM未來研究的主要方向。
貝葉斯納米顯微技術(bayesian nanoscopy)就是一個將LSFM與超分辨顯微技術結合的典型例子,已經發展成為一種新型快速成像方法[60]。貝葉斯算法是利用大量熒光分子的閃爍和漂白信息來還原樣品的結構,通過將高斯光片照明引入到貝葉斯算法中[61],發展出一種新型的貝葉斯納米顯微技術。該技術有效地提高了顯微成像的時空分辨率(50 nm的空間分辨率和4 s的時間分辨率),并大大減少了對樣品的光毒性。Chen等[7]利用貝葉斯納米顯微技術的優勢,觀察到活細胞核中RNAP II分子的空間結構為不規則的球狀幾何形式,并揭示了RNAP II分子的動態組裝和解聚過程。雖然貝葉斯納米顯微技術也存在局限性,比如不適合長期觀察活細胞內的分子動態[57],但此方法是目前為止研究活體細胞內RNAP II分子動力學的最佳選擇。
4 展望
綜上所述,RNAP II的動力學、聚類反應及與轉錄因子之間的相互作用,對于揭示真核生物的轉錄調控具有重要的意義。近年來,多個實驗室在活細胞熒光成像和分子標記技術的研究中取得了長足的進展,為實現在單分子水平上直接觀察RNAP II的動態轉錄奠定了基礎。例如,研究者可以選擇CRISPR/Cas9或SLPs標記技術使目標分子攜帶熒光標簽,再通過LSFM與超分辨顯微技術結合的方法來實時成像和追蹤目標分子,這樣就使得活體細胞內的分子動態行為變得可視化。與動物細胞相比,植物的細胞存在細胞壁、葉綠體等物質極大的限制了植物細胞的活體成像,并且植物細胞也無法像動物細胞一樣進行貼壁生長,這無疑對植物細胞的活體成像觀察提出了更大的挑戰,所以目前關于植物RNAP II的活體動態研究甚少,其響應不同生理條件下的動態調控機制也尚不清晰。因此,植物活體細胞內RNAP II動態調控轉錄是今后重點關注的方向,這也將會為揭示真核生物的轉錄機制帶來更多的啟示。

