產幾丁質酶的無色桿菌ZWW8的發酵產酶及酶學性質研究
張瑤心 王亮節 鄭文 徐漢琴 鄭戀 鐘靜
(湖北第二師范學院化學與生命科學學院 植物抗癌活性物質提純與應用湖北省重點實驗室,武漢 430205)
幾丁質(Chitin)是由N-乙酰-D-葡萄糖胺以β-1,4糖苷鍵連接而成的多聚物,是蝦蟹等甲殼動物的殼、昆蟲的外骨骼和許多真菌的細胞壁的重要組成成分,在自然界中的含量僅次于纖維素[1]。植物、動物及微生物都能產生幾丁質酶切割β-1,4糖苷鍵來降解幾丁質,以實現各自的生理功能。根據作用方式的差異,幾丁質酶可以被分為內切幾丁質酶和外切幾丁質酶。內切幾丁質酶隨機地降解幾丁質鏈內部的β-1,4糖苷鍵,產生各種不同大小的低聚糖。而外切幾丁質酶從幾丁質的非還原端逐個切割,釋放幾丁二糖[2]。許多微生物會產生幾個不同切割方式的幾丁質酶,協同作用完成對幾丁質的降解。
近年來,幾丁質酶因在制備幾丁寡糖、處理海洋廢棄物以及農業生物防治等方面具有大的應用潛力而備受關注[3-5]。幾丁質酶通過降解昆蟲的外骨骼及其圍食膜中的幾丁質,使其喪失生命活動能力,從而殺死害蟲;幾丁質酶通過降解真菌細胞壁中的幾丁質,破壞真菌細胞結構,從而抑制真菌的生長。此外,將幾丁質酶基因導入植物細胞中以構建轉基因植株,能抵抗真菌和害蟲的侵害[6-9]。利用微生物產生的幾丁質酶處理蝦蟹殼廢棄物,不僅可以大大緩解環境污染的壓力,還可以變廢為寶、創造幾丁寡糖等高附加值產品,作為藥物輸送載體、抗氧化劑和食品保存中的抗菌材料,可用于止血、傷口愈合、癌癥預防和治療等方面[10]。但目前的研究還存在幾丁質酶產生菌發酵產酶水平低、產酶周期長等問題,限制了其應用。此外,工業生產時常會涉及如高溫、強酸性、強堿性和低水活度環境等不利條件,常規酶容易聚集沉淀并喪失活性及穩定性,需要開發高效、穩定的新型幾丁質酶。
無色桿菌屬于腸桿菌科Enterobacteriaceae,能通過寄生在線蟲腸道內,侵入各種昆蟲體內,對線蟲和各種鱗翅目昆蟲有殺傷作用。近些年來,已經有一些關于無色桿菌屬的細菌產幾丁質酶的報道。1976年,Chigale?chik等[11]分離得到一株在幾丁質中生長并產生胞外幾丁質酶的液化無色桿菌(Achromobacter liquefaciens)。1993 年,Takashi等[12]分離得到了一株能夠降解幾丁質的無色桿菌,該菌株具有抗菌、抗線蟲及活化植物細胞的能力。2015年,Bholay等[13]從印度漁業固體廢物中分離得到的反硝化無色桿菌Achromobacter denitrificans,在以幾丁質為唯一碳源的培養基中能產生外切幾丁質酶。本實驗室從中國湖北省武漢市的蝦殼堆積處的土壤中篩選得到一株能產生幾丁質酶的細菌ZWW8,并發現其幾丁質酶能在高鹽條件下降解幾丁質,通過16S rDNA鑒定其屬于Achromobacter屬。目前,國內外還沒有關于Achromobacter屬細菌產耐鹽幾丁質酶的研究報道。本文系統研究了產幾丁質酶的無色桿菌的鑒定,產幾丁質酶發酵條件優化及幾丁質酶的酶學性質檢測,旨在發掘新的產耐鹽幾丁質酶的菌株,提高幾丁質酶產量和酶活力,為篩選適用于工業生產的高效穩定的幾丁質酶提供理論依據和技術支持。
1 材料與方法
1.1 材料
1.1.1 主要儀器與試劑 幾丁質粉末購自Sigma公司;胰蛋白胨和酵母提取物購自Oxoid公司;水溶性殼聚糖購自山東奧康生物科技有限公司;殼聚糖粉末購自上海如吉生物科技發展有限公司;N-乙酰-D-氨基葡萄糖購自阿拉丁公司;Pfu DNA聚合酶和DNA marker購自全式金生物技術有限公司;DNA膠回收試劑盒購自OMEGA公司;低分子量蛋白質 Marker購自中國科學院上海生命科學研究院;K2HPO4、KH2PO4、MgSO4、FeSO4·7H2O、NaCl、NH4Cl、HCl、NaOH、瓊脂粉、乙酸、生理鹽水、3,5-二硝基水楊酸、尿素、葡萄糖、NH4NO3、NaNO3、(NH4)2SO4等化學試劑為國產分析純。
恒溫金屬浴(TU-10):上海一恒科技有限公司;氣浴恒溫振蕩器(THZ-92B):上海博訊醫療生物儀器有限公司;紫外可見分光光度計(UV-5200PC):上海元析儀器有限公司;梯度熱循環PCR儀(C1000 Touch):Bio-Rad公司;化學發光凝膠成像系統(Chemi Doc XRS+):Bio-Rad公司;連續光譜光吸收酶標儀(Spectra Max Plus 384):Molecular Devices公司
1.1.2 培養基及溶液 種子培養基:NaCl 10 g,酵母粉 5 g,蛋白胨 10 g,蒸餾水1 L,pH 自然。
初始發酵培養基:NaCl 10 g,MgSO4·7H2O 0.5 g,CaCl20.53 g,KH2PO40.3 g,K2HPO40.7 g,酵母粉 1 g,粉末幾丁質 5 g,蒸餾水1 L,pH自然。
搖瓶發酵培養基:NaCl 10 g,MgSO4·7H2O 0.5 g,CaCl20.53 g,KH2PO40.3 g,K2HPO40.7 g,酵母粉 1 g,膠體幾丁質 5 g,NH4Cl 3 g,蒸餾水1 L,pH 7.0。
膠體幾丁質:10 g幾丁質粉末溶解0.4 L 濃鹽酸中,離心后將上清加入4 L去離子水,靜置過夜后離心棄去上清,將沉淀用去離子水重懸,并加入NaOH溶液調節pH至7.0,并去離子水洗滌3次。取4 mL膠體幾丁質離心棄上清,將沉淀在60℃烘箱烘干至恒重,計算膠體幾丁質濃度。
膠體殼聚糖:10 g殼聚糖粉末溶解于0.4 L 1%乙酸中,將上清加入4 L去離子水,靜置過夜后離心棄去上清,將沉淀用去離子水洗滌3次。取4 mL膠體殼聚糖離心棄上清,將沉淀在60℃烘箱烘干至恒重,計算膠體殼聚糖濃度。
幾丁質親和層析純化幾丁質酶所用溶液:洗滌緩沖液(g/L):NaCl 150,KH2PO40.3,K2HPO40.7,pH 7.0;洗脫緩沖液(g/L):Urea 480,KH2PO40.3,K2HPO40.7,pH 7.0;透析緩沖液(g/L):NaCl 10,KH2PO40.3,K2HPO40.7,pH 7.0。
1.1.3 實驗樣品 本課題組從湖北某高校校園中蝦殼堆積處的土壤中取樣,進行富集培養之后,采用透明圈法,以膠體幾丁質為唯一碳源,篩選出產幾丁質酶活性高的菌株ZWW8。
1.2 方法
1.2.1 菌株的篩選與分子生物學鑒定 利用原核生物 16S rDNA 通用引物 27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492R(5′-TACGGTTACCTTGTTACGACTT-3′),以ZWW8的菌液為模板進行PCR,電泳后用膠回收試劑盒純化DNA片段,并送樣測序,測序結果包含V1-V8的高變區和部分V9區,可用來進行物種初步鑒定及比較親緣關系[14-15]。在NCBI網站對測序結果進行BLAST搜索,選取與其相似性較高的16S rDNA序列進行比對,并用MEGA 6.0構建系統發育樹。
1.2.2 幾丁質酶活性的測定方法 取200 μL酶液加入200 μL 的1%(W/V)膠體幾丁質,混合后置于45℃反應保溫1 h,離心,取上清300 μL加入300 μL DNS混勻,100℃加熱20 min。等樣品冷卻后,12 000 r/min離心10 min,取上清測定其在540 nm處的吸光值,對照組所用為經過100℃滅活后的酶液。實驗組和對照組的差值反映了幾丁質酶的活性。根據N-乙酰葡萄糖胺標準曲線來計算還原糖含量。酶活力單位定義:在合適條件下,每分鐘產生1 μmol的N-乙酰氨基葡萄糖所需的酶量為1個酶活力單位(U)。
1.2.3 產酶條件優化 在初始發酵培養基的基礎上,對培養基中的碳源、氮源、溫度、初始pH 和產酶時間進行優化。在初始培養基中分別加入0.5%(W/V)的粉末幾丁質、膠體幾丁質、水溶性殼聚糖、粉末殼聚糖、葡萄糖或N-乙酰葡萄糖胺作為碳源,確定最佳碳源,并檢測碳源添加量對產酶的影響。在碳源優化的基礎上,分別加入0.3%(W/V)的(NH4)2SO4、NH4NO3、NH4Cl、NaNO3、尿素及蛋白胨作為氮源,檢測發酵上清的幾丁質酶活性,確定最佳氮源。在碳源和氮源優化后的培養基基礎上,依次考查將發酵培養基初始pH值(5.0-9.0),發酵溫度(28-45℃)和發酵時間對胞外上清幾丁質酶產量的影響,確定最優的發酵產酶條件。
1.2.4 幾丁質酶的酶學性質研究
1.2.4.1 溫度對幾丁質酶活力的影響 在pH 7.0,1%NaCl條件下,以膠體幾丁質為底物,檢測粗酶液在不同溫度條件下的活性,以最高酶活為100%,計算其相對酶活。
1.2.4.2 pH 對幾丁質酶活力的影響 在1% NaCl,45℃條件下,檢測粗酶液在不同pH條件下的活性,以最高酶活為100%,計算其相對酶活。
1.2.4.3 NaCl濃度對幾丁質酶活性的影響 在pH 7.0,45℃條件下,檢測粗酶液在不同NaCl濃度中的活性,以最高酶活為100%,計算其相對酶活。
1.2.4.4 金屬離子對幾丁質酶活性的影響 向粗酶液中加入10 mmol/L EDTA,并透析除去EDTA,再向酶液中加入5 mmol/L不同金屬離子,檢測其活性,以不加入金屬離子的酶液的酶活為100%,計算幾丁質酶在不同金屬離子存在時的相對酶活。
1.2.4.6 NaCl濃度對穩定性的影響 向粗酶液中加入NaCl配制成不同NaCl濃度的酶液,將各組酶液于55℃保溫30 min,再檢測酶活。分別以未經過熱處理的各NaCl濃度的酶液的活力定義為100%,計算各NaCl濃度中幾丁質酶的殘余活性百分比。
1.2.4.7 NaCl濃度對幾丁質酶的幾丁質結合能力的影響 向粗酶液中加入NaCl配制成不同NaCl濃度的酶液,取1 mL 酶液加入0.2 mL相同NaCl濃度的1%(W/V)膠體幾丁質,混合后靜置30 min,然后離心檢測上清的幾丁質酶活性,分別以與幾丁質結合前的各NaCl濃度酶液的活性定義為100%,計算幾丁質酶在不同NaCl濃度中與幾丁質的結合率。
1.2.5 幾丁質酶的純化及SDS-PAGE 取20 mL 含有15% NaCl的幾丁質粗酶液,加入幾丁質親和層析柱,收集流出液并反復上樣3次,然后依次加入10 mL 洗滌液和5 mL洗脫液,收集流出液。將洗脫液透析復性,并檢測幾丁質酶活性。將粗酶液、上樣流出液、洗滌液和洗脫液各0.4 mL進行TCA沉淀制樣并進行SDS-PAGE。SDS-PAGE所用分離膠濃度為12.5%,縮膠濃度為4.5%,電泳結束后用考馬斯亮藍R-250染色。
1.2.6 數據分析 試驗數據采用Excel 軟件進行分析,試驗中各發酵條件的優化和酶學性質檢測均為3 次平行實驗,結果以3次實驗的平均值±標準差的形式展現。
2 結果
2.1 產幾丁質酶菌株的篩選和鑒定
在NCBI網站對ZWW8菌株的16S rDNA測序結果進行BLAST搜索和序列比對,發現其與Achromobacter屬菌株的16S rDNA序列相似性達到99.9%以上。圖1 表明ZWW8菌株為Achromobacter屬,并與Achromobacter mucicolens的親緣關系較近。

圖1 基于16S rDNA序列構建的ZWW8菌株的系統進化樹Figure 1 Phylogenetic tree of strain ZWW8 based on 16S rDNA sequences
2.2 ZWW8菌株產幾丁質酶條件的優化
以0.5%的粉末幾丁質為唯一碳源,初始產酶量為4.2 U/L。
以盾構隧道底部無溶洞的情況為例,通過計算可得到管片的極限受拉疲勞次數為1.358×107次,極限受壓疲勞次數為3.147×1014次,兩者之間相差7個數量級,說明管片的疲勞壽命是由極限受拉疲勞次數決定的。
2.2.1 碳源對ZWW8菌株產幾丁質酶的影響 將ZWW8菌株分別在以葡萄糖、膠體幾丁質、粉末幾丁質、粉末殼聚糖、水溶性殼聚糖和N-乙酰葡萄糖胺為碳源的培養基中培養,檢測發酵上清中的幾丁質酶活性。如表1所示,以膠體幾丁質為碳源時,發酵產幾丁質酶量最高,能達到20.0 U/L;粉末幾丁質次之,發酵產酶量達到4.2 U/L。當以膠體殼聚糖、葡萄糖、水溶性殼聚糖和N-乙酰葡萄糖胺為碳源時,ZWW8菌株均不產生幾丁質酶。
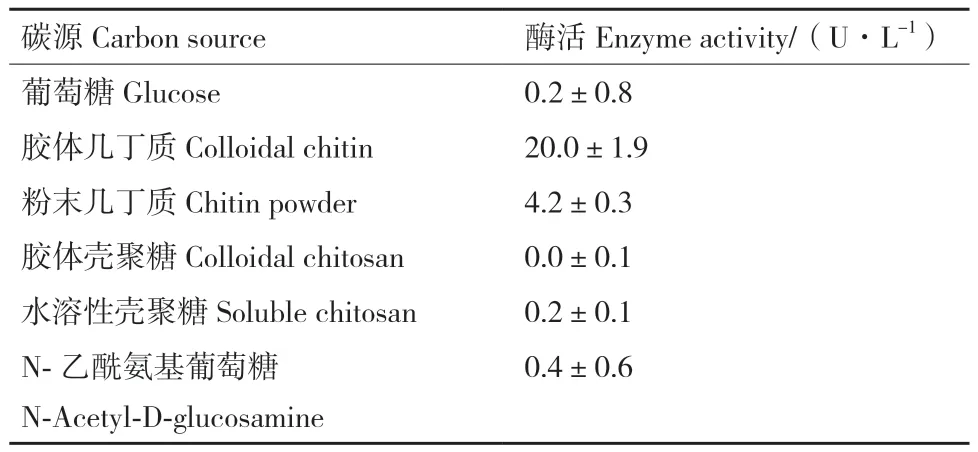
表1 不同碳源對ZWW8菌株發酵產幾丁質酶的影響Table 1 Effect of different carbon sources on chitinase production by Achromobacter sp. ZWW8
2.2.2 氮源對ZWW8產幾丁質酶的影響 在碳源優化的基礎上,將ZWW8菌株分別在以(NH4)2SO4、NH4NO3、NH4Cl、NaNO3尿素和蛋白胨為氮源的發酵培養基中培養,檢測上清中幾丁質酶活性。如表2 所示,NH4NO3、NH4Cl、(NH4)2SO4和蛋白胨作為氮源時幾丁質酶的表達量較高,尿素和NaNO3作為氮源時幾丁質酶的表達量較低。以NH4Cl作為氮源時,發酵產酶量最高,可達到20.7 U/L。
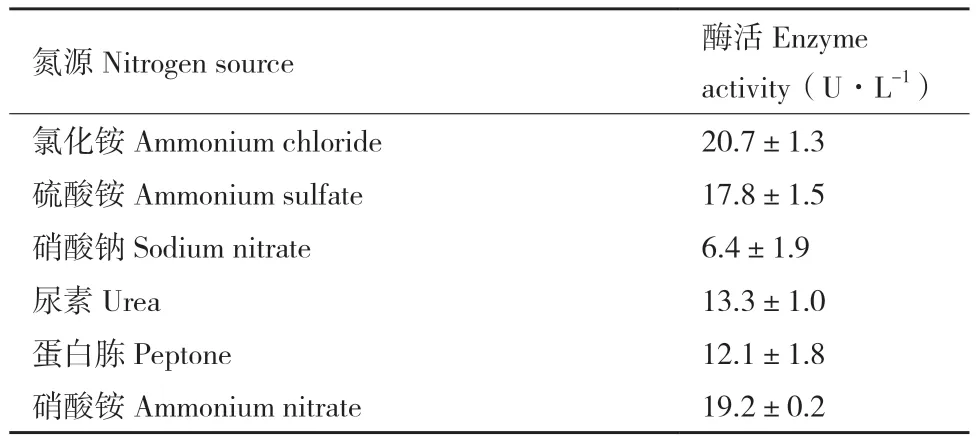
表2 不同氮源對ZWW8菌株發酵產幾丁質酶的影響Table2 Effect of different nitrogen sources on chitinase production by Achromobacter sp. ZWW8
2.2.3 初始pH對ZWW8菌株產幾丁質酶的影響 在碳源和氮源優化的基礎上,將ZWW8菌株分別在初始pH值為5-9的發酵培養基中培養,檢測其發酵上清的活性。圖2表明,ZWW8菌株在pH 5-9均能產生幾丁質酶,且在pH 7時產酶量最高,能達到32 U/L。
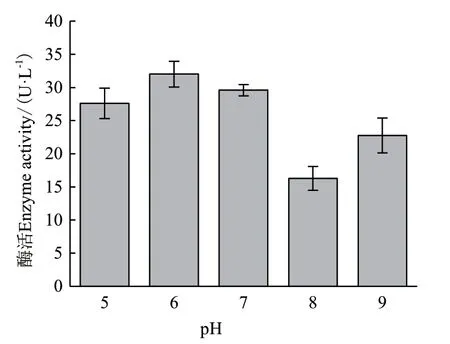
圖2 培養基初始pH對ZWW8菌株產幾丁質酶的影響Fig.2 Effect of initial medium pH on chitinase production by Achromobacter sp. ZWW8
2.2.4 溫度對ZWW8產幾丁質酶的影響 將ZWW8菌株在優化后的培養基中分別在28-45℃培養,檢測上清中幾丁質酶活性。如圖3所示,ZWW8菌株在不同溫度的幾丁質酶產量有顯著差距,28℃時不產生幾丁質酶,而37℃產酶量最高,可以達到33.9 U/L。
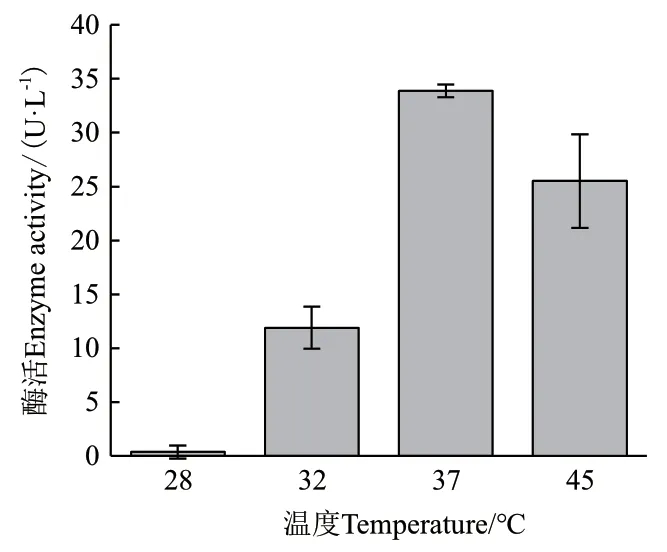
圖3 溫度對ZWW8菌株產幾丁質酶的影響Fig.3 Effect of temperatures on chitinase production by Achromobacter sp. ZWW8
2.2.5 發酵時間對ZWW8菌株產幾丁質酶的影響 在發酵培養基配方和培養溫度優化的基礎上,檢測ZWW8菌株在不同時間的產酶量。如圖4所示,ZWW8菌株培養1 d后就開始大量分泌幾丁質酶,并在第2天產酶量最大,達到32 U/L。此后幾丁質酶產量開始下降,第5天時幾丁質酶產量僅為3 U/L。
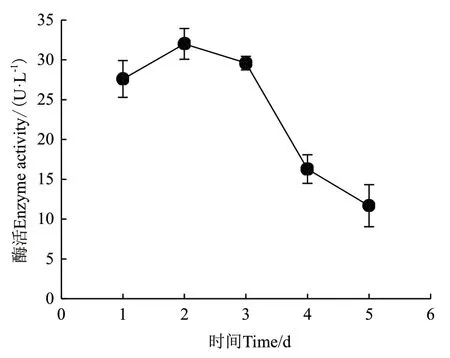
圖4 發酵時間對ZWW8菌株產幾丁質酶的影響Fig.4 Effect of fermentation time on chitinase production by strain ZWW8
2.3 ZWW8幾丁質酶的酶學特性
2.3.1 溫度對ZWW8菌株幾丁質酶活性的影響 檢測ZWW8菌株幾丁質酶液在10-65℃條件下的活性,結果如圖5。幾丁質酶在50℃活性最高,且在65℃時活性維持最大活性的50%,在10℃能維持最高活性的25%左右。
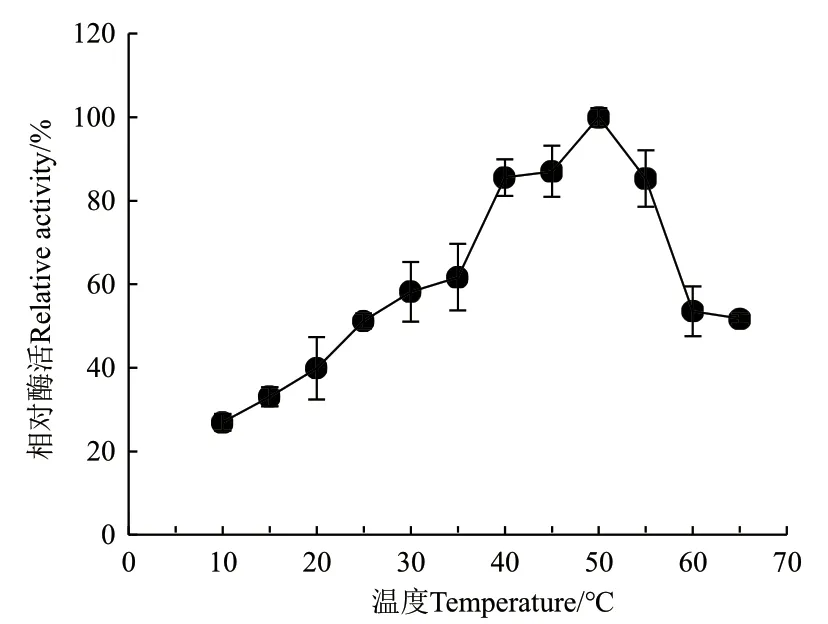
圖5 溫度對ZWW8菌株幾丁質酶活性的影響Fig.5 Effect of temperature on chitinase activity by strain ZWW8
2.3.2 pH對ZWW8幾丁質酶活性的影響 檢測ZWW8菌株幾丁質酶在pH 3-9條件下的活性。如圖6所示,隨著pH值上升,酶的活性呈現先增加后下降的趨勢,pH 5.5時酶的活性達到最高,并在pH 5-7條件下具有較高的活性。

圖6 pH對ZWW8菌株幾丁質酶活性的影響Fig.6 Effect of pH on chitinase activity by strain ZWW8
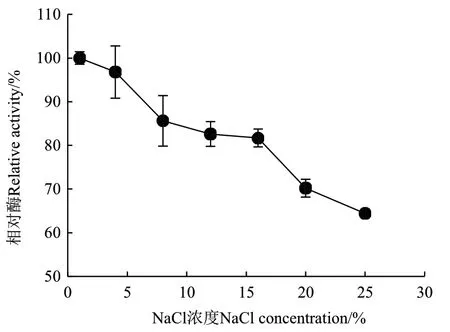
圖7 NaCl濃度對ZWW8菌株幾丁質酶活性的影響Fig.7 Effect of NaCl concentration on chitinase activity by strain ZWW8
2.3.3 NaCl濃度對ZWW8菌株幾丁質酶活性的影響 檢測ZWW8菌株幾丁質酶在1%-25% NaCl條件下的活性。如圖7所示,隨著NaCl濃度上升,活性下降。NaCl濃度為1%時幾丁質酶的活性最高,而當NaCl濃度為25%時,仍然能保持最大活性的64%。
2.3.4 金屬離子對ZWW8菌株幾丁質酶活性的影響 檢測 5 mmol/L 的 Hg2+、Zn2+、Mg2+、Ca2+、Ag+、Cu2+和Ni2+等金屬離子對ZWW8幾丁質酶活性的影響,如表3所示,Cu2+和Zn2+對酶活有抑制作用,Hg2+可導致幾丁質酶完全失活,Ca2+和Ni2+有一定的促進作用。
2.3.5 溫度對ZWW8菌株幾丁質酶熱穩定的影響 檢測ZWW菌株幾丁質酶液分別在40-60℃保溫后的殘余活性,如圖8所示,ZWW菌株的幾丁質酶在40℃穩定性較好,經過1 h保溫活性沒有明顯變化。隨著溫度升高,幾丁質酶的穩定性逐漸下降,60℃保溫20 min后殘余活性僅有10%。

表3 金屬離子對ZWW8菌株幾丁質酶活性的影響Table 3 Effect of metal ions on chitinase activity by strain ZWW8

圖8 ZWW8菌株幾丁質酶在不同溫度熱處理后的殘余活性Fig.8 Effect of temperature on residual activity of chitinase by strain ZWW8
2.3.6 NaCl濃度對ZWW8菌株幾丁質酶熱穩定的影響 將1%-20% NaCl ZWW8菌株幾丁質酶液于55℃保溫30 min,檢測其殘余活性。如圖9所示,隨著NaCl濃度提高,幾丁質酶熱穩定性明顯增強。NaCl濃度為20%時,幾丁質酶在55℃保溫30 min后還能維持近70%的活性。
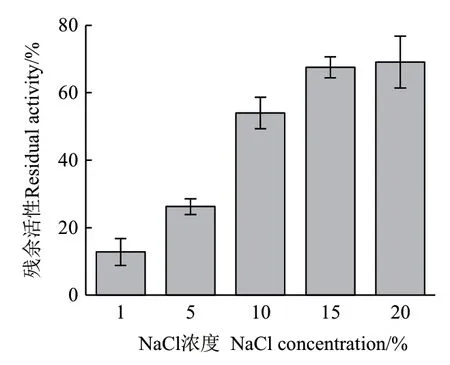
圖9 幾丁質酶在不同NaCl濃度熱處理后的殘余活性Fig.9 Effect of NaCl concentration on residual activity of chitinase
2.3.7 NaCl濃度對ZWW8菌株幾丁質酶的幾丁質結合能力的影響 檢測ZWW8菌株幾丁質酶在1%-20% NaCl條件下對幾丁質的結合能力,圖10表明隨著NaCl濃度增加,幾丁質酶與膠體幾丁質的結合率明顯提高。

圖10 NaCl濃度對ZWW8菌株幾丁質酶的幾丁質結合能力的影響Fig.10 Effect of NaCl concentration on chitin binding ability of chitinase by strain ZWW8
2.3.8 ZWW8菌株幾丁質酶的純化及SDS-PAGE檢測 為了對ZWW8菌株的幾丁質酶進行初步純化,我們利用其幾丁質酶能特異性結合幾丁質這一特點,通過幾丁質親和層析柱對含有15% NaCl的粗酶液進行分離純化。如圖11所示,ZWW8菌株的粗酶液有5條主帶可與幾丁質特異性結合。對各組分進行幾丁質酶活性檢測結果表明,上樣流出液和洗滌液均無活性,僅有洗脫液透析復性后具有幾丁質酶活性。
3 討論
我國蝦蟹等水產品資源十分豐富,產生了巨大的經濟價值,但也因此產生大量的廢棄物,造成了環境的污染和資源的巨大浪費。幾丁質作為蝦殼蟹殼的主要成分,可通過物理、化學處理和酶降解成幾丁寡糖,具有抗微生物、抗腫瘤、抗氧化、免疫調節、促進傷口愈合和組織再生、控制血壓和降低膽固醇等各項生物活性[16],可作為殺蟲殺菌劑、免疫增強劑、藥物載體和食品添加劑等進行大規模應用[17]。研究表明,利用幾丁質酶水解可得到所需長度和脫乙酰度的幾丁寡糖,而且反應條件溫和、專一性高、對環境污染小,是獲得幾丁寡糖最環保且低能耗的方法[18]。然而工業生產時常會涉及例如高溫、強酸性、強堿性和低水活度環境等不利條件,目前所使用的酶在高鹽、低溫和有機溶劑等低水活度環境中容易聚集沉淀并喪失活性及穩定性,因此開發適用于大規模工業生產,耐受各種不利條件,在低水活度環境中具有活性和穩定性的幾丁質酶,具有重大經濟價值與理論價值[19-20]。

圖11 幾丁質親和層析純化ZWW8菌株幾丁質酶的SDSPAGE檢測圖Fig.11 SDS-PAGE analysis of strain ZWW8 chitinase purified by chitin affinity chromatography
本課題組從湖北省武漢地區的土壤中篩選得到一株能產生耐鹽幾丁質酶的細菌ZWW8,經鑒定其屬于無色桿菌屬,目前國內外關于無色桿菌屬發酵產幾丁質酶的研究非常少,在無色桿菌屬所在的產堿桿菌科(Alcaligenaceae),也僅發現氧化木糖產堿桿菌(Alcaligenes xylosoxydans)可產生幾丁質酶[21-23],而該菌種現在也已經被鑒定為氧化木糖無色桿菌(Achromobacter xylosoxidans)。我們通過單因素試驗優化了ZWW8菌株在液體培養基中發酵產胞外幾丁質酶的的培養條件。不同碳源對該菌株分泌胞外幾丁質酶的影響較大,以膠體幾丁質為碳源時,發酵產幾丁質酶量最高,粉末幾丁質次之。這可能是因為膠體幾丁質表面積較大,容易被ZWW8菌株本底表達的少量幾丁質酶降解產生可溶的幾丁寡糖,進一步誘導該菌株大量表達幾丁質酶。當以膠體殼聚糖、葡萄糖、水溶性殼聚糖和N-乙酰氨基葡萄糖為碳源時,ZWW8菌株均不產生幾丁質酶,這與付星所報道的巴倫葛茲類芽孢桿菌(Paenibacillus barengoltzii CAU904)較相似[24]。說明大部分細菌的幾丁質酶主要為誘導酶,幾丁質及其降解產物能誘導細菌幾丁質酶的表達。氮源對ZWW8菌株產生幾丁質酶也有明顯影響,銨鹽和蛋白胨作為氮源時幾丁質酶的表達量較高,尿素和硝酸鹽作為氮源時幾丁質酶的表達量較低。這與疣孢漆斑菌(Myrothecium verrucaria)較相似[25],1.4 g/L 硫酸銨和 0.1 g/L-0.5 g/L尿素能使該菌株幾丁質酶產量提高4倍。此外,可能因為缺乏其生長所需維生素等的生長因子,ZWW8菌株在合成培養基中生長非常緩慢。因此,在對ZWW8菌株產酶條件優化過程中,各發酵培養基中均額外添加了3 g/L的酵母粉以提供生長因子,也補充了有機氮源。Vaidya[21]也發現添加少量酵母粉或蛋白胨等有機氮源能顯著提高A. xylosoxydans幾丁質酶的產量。
pH對產酶的影響實驗表明,無色桿菌ZWW8在比較廣的pH范圍(5-9)均能產生幾丁質酶,在pH 7時產酶量最高,當pH>7時產酶量明顯下降。大多數細菌產幾丁質酶的最適pH 在中性或者略偏酸性。之前報道的液化無色桿菌A. liquefaciens在pH 6.5時幾丁質酶產量最高[11]。發酵溫度對胞外幾丁質酶產量也有重要影響,大部分細菌的最適產酶溫度在30-37℃,如唐德鏈霉菌(Streptomyces tendae)在37℃時幾丁質酶產量最高[26]。ZWW8菌株在28℃幾乎不分泌胞外幾丁質酶。隨著培養溫度升高,幾丁質酶產量逐漸增加,37℃時達到最高,這與A.liquefaciens發酵產生幾丁質酶的最適溫度40℃結果比較相似[11]。當溫度進一步上升則胞外幾丁質酶產量開始下降,這可能是由于高溫條件下幾丁質酶表達量和穩定性均有所下降。通過檢測發酵時間對產酶量的影響,發現ZWW8菌株培養1 d后就開始大量分泌幾丁質酶,在第2天達到峰值,隨后產酶量開始明顯下降。這與在第3天幾丁質酶產量最高的A.xylosoxydans相比[21],無色桿菌ZWW8的產酶周期較短,更有利于降低生產成本。ZWW8菌株在優化后的發酵培養基中37℃發酵2 d,胞外上清的酶活力可達到33.9 U/L,比優化前(4.2 U/L)提高了約8倍。不同研究中對于酶活力單位的定義有所差別,如果將酶活力單位(U)統一為每分鐘產生1 μmol的N-乙酰氨基葡萄糖所需的酶量,A. xylosoxydans經過產酶條件優化后,幾丁質酶產量可達到483 U/L[22]。因此Achromobacter sp. ZWW8的產酶量處于較低水平,發酵條件還有待進一步優化。
通過對ZWW8菌株幾丁質酶的酶學性質進行研究,我們發現溫度對幾丁質酶活性有顯著影響,無色桿菌ZWW8幾丁質酶在較廣的溫度范圍(10-65℃)具有水解活性,最適反應溫度為50℃。A. denitrificans幾丁質酶的最佳反應溫度為35℃[13],與之相比,無色桿菌ZWW8幾丁質酶不僅低溫活性較強,還具有良好的耐熱性。pH也對幾丁質酶活性有較大影響,ZWW8菌株幾丁質酶在pH 5-7范圍內均有較高的活性,最適反應pH為 5.5,為酸性幾丁質酶,而A. denitrificans幾丁質酶的最佳反應pH為7.0[13]。在金屬離子對ZWW8幾丁質酶活性的影響中,Ca2+和Ni2+對酶活有一定促進作用,Hg2+能完全抑制酶活。之前報道的A. denitrificans幾丁質酶的活性也會被Ca2+激活,而被Hg2+抑制[13]。此外,值得注意的是ZWW8菌株幾丁質酶在高鹽條件下具有活性和穩定性,這對幾丁質酶在低水活度條件下的應用具有重要價值。ZWW8菌株幾丁質酶的活性隨著NaCl濃度上升而逐漸下降。最適反應鹽濃度為1%,但當NaCl濃度為25%時,仍然能保持最大活性的64%。同時,NaCl濃度還能明顯增強熱穩定性,ZWW8菌株幾丁質酶在20%NaCl條件下55℃保溫30 min后還能維持近70%的活性。與只有在1 mmol/L NaCl以下才有活性的A. denitrificans幾丁質酶相比[13],ZWW8菌株的幾丁質酶有很好的耐鹽性,能在高鹽條件下維持其活性和穩定性。高鹽濃度還能促進ZWW8菌株幾丁質酶對幾丁質的特異性結合,這說明其幾丁質酶可能含有幾丁質結合區,有研究表明高鹽濃度通過增強幾丁質結合區中芳香族氨基酸殘基與幾丁質的疏水相互作用來提高結合能力[27]。通過幾丁質親和層析柱在高鹽條件下對ZWW8菌株的幾丁質酶進行了初步純化,SDS-PAGE檢測結果表明該菌株能分泌多種可特異性結合幾丁質的蛋白質,并具有幾丁質酶活性。許多微生物能同時分泌內切幾丁質酶、外切幾丁質酶和N-乙酰葡萄糖胺糖苷酶等多種幾丁質水解酶。例如,海洋細菌(Pseudoalteromonas piscicida strain O-7)可產生5個幾丁質酶和3個β-N-乙酰葡萄糖胺糖苷酶,它們協同作用降解含幾丁質生物質,為微生物代謝提供營養[28]。
本研究中Achromobacter sp. ZWW8所分泌的幾丁質酶具有耐熱和耐鹽等的優良特征,并與已報道的A. denitrificans和A. xylosoxydans的幾丁質酶有明顯差異。在后續研究中,我們將對ZWW8菌株進行全基因組測序,結合生物信息學分析該菌株幾丁質酶基因的表達調控機制,采用代謝調控手段進一步提高幾丁質酶表達量。此外,還將對ZWW8菌株的胞外幾丁質酶進行蛋白質譜檢測,通過與全基因組序列比對獲得各幾丁質酶基因,構建重組質粒并對它們進行異源表達和純化,對它們的酶學性質及耐熱耐鹽的分子機制進行進一步研究,為開發在低水活度條件下具有良好活性和穩定性的生物催化劑提供新的理論依據和設計思路,對于幾丁質資源的開發利用具有重要的理論意義和應用價值。
4 結論
本研究以湖北武漢地區土壤中篩選得到的能降解幾丁質膠體的菌株ZWW8為研究對象,通過16S rDNA序列測定及構建系統發育樹,初步鑒定該菌株為無色桿菌屬。通過檢測碳源、氮源、溫度、培養基pH和培養時間對幾丁質酶產量的影響對發酵條件進行優化,Achromobacter sp. ZWW8在添加0.5%幾丁質膠體,0.5% NH4Cl,初始pH 7.0的培養基中,于37℃培養2 d后胞外上清酶活力可達到33.9 U/L,是優化前酶活力的8倍。ZWW8菌株分泌胞外幾丁質酶最適反應pH為5,最適反應溫度為50℃。Ca2+能提高幾丁質酶活性,Hg2+、Cu2+和Zn2+等金屬離子能明顯抑制酶活。ZWW8菌株的胞外幾丁質酶不僅在高鹽條件維持活性和穩定性,還能特異性結合幾丁質,并通過幾丁質親和層析對胞外幾丁質酶進行了初步純化。

