出生24 h內外周血炎性標志物在NEOS中的水平及NEOS病原菌分布
薛 霖,王 佳
江蘇省南京市浦口區中心醫院/江蘇省人民醫院浦口分院:1.臨床基因擴增實驗室;2.檢驗科,江蘇南京 211899
新生兒由于免疫系統、皮膚黏膜屏障發育不健全,抵抗力低,極易發生感染。感染是導致新生兒死亡的主要原因之一。新生兒早發型敗血癥(NEOS)起病隱匿,進展快,具有較高的病死率,已成為世界范圍內新生兒科面臨的巨大挑戰[1]。因此,早期診斷并及時進行臨床干預對NEOS至關重要。外周血炎性標志物,如超敏C反應蛋白(hs-CRP)、血清降鈣素原(PCT)、白細胞計數(WBC)及中性粒細胞/淋巴細胞比值(NLR)等具有檢測快速、便捷、價廉等優點,同時其水平在炎性反應初期可出現明顯變化。其中PCT在感染發生后4 h即可升高[2],被認為是鑒別細菌感染的良好炎性標志物而廣泛應用于臨床。然而,新生兒時期外周血炎性標志物變化情況與成人不同[3],有研究報道,新生兒血清PCT水平在出生后48 h內可出現生理性升高[4]。分析新生兒出生早期(出生24 h內)炎性標志物特點方面的文獻報道較少,因此,本研究收集2014年7月至2017年12月于本院出生的新生兒資料,回顧性分析NEOS的病原菌分布,旨在評估新生兒出生24 h內炎性標志物對NEOS的診斷價值,為臨床早期診斷NEOS提供參考。
1 資料與方法
1.1一般資料 選擇2014年7月至2017年12月于本院出生的363例NEOS患兒納入NEOS組。其中足月兒66例,早產兒297例。NEOS定義為出生72 h內發生的敗血癥。NEOS組患兒納入標準:符合相應臨床癥狀,同時滿足實驗室培養結果,(1)應用抗菌藥物前血培養或無菌體液培養出致病菌;(2)若培養結果為條件致病菌,須兩份標本從無菌體液或血培養中檢測出同一菌種[5]。選取同期入院的88例非感染性疾病新生兒納入對照組。其中足月兒31例,早產兒57例。低出生體質量:出生體質量<2 500 g;極低出生體質量:出生體質量≤1 500 g。排除標準:社區獲得性感染及病歷資料不全的患兒。
1.2儀器與試劑 所用儀器包括全自動血培養儀(BacT/ALERT 3D,法國生物梅里埃)、全自動細菌鑒定及藥敏分析系統(VITEK-2,法國生物梅里埃)、全自動血液分析儀(ADVIA 2120,美國拜耳)、干式免疫分析儀(i-Reader,上海艾瑞德)、PCT分析儀(BRAHMS PCT-Q,德國)。采用儀器配套試劑進行檢測。血培養接種平板采用血平板和巧克力平板(廣州迪景)。細菌培養質控菌株:大腸埃希菌ATCC25922、肺炎克雷伯菌ATCC700603、金黃色葡萄球菌ATCC25923、銅綠假單胞菌 ATCC27853。
1.3方法
1.3.1血培養方法 在NEOS患兒發熱、應用抗菌藥物前采集2~5 mL靜脈血于培養瓶中,置于全自動血培養儀進行檢測。血培養報陽后,同時接種于血平板和巧克力平板,分離出單個菌落制成0.5麥氏濁度菌懸液,采用全自動細菌鑒定及藥敏分析系統進行鑒定。
1.3.2出生24 h內血清炎性標志物檢測 PCT:采集患兒靜脈血2~5 mL,凝固后3 000 r/min離心10 min分離血清,經免疫色譜層析法(BRAHMS PCT-Q,德國)進行檢測,以PCT≥0.5 ng/mL為陽性。hs-CRP:采集EDTA抗凝血,采用免疫層析法(i-Reader,上海艾瑞德)進行檢測,正常值<10 mg/L。EDTA抗凝血采集后混勻,經全自動血液分析儀ADVIA 2120及其配套試劑進行血常規檢測。
1.4觀察指標 (1)比較兩組患兒胎齡、性別、體質量、1 min與5 min Apgar評分、住院時間、死亡情況。(2)比較兩組患兒出生24 h內外周血炎性標志物水平。(3)分析NEOS患兒病原菌分布情況。(4)評估外周血炎性標志物對NEOS的診斷效能。(5)451例患兒共獲得147例患兒母親資料,其中NEOS組83例,對照組64例。分析兩組患兒母親的圍生期相關影響因素,包括孕次、產次、生產方式、產前發熱、胎膜早破、羊水異常(包括羊水減少、羊水增多、羊水渾濁、血性羊水)。
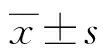
2 結 果
2.1兩組一般資料比較 兩組在胎齡、體質量、低出生體質量患兒比例、5 min Apgar評分、住院時間方面比較,差異有統計意義(P<0.05),見表1。所有患兒的臨床表現以新生兒肺炎(115例)、新生兒呼吸窘迫綜合征(90例)、先天性心臟病(40例)、新生兒高膽紅素血癥(50例)、新生兒黃疸(38例)為主。
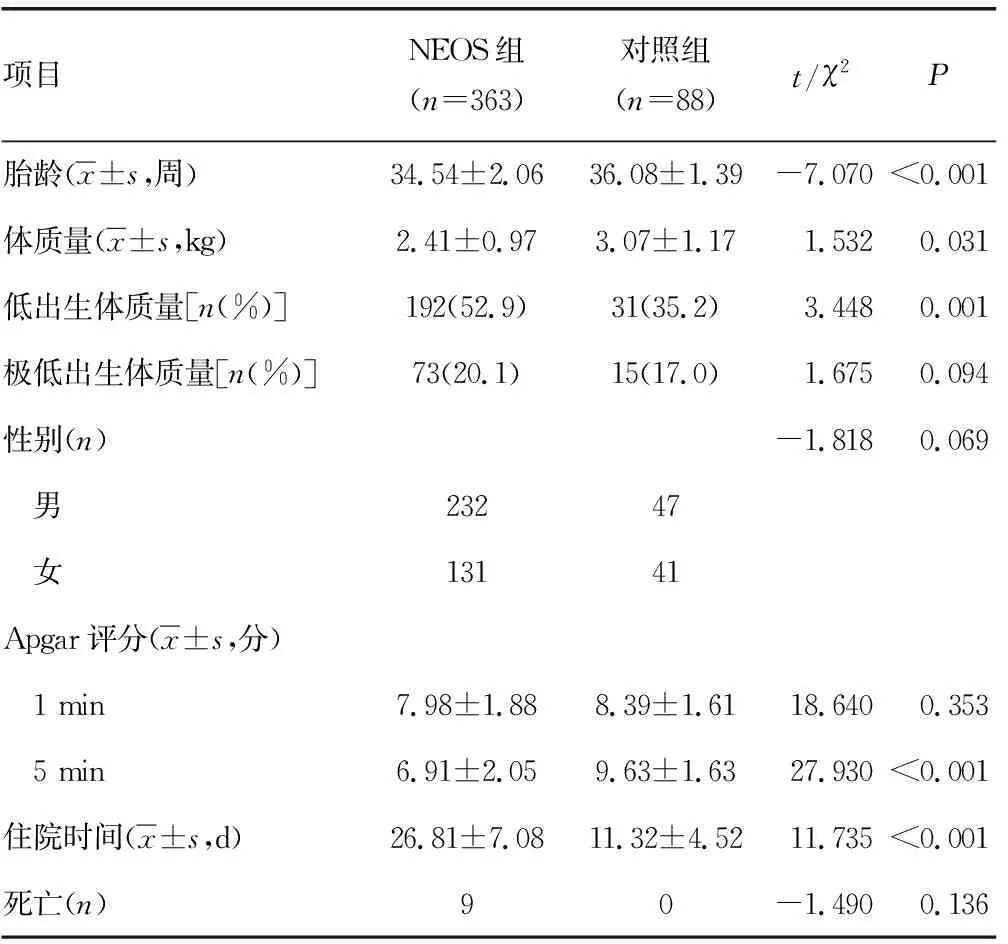
表1 一般資料在兩組間比較
2.2兩組患兒出生24 h內外周血炎性標志物水平比較 NEOS組患兒血清PCT、WBC、NLR水平明顯高于對照組,差異有統計學意義(P<0.05)。見表2。
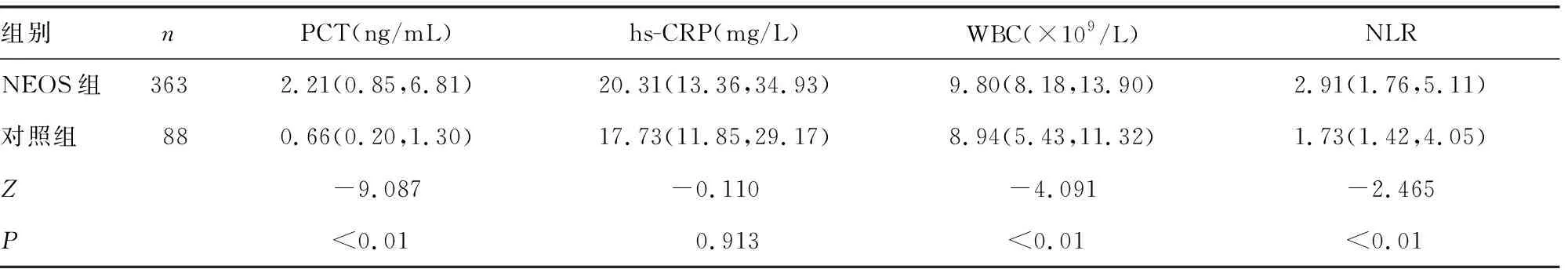
表2 兩組患兒出生24 h內外周血炎性標志物水平比較[M(P25,P75)]
2.3NEOS病原菌分布情況 NEOS患兒共培養出革蘭陰性菌168例,革蘭陽性菌177例,真菌18例。革蘭陰性菌分別為大腸埃希菌(72例)、肺炎克雷伯菌(46例)、陰溝腸桿菌(13例)、鮑曼不動桿菌(7例)、其他革蘭陰性菌(30例)。革蘭陽性菌以凝固酶陰性葡萄球菌為主(77例),其他還包括金黃色葡萄球菌(37例)、無乳鏈球菌(33例)、耐甲氧西林凝固酶陰性葡萄球菌(MRCNS,22例)、腸球菌(8例)。檢出真菌18例,為白色念珠菌(10例)、近平滑念珠菌(5例)和熱帶念珠菌(3例)。
2.4出生24 h內的外周血炎性標志物對NEOS的診斷效能 ROC曲線分析結果顯示,血清PCT的曲線下面積最大,具有較高的靈敏度和特異度,見表3、圖1。由于新生兒血清PCT基線水平與成人不同,為了明確該炎性標志物在NEOS中的變化特點,與同期對照組的早產兒和足月兒進行比較,結果顯示兩組血清PCT水平變化趨勢不同(P<0.05)。NEOS組24~<48 h達到高峰,72 h后下降,而對照組在24 h內達到峰值。見表4。

表3 出生24 h內的外周血炎性標志物對NEOS的診斷效能
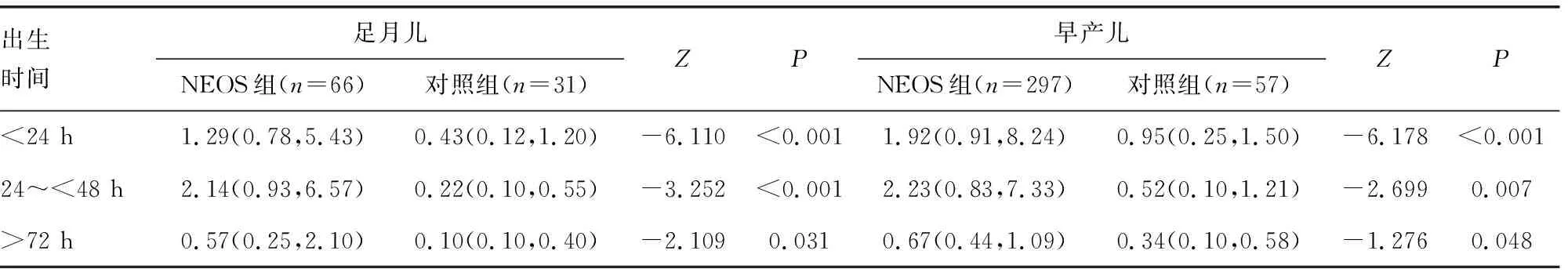
表4 不同時間段血清PCT在兩組間的變化趨勢[M(P25,P75),ng/mL]
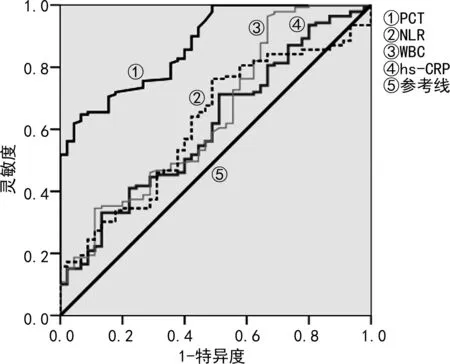
圖1 出生24 h內外周血炎性標志物預測NEOS的ROC曲線
2.5兩組患兒母親圍生期相關影響因素比較 在孕次、產次、胎膜早破、產前發熱、羊水異常方面,兩組間差異無統計學意義(P>0.05),兩組間生產方式差異有統計學意義(P<0.05)。見表5。
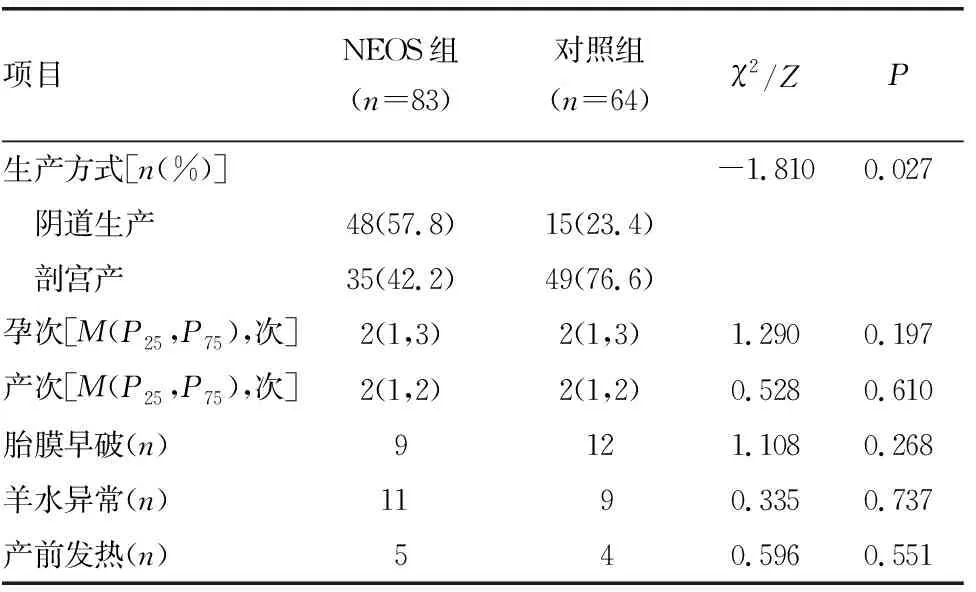
表5 兩組患兒母親圍生期相關影響因素比較
3 討 論
新生兒敗血癥根據敗血癥的發病時間分為NEOS和晚發型敗血癥(LOS)[6]。NEOS在發展中國家具有較高的發病率,有研究報道NEOS(出生<48 h)發生率高達59.33%[7]。據報道,我國住院NEOS發病率高達5.0%[8]。相比足月兒,早產兒具有更高的患病風險[9]。為了明確引起NEOS的相關因素,本研究分析了患兒母親圍生期相關影響因素,納入了孕次、產次、胎膜早破、羊水異常等因素,發現胎膜早破、羊水異常、產前發熱、孕次、產次與NEOS無關(P>0.05),而兩組間生產方式差異有統計學意義(P<0.05)。本研究中血培養結果發現大腸埃希菌、凝固酶陰性葡萄球菌、肺炎克雷伯菌在NEOS中占較高比例。大腸埃希菌是育齡期女性陰道常見定植菌,提示NEOS患兒多數經產道感染。而作為女性生殖道常見細菌,無乳鏈球菌在本研究中僅培養出33例,與其他研究[10]比較,培養陽性率較低,其原因在于本院已開展孕產婦無乳鏈球菌篩查項目,多數篩查陽性孕產婦已進行抗菌藥物治療。凝固酶陰性葡萄球菌和肺炎克雷伯菌是醫院感染的常見病原菌,新生兒發育不健全,免疫力低下,極易發生醫院感染[11]。這提示臨床對于新生兒等免疫力低下人群應減少廣譜抗菌藥物使用,避免侵入性檢查。
血培養的缺點是陽性率低且培養周期較長。血清PCT作為一種靈敏的炎性標志物,在革蘭陰性菌內毒素刺激下呈高水平表達,在感染后2~4 h迅速升高。本研究檢測了新生兒出生24 h內常見的幾種炎性標志物的水平,發現除hs-CRP外,NEOS組與對照組血清PCT、WBC、NLR水平差異有統計學意義(P<0.05)。本研究發現,hs-CRP在出生后普遍升高,無法在早期鑒別診斷NEOS。其原因在于C反應蛋白屬急性時相反應蛋白,易受多種因素影響,在分娩、早產、發生新生兒窒息及胎糞吸入時均可導致其水平升高。同樣,由于新生兒WBC波動幅度大,因此也不宜作為NEOS的早期診斷指標。CHIESA等[12]通過分析早產兒與足月兒血清PCT水平發現,胎齡以及新生兒出生后PCT的檢測時間對PCT水平有一定影響。本研究經ROC曲線分析證實血清PCT在新生兒出生24 h內即具有較高的診斷效能,并發現血清PCT在NEOS組和對照組中水平和升高趨勢不同。有研究報道,血清PCT在新生兒中呈生理性升高且與胎齡具有一定相關性[13]。本研究中對照組研究對象血清PCT水平雖有升高,然而呈低水平表達,在24 h內達到峰值后緩慢下降。而NEOS組患兒血清PCT水平則表現為完全不同的變化趨勢:在24~<48 h達到峰值,在>72 h開始下降。這提示動態監測血清PCT水平有助于判斷新生兒感染、監測抗菌藥物療效。
綜上所述,血清PCT的診斷效能優于其他炎性標志物,能夠早期預測NEOS,為臨床治療提供參考。

