垂體后葉素致滲透性脫髓鞘綜合征1例
劉全生,曾小鳳,張雯凌,吳 濤
1.川北醫學院附屬醫院神經內科,四川南充 637000;2.川北醫學院附屬醫院全科醫學科,四川南充 637000;3.四川省宜賓市第二人民醫院全科醫學科,四川宜賓 644000
滲透性脫髓鞘綜合征(ODS)又稱為滲透性髓鞘溶解綜合征,是一種急性非炎性中樞神經脫髓鞘病變。ODS的主要特點是臨床癥狀與影像學表現不同步,易被漏診和誤診。ODS在成年人中很少見(0.40%~0.56%)[1]。國內關于使用垂體后葉素導致ODS報道較少。現將川北醫學院附屬醫院神經內科收治的1例因使用垂體后葉素引起低鈉血癥導致ODS的病例報道如下。
1 臨床資料
患者,男,42歲,因“發熱、咳嗽半月,咯血1周,精神行為異常3 d” 于2019年4月9日就診于川北醫學院附屬醫院。入院前半月患者無明顯誘因出現發熱、咳嗽,最高體溫達39 ℃,咳少量白色黏液痰,于當地醫院輸液治療3 d無緩解。入院前1周,患者出現咯血2次(具體咯血量不詳)于當地縣人民醫院住院治療,完善相關檢查考慮診斷“支氣管擴張伴感染”,予以頭孢噻肟2 g 每日兩次、垂體后葉素12 U每日1次靜脈滴注及輸注等滲溶液等治療。入院前3 d患者出現精神行為異常,主要表現為記憶力減退、言語減少,反應遲鈍,伴非噴射性嘔吐,嘔吐物為胃內容物,伴食欲不振、腹瀉,入院前7 h患者出現意識障礙、呼之不應,轉入川北醫學院附屬醫院神經內科進一步診治。院外輔助檢查4月2日血常規、電解質未見異常,甲狀腺功能指標血清游離三碘甲狀腺原氨酸(FT3)、血清游離甲狀腺素(FT4)、促甲狀腺激素(TSH)及皮質醇激素正常。4月6日血常規:白細胞計數7.89×109/L、中性粒細胞比例80.1%;電解質:鉀3.59 mmol/L、鈉112.8 mmol/L、氯77.2 mmol/L,予以3%氯化鈉溶液輸入糾正低鈉血癥、停用垂體后葉素。4月7日查電解質:鉀3.32 mmol/L、鈉108.1 mmol/L、氯73.6 mmol/L。4月8日查電解質:鉀2.96 mmol/L、鈉137.0 mmol/L、氯99.0 mmol/L。既往史:患者20年前曾診斷為肺結核,治療經過不詳,未定期復診。近3年患者反復咳嗽、咳痰,予以口服藥物治療后有緩解(具體不詳)。余無特殊。
入院查體:體溫38.2 ℃,脈搏94次/分,呼吸27次/分,血壓125/63 mm Hg。胸廓無畸形,雙肺呼吸音粗,未聞及明顯干濕啰音及胸膜摩擦音。心臟及腹部查體未見明顯異常。專科查體:昏睡,疼痛刺激可睜眼,問之不答,高級神經功能檢查不配合,頸阻陽性,雙眼球居中、無震顫,雙側瞳孔等大等圓、對光反射靈敏,鼻唇溝對稱,口角無歪斜,伸舌不配合,四肢查體不合作,疼痛刺激可見四肢活動,四肢肌張力正常,四肢深反射減弱,雙側病理征陰性。
入住川北醫學院附屬醫院神經內科時,血常規:白細胞計數10.91×109/L、中性粒細胞比例84.6%;生化分析1:總蛋白64.2 g/L、清蛋白35.4 g/L、鉀2.96 mmol/L、鈉135.2 mmol/L、氯101.0 mmol/L、葡萄糖7.78 mmol/L;頭顱CT:右側額葉點狀鈣化灶;胸部CT:雙肺散在多形性病變,考慮繼發性肺結核,目前以纖維化、鈣化灶為主,雙肺上葉、右肺中葉多發支氣管擴張,雙肺上葉尖后段多發肺大皰形成。
診治經過:患者入住川北醫學院附屬醫院神經內科重癥監護室,考慮診斷為顱內感染、代謝性腦病,下病危通知,監測生命體征,吸氧,予降顱內壓、抗感染、營養支持、維持內環境平衡等治療。入院當天查頭顱MRI:彌散加權成像(DWI)顯示雙側額顳頂部腦回分布稍高信號(圖1)。完善腰椎穿刺術測腦脊液壓力142.8 mm H2O,腦脊液清亮,常規、生化項目未見異常,涂片未查見細菌、抗酸桿菌、真菌,腦脊液及血清自身免疫性腦炎抗體陰性。結合患者病史及院外檢查結果考慮為ODS,予抗感染、大劑量激素+丙種球蛋白、降顱內壓、維持水電解質平衡等治療。7 d后復查頭顱MRI+MRV:雙側基底節呈對稱性T1WI低信號、T2WI及T2液體衰減反轉回復序列(FLAIR)高信號,雙側背側丘腦、雙顳葉、枕葉及腦干內可見條片樣腦白質彌散受限,頭部MRV未見異常(圖2)。復查影像支持ODS的診斷,給予上述治療后患者病情無明顯好轉。于2019年5月20日出院時患者呈去皮質狀態,出院診斷:(1)ODS;(2)支氣管擴張伴感染;(3)陳舊性肺結核;(4)電解質代謝紊亂;(5)肺大皰;(6)雙下肢深靜脈血栓形成;(7)低蛋白血癥。
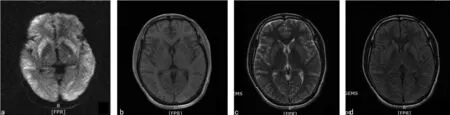
注:a為DWI示雙側基底節、顳葉高信號;b為T1WI示雙側基底節稍高信號;c為T2WI示雙側基底節稍高信號;d為FLAIR示雙側基底節稍高信號。
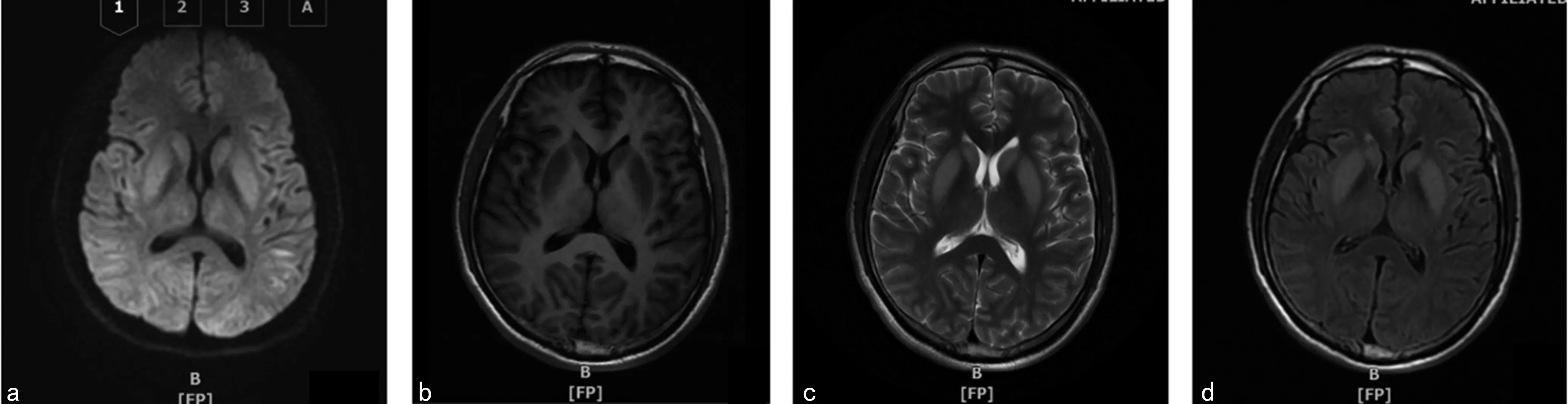
注:a為DWI示雙側基底節、背側丘腦、枕葉、顳葉對稱性高信號;b為T1WI示雙側基底節對稱性高信號;c為T2WI示雙側基底節對稱性高信號;d為FLAIR示雙側基底節對稱性高信號。
2 討 論
ODS根據發生部位分為腦橋中央髓鞘溶解癥 (CPM)和腦橋外髓鞘溶解癥(EPM),兩者可以單獨存在也可同時發生。當涉及腦橋、皮質和皮質脊髓束時,經典表現為構音障礙、吞咽困難以及松弛性麻痹轉變為痙攣。如果病變進一步擴展,可導致動眼功能障礙和閉鎖綜合征。EPM的特征是震顫、共濟失調和運動障礙,例如緘默癥、帕金森病、肌張力障礙和緊張癥[2]。當腦橋和腦橋外病變同時存在時,臨床表現通常是混合且可變的。
ODS較早的病例見于慢性酒精中毒和營養不良,從20世紀70年代研究者開始提出ODS與快速糾正低鈉血癥有關。本例患者因咯血使用垂體后葉素,排除其他導致重度低鈉血癥原因,檢索文獻及相關報道,考慮垂體后葉素引起的嚴重低鈉血癥[3]。
垂體后葉素是從豬、牛等動物的腦垂體后葉中提取的水溶性成分,由催產素和血管加壓素(抗利尿激素)組成。血管加壓素通過激活位于血管平滑肌細胞中的V1受體引起血管收縮,從而達到止血目的;同時血管加壓素可激活腎集合管細胞基底外側膜的V2受體,使頂端細胞膜的透水性顯著增加以促進水的重吸收,從而降低血漿滲透壓。當患者有肺部疾病時,位于胸腔內容量感受器的信號傳導障礙,對各種刺激所致的抗利尿激素抑制或分泌有異常反應,靜脈滴注垂體后葉素時,可引發抗利尿激素分泌不當綜合征,增加了尿鈉的排出,使血鈉更低。且本例患者有食欲不振、腹瀉的癥狀,可進一步加重低鈉血癥。
急性低鈉血癥時細胞水腫,無機離子從腦細胞內轉移到細胞外間隙以減輕水腫,當滲透壓恢復時,這些無機離子可迅速轉移至細胞內。而慢性低鈉血癥時,電解質和有機滲透物的丟失是調節腦容量的有效機制[4]。當慢性低鈉血癥被過快糾正,有機滲透物的再攝取比低鈉血癥適應期有機滲透物的丟失慢得多,細胞內、外水快速轉移到血管引起少突膠質細胞脫水和髓鞘退化,導致腦橋和腦橋外結構中的少突膠質細胞凋亡,出現髓鞘脫失、溶解,即ODS[5]。
ODS的組織病理學特點是髓鞘破壞但神經元及軸突相對完好,無炎性反應及血管改變,病變呈對稱性。目前頭顱MRI是臨床診斷 ODS的關鍵。ODS患者頭顱MRI影像學改變可表現為病灶在 T2WI和T2 FLAIR顯示高信號,在 T1WI顯示低信號,DWI早期顯示高信號。DWI、T2和T2 FLAIR序列在ODS診斷中具有同等的價值[6]。本病例頭顱MRI影像學改變符合ODS影像學特點。有研究顯示約20% ODS患者最初頭顱MRI是正常的,往往在發病后1~2周才顯示病灶。因此對于高度懷疑ODS且早期(<7 d)MRI檢查病變不明顯的患者,應在1~2周后復查頭顱MRI。
ODS是由先前的原發疾病引起的繼發性神經系統疾病。多數ODS患者在數周內死亡,少數存活患者遺留不同程度的不可逆性神經損害,后果嚴重。
目前對ODS的治療仍處于試驗階段,主要有類固醇皮質激素、靜脈注射丙種球蛋白、血漿置換以及高壓氧等治療方法[7],但尚無循證學依據。故在臨床診療過程中應重視ODS的預防,尤其是慢性低鈉血癥的患者在糾正低鈉的過程中需謹慎,補鈉的速度應緩慢,24 h血鈉升高水平不超過10 mmol/L。當患者有血鈉水平≤120 mmol/L和(或)低鈉血癥持續時間>48 h、低鉀血癥、飲酒、營養不良、肝病晚期等ODS高危因素時,24 h血鈉升高水平推薦4~6 mmol/L、24 h不超過8 mmol/L,每4~6小時復查血鈉水平[8],及時調整速度。如還存在低鉀血癥,則須先糾正低鉀血癥[9]。
ODS在臨床上發生較少,后果嚴重。該病極易被漏診和誤診。本文報道1例使用垂體后葉素出現低鈉血癥,過快糾正血鈉引起ODS的病例,回顧了相關文獻,以期對臨床醫師認識、預防和診斷該病有所幫助。

