利多卡因聯(lián)合瑞舒伐他汀治療不耐受胺碘酮的急性冠狀動脈綜合征伴急性心律失常的臨床療效
崔國艷,鄭 雯,張麗偉
(遼陽市中心醫(yī)院 心血管內(nèi)科, 遼寧 遼陽 111000)
急性冠狀動脈綜合征(acute coronary syndrome, ACS)是因冠狀動脈不穩(wěn)定斑塊破裂、脫落以及出血形成血栓導(dǎo)致的心肌急性缺血綜合征。急性心律失常是重癥ACS患者最為常見的并發(fā)癥之一,近年來有研究發(fā)現(xiàn)該合并癥的發(fā)病過程是多因素參與的結(jié)果,其中自由基產(chǎn)生和炎性因子的釋放會進(jìn)一步破壞斑塊、加劇病情[1]。胺碘酮是常用抗心律失常藥物,但是部分患者服藥后會出現(xiàn)QT間期延長、甲狀腺功能異常等反應(yīng)而終止使用[2]。胺碘酮導(dǎo)致QT間期延長則反映復(fù)極化延長,有可能是達(dá)到治療濃度的征象,也可能是毒性效應(yīng)[3]。在《2018歐洲甲狀腺協(xié)會胺碘酮相關(guān)甲狀腺功能障礙的管理指南》[4]中指出胺碘酮會導(dǎo)致包括甲狀腺功能減退(AIH)、甲狀腺功能亢進(jìn)(AIT)等不良現(xiàn)象,嚴(yán)重者可能會危及患者的生命。目前《心律失常緊急處理專家共識》[5]將胺碘酮作為首選,在胺碘酮不能應(yīng)用時(shí)推薦使用利多卡因。近年研究報(bào)道,瑞舒伐他汀可改善患者心肌功能,具有良好的抗心律失常作用[6]。本研究旨在探討利多卡因與瑞舒伐他汀聯(lián)合用藥在不耐受胺碘酮的ACS伴急性心律失常患者治療中的價(jià)值,期望能夠?yàn)椴煌愋突颊叩闹委熖峁椭?/p>
1 資料與方法
1.1病例選擇 選取2014年4月-2018年4月間收治的ACS伴急性心律失常患者110例,按照治療方法分成2組,對照組55例,男性37例,女性18例,年齡52~74歲,平均(61.72±5.24)歲,病程在8個(gè)月~2年,平均(13.40±2.28)個(gè)月;Killip-Ⅰ級者27例、Ⅱ級18例、Ⅲ級10例;觀察組55例,男性34例,女性21例,年齡50~77歲,平均(62.04±5.12)歲,病程在10個(gè)月~2.2年,平均(13.36±2.40)個(gè)月;Killip-Ⅰ級者29例、Ⅱ級17例、Ⅲ級9例,兩組基線資料差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。本研究經(jīng)醫(yī)院倫理委員會批準(zhǔn)。
1.2納入和排除標(biāo)準(zhǔn) 納入標(biāo)準(zhǔn):符合美國心臟病學(xué)會(American College of Cardiology, ACC)制定的《急性冠狀動脈綜合征指南》[7]中診斷標(biāo)準(zhǔn)者;心電圖檢查顯示室速、心房顫動等心律失常指征者;無法緊急行PCI治療者;胺碘酮治療后3~7d后出現(xiàn)心電圖QT間期延長、甲狀腺功能亢進(jìn)或減退等異常現(xiàn)象,停藥后癥狀有所改善者[8];患者及家屬對實(shí)驗(yàn)知情且自愿簽署授權(quán)書者。排除標(biāo)準(zhǔn):精神疾病導(dǎo)致交流障礙患者,伴有肝腎等臟器功能損傷者;合并實(shí)體或血液惡性腫瘤者, 伴系統(tǒng)性紅斑狼瘡、甲狀腺功能亢進(jìn)等自身免疫性疾病,合并機(jī)體感染性疾病者。
1.3方法 對照組:均常規(guī)行溶栓、抗凝(低分子肝素)治療,溶栓劑為尿激酶(建議劑量為150萬U,30分鐘內(nèi)靜脈滴注),低分子肝素皮下注射7500~1萬U,12h/次。同時(shí)給予利多卡因,初始取50 mg利多卡因靜脈注射,10分鐘內(nèi)注射完畢。之后給予10 mg/0.5 mg/kg靜脈推注治療,至患者室性期前收縮消失,再給予1~4 mg/min靜脈滴注。
觀察組:在對照組的基礎(chǔ)上,加用瑞舒伐他汀口服治療,依據(jù)患者心血管危險(xiǎn)性調(diào)整劑量,初始劑量5 mg/(次·d),無異常后逐漸調(diào)整至20 mg/d。兩組均連續(xù)治療8周。
1.4觀察指標(biāo) (1)血清炎性因子檢測。于治療前、治療后清晨空腹?fàn)顟B(tài)抽肘靜脈血液3 ml,3 000 r/min離心10 min,取上層血清使用ELISA法測定細(xì)胞腫瘤壞死因子-α(TNF-α)、超敏C反應(yīng)蛋白(hs-CRP)水平,試劑盒由上海晶抗生物工程有限公司提供,嚴(yán)格遵照說明書操作。(2)心率變異指標(biāo)。采用深圳博英BI9900系列動態(tài)心電圖工作站進(jìn)行24h動態(tài)心電圖監(jiān)測,采集24h動態(tài)心電信號,計(jì)算RR間期總體標(biāo)準(zhǔn)差(SDNN)、RR間期平均值標(biāo)準(zhǔn)差(SDANN)、相鄰RR 間期差值均方根(RMSSD)、相鄰竇性RR間期差值超過50 ms心搏百分比(pNN50)。(3)超氧化物歧化酶檢測。在治療前1 d、治療結(jié)束時(shí)測定黃嘌呤氧化酶法測定血清中超氧化物歧化酶(SOD)、使用硫代巴比妥酸法測定丙二醛(MDA)水平變化。
1.5療效判定標(biāo)準(zhǔn) 依據(jù)《中華醫(yī)學(xué)會AMI診斷與治療指南(2014版)》[8]中判定標(biāo)準(zhǔn)進(jìn)行評估,顯效:成對室性期前收縮、非持續(xù)性室性心動過速消失,室性期前收縮減少≥90%;有效:成對室性期前收縮、非持續(xù)性室速減少≥80%,或室性期前收縮降幅在50~90%間;無效:成對室性期前收縮、非持續(xù)性室速減少<80%, 室性期前收縮降幅<50%。
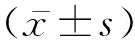
2 結(jié) 果
2.1兩組臨床療效比較 連續(xù)治療8周后,觀察組總有效率高于對照組(P=0.047),見表1。

表1 兩組治療總有效率比較[例(%)]
2.2兩組心率變異性(HRV)指標(biāo)比較 兩組治療前HRV無明顯差異(P>0.05);治療后兩組HRV指標(biāo)均明顯提高,且組間比較有統(tǒng)計(jì)學(xué)意義(P<0.05),見表2。
2.3兩組血清炎性因子水平比較 治療前兩組hs-CRP、TNF-α水平差異無統(tǒng)計(jì)學(xué)意義(P>0.05),治療后觀察組hs-CRP、TNF-α水平顯著低于對照組(P<0.05),見表3。
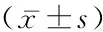
表2 兩組HRV比較
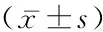
表3 兩組血清炎性因子水平變化
2.4兩組SOD和MDA水平比較 治療前兩組SOD和MDA水平差異無統(tǒng)計(jì)學(xué)意義,治療后觀察組SOD水平均高于對照組,MDA水平低于對照組(P<0.05),見表4。
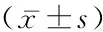
表4 兩組SOD、MDA水平比較
3 討 論
ACS嚴(yán)重缺血時(shí),心肌細(xì)胞電活動和能量代謝紊亂導(dǎo)致心肌復(fù)極不均一性,血液中兒茶酚胺濃度、脂肪酸濃度異常升高,心肌自律收縮受阻而產(chǎn)生心律失常。胺碘酮是一種多通道阻斷劑,能夠表現(xiàn)出Ⅰ~Ⅳ類抗心律失常藥物的電生理作用,是臨床上ACS心律失常患者首選治療藥物[9-10],但Ⅱ~Ⅲ度房室傳導(dǎo)阻滯、甲狀腺功能異常以及病態(tài)竇房結(jié)綜合征是胺碘酮使用的禁忌證[11]。對于不能耐受胺碘酮的ACS伴急性心律失常患者,選擇一種效用類似、安全性高的藥物成為研究的重點(diǎn)。
利多卡因是1B類抗心律失常藥物,作用于希-浦肯野纖維系統(tǒng)及心室肌細(xì)胞,能夠降低浦肯野纖維自律性,加速鉀離子外流,并且縮短動作電位時(shí)程,延長有效不應(yīng)期,因此可以作為胺碘酮的替代品改善惡性心律失常的癥狀[12]。瑞舒伐他汀可通過結(jié)合三羥基三甲基戊二酰輔酶A還原酶,抑制酶還原活性而有效調(diào)節(jié)脂代謝,有助于血管內(nèi)皮功能改善,減少心肌缺血損傷程度并對缺血心肌灌注,有效調(diào)節(jié)心肌肌膜生脂肪酸的成分和生化特性,促進(jìn)跨膜離子通道的穩(wěn)定性,發(fā)揮改善心肌傳導(dǎo)和興奮性作用,有效減少心律失常的發(fā)生[6]。兩種藥物發(fā)揮協(xié)同作用,可有效提高抗心律失常的臨床療效。
ACS患者普遍存在自主神經(jīng)系統(tǒng)功能受損的情況。ACS患者發(fā)生心臟不良事件與迷走神經(jīng)張力降低有關(guān),當(dāng)迷走神經(jīng)張力下降導(dǎo)致對抗交感神經(jīng)張力作用減弱,使交感神經(jīng)活動處于明顯優(yōu)勢,則會導(dǎo)致心肌電活動穩(wěn)定性下降,從而增加折返性心室顫動、心動過速現(xiàn)象誘發(fā)急性心律失常[13-14]。HRV是評估心臟自主神經(jīng)系統(tǒng)功能的有效指標(biāo)。本研究結(jié)果顯示,治療后兩組HRV指標(biāo)均明顯提高,且觀察組HRV改善程度優(yōu)于對照組,表明聯(lián)合用藥在逆轉(zhuǎn)心臟自主神經(jīng)系統(tǒng)功能障礙方面具有積極作用,可能與瑞舒伐他汀能夠調(diào)節(jié)心肌興奮性、改善心肌缺血等重要作用有關(guān)。張輝等[15]表示,瑞舒伐他汀能夠改善心肌血管內(nèi)皮功能,調(diào)節(jié)心肌膜脂肪酸水平,穩(wěn)定跨膜離子通道,通過抑制心肌興奮性和離子傳導(dǎo)效率來緩解心肌損傷,與本研究結(jié)論一致。
ACS伴急性心律失常患者神經(jīng)內(nèi)分泌過度激活,并且出現(xiàn)氧化應(yīng)激和炎性反應(yīng)的相互作用,再加上神經(jīng)內(nèi)分泌系統(tǒng)共同參與心律失常的發(fā)生和進(jìn)展。CRP是冠狀動脈硬化患者冠狀動脈不良事件和預(yù)后的主要預(yù)測因素[16],人們發(fā)現(xiàn)ACS急性心律失常患者體內(nèi)巨噬細(xì)胞活化后會分泌大量TNF-α以及白細(xì)胞介素(IL),誘導(dǎo)干細(xì)胞生成更多的CRP,而CRP與脂蛋白結(jié)合激活補(bǔ)體系統(tǒng)致使心肌細(xì)胞損傷[17-18]。已有研究認(rèn)為,他汀類藥物具有降脂作用,并且抑制黏附因子并上調(diào)內(nèi)皮一氧化氮(NO)的合成,降低超氧化物、γ干擾素、TNF-α等炎性因子的釋放[19]。許長青等[20]研究報(bào)道,應(yīng)用瑞舒伐他汀治療急性腦梗死,可顯著降低血清炎癥細(xì)胞因子高遷移率組蛋白1、白介素等炎癥介質(zhì)濃度,有助促進(jìn)神經(jīng)功能的恢復(fù)。蘭振和等[6]研究指出,舒伐他汀藥物可降低ACS合并心律失常患者炎癥因子水平。本研究結(jié)果顯示,兩組治療后炎性因子水平均明顯下降,觀察組CRP、TNF-α降幅顯著高于對照組,說明瑞舒伐他汀聯(lián)合利多卡因可更好地消除機(jī)體炎性因子,與上述研究結(jié)論一致。
氧自由基與心律失常發(fā)生密切相關(guān)[21-22]。活性氧(ROS)在心律失常中發(fā)揮巨大作用,ROS升高對心肌細(xì)胞內(nèi)Na+電流的影響是導(dǎo)致急性心律失常的主要機(jī)制;此外氧化應(yīng)激反應(yīng)導(dǎo)致心肌動作電位傳導(dǎo)屏障發(fā)生折返,導(dǎo)致心律失常發(fā)生。SOD是一種可有效清除機(jī)體氧化自由基的抗氧化酶,能夠通過降低氧自由基水平來緩解心肌細(xì)胞和血管平滑肌損傷。MDA是生物體內(nèi)自由基作用于脂質(zhì)產(chǎn)生過氧化反應(yīng)最終產(chǎn)物,同樣是反映機(jī)體氧自由基水平的重要指標(biāo)之一。氧自由基會延長心肌電位時(shí)程,同時(shí)引起早期去極化,減慢心肌細(xì)胞去極化速度和降低其興奮性誘使急性心律失常發(fā)生[23]。本研究結(jié)果顯示治療后兩組SOD水平均明顯升高,而MDA水平則顯著下降,提示經(jīng)治療后患者機(jī)體氧自由基水平明顯減少;觀察組兩項(xiàng)指標(biāo)變化幅度更為明顯,可能是因?yàn)槿鹗娣ニ∧軌蛱岣呖寡趸烙饔茫嵘杂苫宄芰Α?/p>
綜上所述,不耐受胺碘酮的ACS伴急性心律失常患者行利多卡因聯(lián)合瑞舒伐他汀治療能夠通過消除機(jī)體炎性因子、穩(wěn)定心肌電位、調(diào)節(jié)HRV等相關(guān)作用機(jī)制,有效改善心律失常癥狀,提升治療效果。

