308.2 K三元體系KCl+PEG10000/20000+H2O相平衡及熱力學計算
黃琴,于旭東,2,李茂蘭,鄭洪,曾英,2
(1 成都理工大學材料與化學化工學院,四川成都610059; 2 礦產資源化學四川省高等學校重點實驗室,四川成都610059)
引 言
鉀是農作物生長必需的營養元素之一,農業基礎鉀肥主要包含氯化鉀、硫酸鉀、硝酸鉀、磷酸二氫鉀等[1]。我國所需鉀肥數量大,2019 年11 月我國氯化鉀進口量為39萬噸,市場缺口較大。鉀鹽是鉀肥重要的礦物原料,我國已查明的鉀鹽(KCl)資源儲量為11 億噸,其中約77%賦存于鹽湖鹵水[2]。前期研究工作表明,在氯化物型鹵水中,鉀、鎂、銣、銫共存時,易形成多種形式的復鹽KCl·MgCl2·6H2O、RbCl·MgCl2·6H2O、CsCl·MgCl2·6H2O或固溶體[(Kx,Rb1-x)Cl]、[(Kx,Cs1-x)Cl]、[(Rbx,Cs1-x)Cl],使得鹽類作用關系異常復雜[3-6],采用常規的蒸發結晶工藝難以進行分離。
現有文獻中,通過在水鹽體系引入甲醇[7]、丙三醇[8]、乙醇[9]、乙二醇[10]、四甲基脲[11]等水溶性有機物,可利用鹽析效應實現鹽類的分離和純化。相較于低元醇和其他有機物,聚乙二醇(PEG)具有水溶性好、無毒、經濟、綠色環保等優點,而廣泛應用于鹽類的綠色分離提取。鹽類在聚乙二醇-水混合溶劑的溶解析出規律可用對應體系的相平衡與相圖進行描述。目前,國內外學者主要針對聚乙二醇分子量、鹽的種類以及溫度對混合溶劑體系的影響,完成了部分聚乙二醇-鹽-水混合溶劑體系相平衡研究[12-18],發現聚乙二醇分子量是混合溶劑體系相平衡關系的主要因素之一。因此,有必要開展不同分子量聚乙二醇條件下的混合溶劑體系相平衡研究,獲取對應條件下的相平衡關系和結晶析鹽規律。
本課題組已完成了三元體系KCl+PEG1000/4000/6000+H2O (288.2、298.2、308.2 K)[19-21]、三元體系CsCl+PEG1000/4000/6000+H2O(298.2 K)[22]和三元體系RbCl+PEG1000/4000+H2O(298.2 K)[23-24]相平衡研究。研究發現:含KCl三元體系中,溫度或聚乙二醇分子量發生改變時,體系僅存在固液平衡關系;含CsCl 或RbCl 的三元體系中,同一溫度下,隨著聚乙二醇分子量的增加,體系中相平衡關系發生改變,由僅存在固液相平衡關系,變化為同時存在固液和液液相平衡關系,表明聚乙二醇分子量對混合溶劑相平衡關系有一定的影響。因此,為進一步研究聚乙二醇分子量對三元體系KCl+PEG+H2O 的影響,本文完成了308.2 K 三元體系KCl+PEG10000/20000+H2O 相平衡研究,并采用Chen-NRTL-PDH模型[25]對液液平衡實驗數據進行了理論計算。
1 實驗材料和方法
1.1 實驗試劑與儀器
主要試劑:氯化鉀(純度99.5%,國藥集團化學試劑有限公司)在378.2~383.2 K 干燥2 h,冷卻后置于干燥器中備用;聚乙二醇10000、聚乙二醇20000(純度99.0%,國藥集團化學試劑有限公司)在323.2 K 干燥5 d,冷卻后置于干燥器中備用;實驗室用水均為去離子水κ ≤5.5×10-6S?m-1。
主要儀器:Practum224-1CN 型電子分析天平(Sartorius 科學儀器(北京)有限公司);HH-601A 高精度超級恒溫水浴(常州市金壇友聯儀器研究所);WYA 型阿貝折射儀(上海儀電物理光學儀器公司);DA-130N 電子密度計(日本京都電子公司);UPT-II-20T 實驗室超純水機(四川優普超純科技有限公司);SPX-150 生化培養箱(北京市永光明醫療器械有限公司)。
1.2 實驗方法
固液相平衡研究采用等溫溶解平衡法,具體方法如下:使用分析天平準確配制一系列不同質量比[mPEG/(mPEG+ mH2O)]的聚乙二醇-水(PEG-H2O)混合溶液。在PEG-H2O 混合溶液中加入過量KCl,使用磁力攪拌器進行攪拌,所配試樣置于SPX-150 生化培養箱中進行控溫,整個過程需保持鹽過量。定期取上層清液,測定其折射率,以折射率不變作為達到平衡依據。待試樣達到平衡后,停止攪拌,靜置24 h 后固液分離,分別取上層清液和平衡固相進行化學分析,同時采用DA-130N 電子密度計測定溶液密度,采用WYA 阿貝折射儀同時配以HH-601A 超級恒溫水浴測定溶液的折射率。
液液相平衡研究采用濁點法測定雙液線組成,根據雙液線組成測定結線數據。具體方法如下:在平衡管中準確配制20 g 濃度已知的KCl 溶液,置于SPX-150 生化培養箱中并使用磁力攪拌器攪拌,逐次向溶液中加入約0.02 g 聚乙二醇,直至溶液變渾濁,準確記錄KCl、H2O 和PEG 的質量,即可計算得到雙液線上的一個組成點;向渾濁溶液中逐滴加入去離子水,待溶液澄清后,重復以上步驟,記錄每次加入的H2O 和PEG 的質量,即可得到一系列雙液線組成點。根據雙液線組成,在平衡管中配制系列不同組成的混合溶液,使用磁力攪拌器攪拌72 h 使其充分混合,靜置24 h,待試樣分成清晰透明的上下兩相,分取上下兩相測定其組成,即可得到結線數據。
1.3 分析方法
采用AgNO3容量法[26]確定平衡液相中的Cl-含量,即可得到液相中的KCl 含量。采用折射率標準曲線法[27]測定固液平衡中的PEG 含量,采用雙液線方程法[28]測定結線中的PEG含量,具體如下。
折射率標準曲線法:在稀溶液中,溶液的折射率與鹽、PEG的含量存在線性關系。
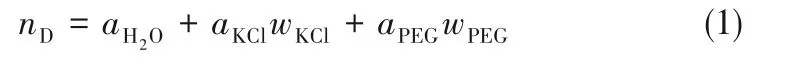
式中,nD表示溶液折射率,aH2O為實驗溫度下超純水的折射率,wKCl、wPEG分別代表KCl和聚乙二醇的質量分數,aKCl、aPEG為擬合參數。298.2 K 時aH2O=1.3325、aKCl=0.1335、aPEG10000=0.1324、aPEG20000=0.1320。
雙液線方程法:分析得到結線中KCl含量后,根據式(2)[29]對雙液線數據進行非線性回歸便可計算得到結線組成中的PEG含量wPEG。
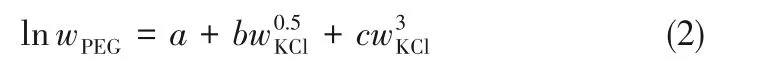
式中,a、b、c 為方程參數,根據實驗雙液線數據通過最小二乘法回歸得到,各值列于表1中。
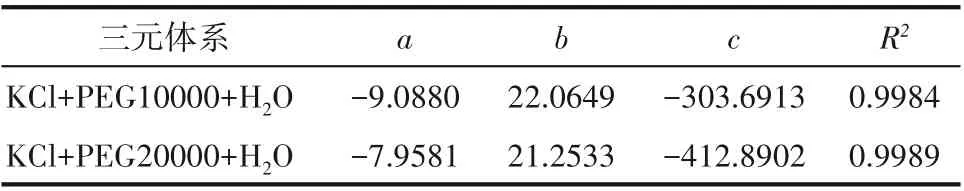
表1 回歸參數值Table 1 Parameters of regression
2 實驗結果與討論
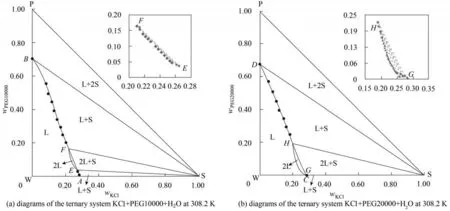
圖1 三元體系KCl+PEG10000/20000+H2O 308.2 K 完整相圖Fig.1 Diagrams of the ternary systems KCl+PEG10000/20000+H2O at 308.2 K

表2 三元體系KCl+PEG10000/20000+H2O 308.2 K、94.77 kPa固液平衡實驗數據Table 2 Solid-liquid equilibrium data for ternary systems KCl+PEG10000/20000+H2O at T=308.2 K and pressure p=94.77 kPa
KCl+PEG10000/20000+H2O三元體系308.2 K固液平衡時的溶解度、固相組成、密度及折射率數據列于表2,雙液線組成及結線組成分別列于表3和表4,其中,wKCl、wPEG分別代表KCl 和聚乙二醇的質量分數。根據表2~表4數據,繪制了308.2 K時三元體系KCl+PEG10000/20000+H2O 的完整相圖,見圖1。圖1中,點A、C為308.2 K時KCl在純水中的溶解度,點B 和點D 分別為308.2 K 時PEG10000、PEG20000在純水中的飽和點,點E、G為雙液線的起點,點F、H為雙液線的終點。線EF 和GH 分別為兩個體系的雙液線,即不飽和液相區(L)和液-液平衡相區(2L)的分界線。兩個體系的完整相圖均包含6 個區域:不飽和液相區(L)、2 個一固一液區(L+S)、雙液相區(2L)、兩液一固區(2L+S)以及一液兩固區(L+2S),其中,一液兩固區(L+2S)中的兩種固相分別為KCl 和PEG10000/PEG20000。在完整相圖中,一固一液區面積最大,雙液相區面積最小。
由表2 可知,聚乙二醇在純水中的飽和點隨其分子量增大而降低,且在固-液平衡區域,KCl 溶解度隨溶液中聚乙二醇含量增大而降低,其原因主要在于混合溶劑的介電常數逐步減小,導致K+與水分子間的靜電吸引作用減小,K+與Cl-之間的締合作用增強而結晶析出。固液平衡時,平衡液相的密度隨溶液中聚乙二醇含量的增加而增大,折射率隨溶液中聚乙二醇含量的增加而減小。二者的變化規律分別與三元體系KCl+PEG1000/4000/6000+H2O 308.2 K[19-21]時的平衡液相密度和折射率變化規律一致。
采用濁點法測定了三元體系KCl+PEG10000/20000+H2O 雙液線組成,雙液線上各點組成如表3所示。根據表3 數據繪制了三元體系KCl+PEG10000/20000+H2O 雙液線對比圖,如圖2 所示。由圖可知:隨著聚乙二醇分子量的增加,雙液線往左移動靠近原點,雙液線長度增加,雙液相區(2L)增大,說明隨著PEG 含量的增大,形成兩相時所需的KCl含量降低。

表3 三元體系KCl+PEG10000/20000+H2O 308.2 K、94.77 kPa液液平衡實驗數據Table 3 Liquid-liquid equilibrium data of ternary systems KCl+PEG10000/20000+H2O at T=308.2 K and pressure p=94.77 kPa
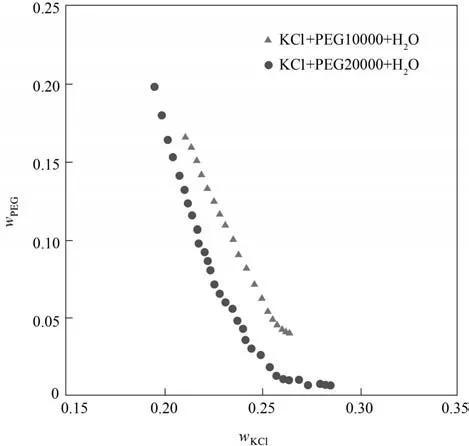
圖2 三元體系KCl+PEG10000/20000+H2O 308.2 K雙液線對比圖Fig.2 Comparison of binodal curves of ternary systems KCl+PEG10000/20000+H2O at 308.2 K
表4中,Kpc是兩相間KCl的分配系數,采用式(3)進行計算。TLL(tie line length)是結線的長度,STL(slope of tie line)為結線的斜率,二者用于反映液-液平衡中上下兩相組分間的濃度差異。二者計算公式分別為式(4)和式(5)[30-31]。
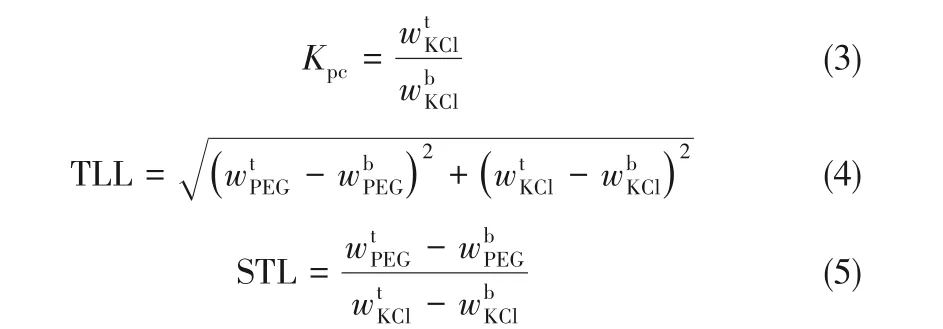
式中,上角標t與b分別表示分層體系的上相與下相。結果表明,在三元體系KCl+PEG10000/20000+H2O 的雙液相區,隨著結線原始組成中PEG含量的增加,KCl 的分配系數Kpc減小,TLL 和STL 的值增大,表明PEG 逐漸富集在上相,KCl逐漸富集在下相,且KCl 富集程度大于PEG 的富集程度。在含不同分子量PEG 的混合溶劑體系中,通過增加PEG的分子量,TLL 的值增大,對應結線長度增大,STL的值減小,對應結線斜率增大,這一現象表明,在一定的鹽濃度差下,兩相間的PEG 濃度差增大,說明隨著PEG 分子量的增大,PEG 與鹽的互溶性降低,更容易形成兩相。
表4 三元體系KCl+PEG10000/20000+H2O 308.2 K、94.77 kPa結線實驗數據Table 4 Experimental data of tie lines of ternary systems KCl+PEG10000/20000+H2O at T=308.2 K and pressure p=94.77 kPa
在液液平衡關系中,為了檢驗實驗中所獲得結線數據的可靠性,通常采用經驗方程對結線數據進行關聯計算。本文采用四種不同的經驗方程:Othmer-Tobias 方程[32]、Bancroft 方程[33]、Hand 方程[34]和Bachman 經驗方程[35]對結線數據進行關聯計算,見式(6)~式(9):
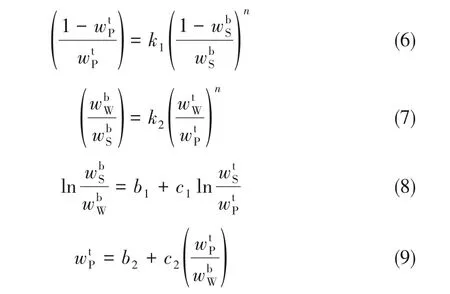
式中,下角標S、P、W 分別代表鹽、聚乙二醇與水,由關聯結果可知,308.2 K 時,三元體系KCl+PEG10000+H2O 的結線組成由上述四個經驗方程關聯后與雙液線的線性相關系數R2分別為0.9927、0.9894、0.9898、1;三元體系KCl+PEG20000+H2O 關聯后的四個線性相關系數R2分別為0.9965、0.9982、0.9983、1,表明實驗測得的結線數據有較好的可靠性。
為考察不同分子量聚乙二醇對體系相平衡關系的影響,結合本課題組已完成的三元體系KCl+PEG1000/4000/6000+H2O(308.2 K)相平衡研究[19-21]結果,繪制了308.2 K 溫度下的5 個不同聚乙二醇分子量(PEG1000/4000/6000/10000/20000)的三元體系KCl+PEG+H2O 完整相圖對比圖,如圖3 所示。分析圖3可知:308.2 K時,三元體系KCl+PEG1000/4000/6000+H2O只存在固液平衡關系;當混合溶劑中的組成為PEG10000 或PEG20000 時,該體系同時存在固液平衡和液液平衡關系,其對應的完整相圖與三元體系KCl+PEG1000/4000/6000+H2O 相比,增加了雙液相區(2L)、兩液一固區(2L+S)和1個一固一液區(L+S)。對比三元體系KCl+PEG10000/20000+H2O 的完整相圖,隨著聚乙二醇分子量的增加,雙液相區(2L)和兩液一固區(2L+S)增大,不飽和液相區(L)和2 個一固一液區(L+S)均減小。
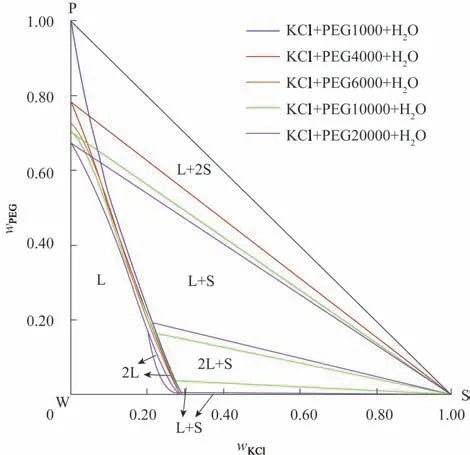
圖3 三元體系KCl+PEG1000/4000/6000/10000/20000+H2O 308.2 K完整相圖對比Fig.3 Diagrams comparison of ternary systems KCl+PEG1000/4000/6000/10000/20000+H2O at 308.2K
結合已有文獻分析[36-38]可知:聚乙二醇分子量是影響相平衡關系的主要因素之一。隨著聚乙二醇分子量的增大,PEG 與H2O 分子形成的氫鍵作用將減弱,當這種氫鍵作用小于K+對H2O 的靜電吸引時,K+與H2O 分子形成的離子締合體將破壞PEG 和H2O 分子間形成的溶劑分子締合體,從而使得兩相體系更容易出現;同時,聚乙二醇分子量的增加表明其分子鏈增長,導致了聚乙二醇的疏水性增大,在水中的溶解度降低,有利于兩相的形成。
3 熱力學計算
Zafarani-Moattar 等[39]采 用Chen-NRTL-PDH 模型[25],對三元體系PVP-NaH2PO4-H2O(293.2、298.2、303.2 K)液液相平衡進行了計算,計算結果與實驗結果吻合較好[22]。鑒于此,本文采用Chen-NRTL-PDH模型[25,39]進行三元體系KCl+PEG10000/20000+H2O 308.2 K計算。
在該模型中,活度系數由三部分組成:長程貢獻項、組合貢獻項和短程貢獻項,如式(10)所示。
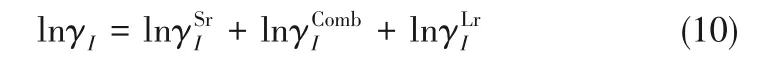
采用Pitzer–Debye–Hückel等式完成長程貢獻項的計算,見式(11)~式(15),其中,i 和j 分別代表離子和分子,1、2、3表示H2O、KCl和PEG。

式中,Zi表示離子電荷數;ρ表示最近距離參數,在電解質溶液中通常為14.9[40];Ix是以摩爾分數xi為計算基礎的離子間作用力;NA、K、ε、e 分別代表Avogadro 常數、Boltzmann 常數、介電常數以及電子電荷;VS代表混合溶劑的摩爾體積。
采用Flory-Huggins 等式計算組合貢獻項,見式(16)、式(17)。
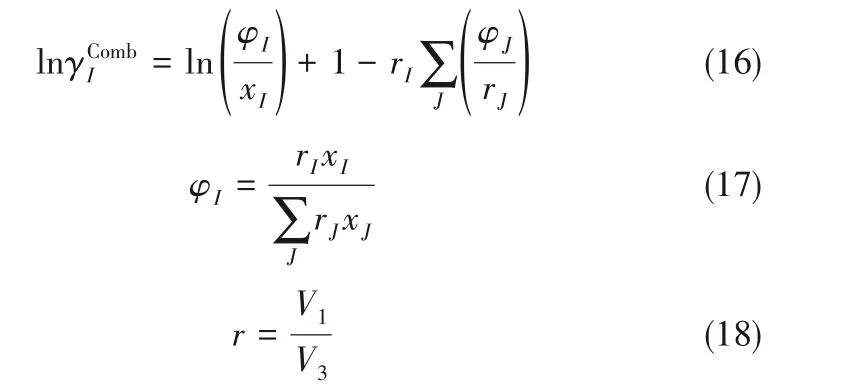
式中,I和J代表任意組分。對于離子和H2O,片段數r=1;對于聚合物,片段數計算見式(18)。式(19)~式(22)是Chen-NRTL 模型中的短程貢獻項的計算。與前人描述溶液組成的不同之處在于,該模型將分層體系的溶液分成了溶質、離子以及分子片段三部分,并用字母w、p、s、c、ca分別代表H2O、聚合物、聚合物片段、陽離子和鹽,陰離子活度系數計算公式與陽離子活度系數計算公式相似,離子與其他組分之間的相互作用大小相等。
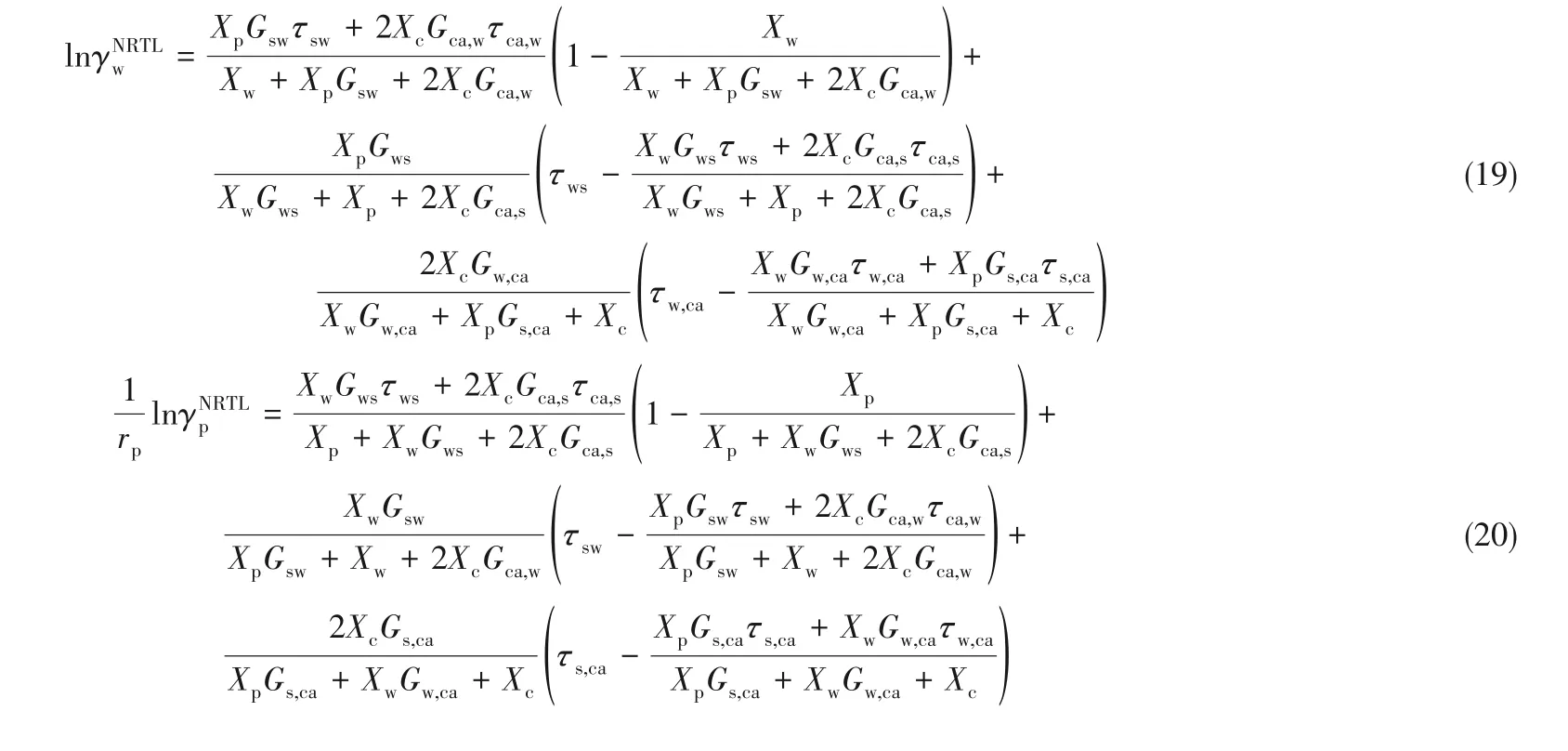
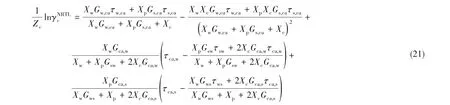
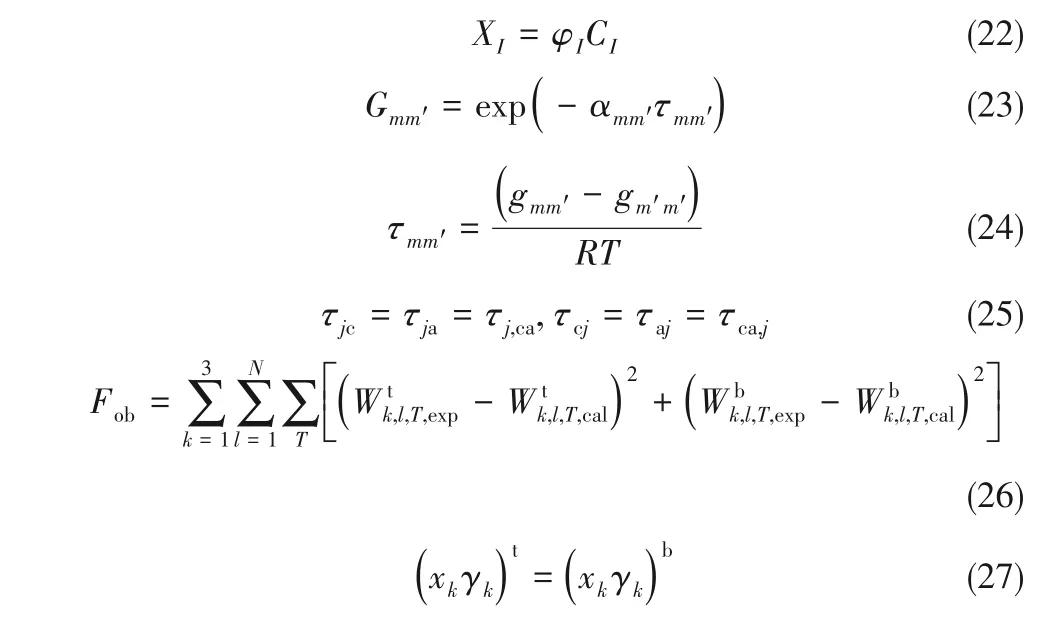
式中,XI是組分I 的有效局部摩爾分數;參數α通常取值為0.25;下角標m 和m′可代表任意組分;當組分I 表示離子時,CI=ZI;當組分I 表示聚合物或者H2O 時,CI=1;Wk,l,T是溫度為T時的第l條結線的百分含量組成。以式(26)和式(27)為約束條件,進行線性回歸,可得到交互參數τ 的值。該模型的標準偏差可由式(28)計算得到,其中,N表示結線數量。

熱力學計算所需參數列于表5,采用牛頓迭代法擬合得到的熱力學參數和計算數據分別列于表6和表7,其中,wKCl、wPEG分別代表KCl 和聚乙二醇的質量分數。根據計算數據繪制了結線對比圖,如圖4所示。結果表明,采用Chen-NRTL-PDH 模型對三元體系KCl+PEG10000/20000+H2O 在308.2 K 時進行液液平衡實驗數據計算,其計算值與實驗值吻合較好。
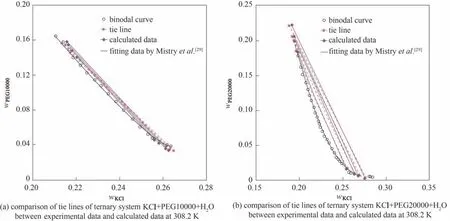
圖4 三元體系KCl+PEG10000/20000+H2O 308.2 K實驗結線與計算結線對比圖Fig.4 Comparison of tie lines of ternary systems KCl+PEG10000/20000+H2O between experimental data and calculated data at 308.2 K

表5 PEG10000/20000以及H2O在308.2 K時的物理性質參數[41-42]Table 5 Physical property parameters of PEG10000/20000 and H2O at 308.2 K[41-42]

表6 三元體系KCl+PEG10000/20000+H2O在308.2 K時的熱力學參數Table 6 Thermodynamic parameters of ternary systems KCl+PEG10000/20000+H2O at 308.2 K

表7 三元體系KCl+PEG10000/20000+H2O在308.2 K時的熱力學計算數據Table 7 Calculated data of ternary systems KCl+PEG10000/20000+H2O at 308.2 K
4 結 論
(1)308.2 K 下,三 元 體 系KCl+PEG10000/20000+H2O 均同時存在固液平衡和液液平衡關系;兩個體系的完整相圖構成相同,區域大小隨聚乙二醇分子量的變化而發生改變。隨著聚乙二醇分子量的增大,雙液相區(2L)和兩液一固區(2L+S)增大,不飽和液相區(L)和2 個一固一液區(L+S)均減小,其中一固一液區面積最大,雙液相區最小。
(2)對比三元體系KCl+PEG1000/4000/6000/10000/20000+H2O 308.2 K 時的完整相圖可知,聚乙二醇分子量對體系相平衡關系有影響。當聚乙二醇分子量為1000、4000 和6000 時,三元體系KCl+PEG+H2O 僅存在固液平衡關系,當聚乙二醇分子量為10000 和20000 時,三元體系KCl+PEG+H2O 同時存在固液和液液平衡關系。
(3)隨著聚乙二醇分子量的增大,更易形成液液相平衡;同時隨著PEG 分子量的增大,雙液線往左移動靠近原點,表明形成體系兩相時所需的KCl含量減少。
(4)采用Chen-NRTL-PDH 熱力學模型完成結線的熱力學計算,其計算結果與實驗數據吻合較好。

