大豆GmWIN1-6轉(zhuǎn)錄因子的鑒定、表達分析及鹽脅迫響應
蔡桂萍,劉寶玲,周雅莉,鄧咪咪,高慧玲,李 騰,張 莉,李潤植
(山西農(nóng)業(yè)大學農(nóng)學院,太谷 030801)
大豆(Glycine max)是我國甚至全球重要的油料作物,可食用和作為飼料[1]。大豆油是全世界食用油的主要來源之一,約占總植物油產(chǎn)量的28%[2]。其主要由5 種脂肪酸組成,包括2 種飽和脂肪酸[棕櫚酸(C16:0,約11.38%)、硬脂酸(C18:0,約4.29%)]和3 種不飽和脂肪酸[油酸(C18:1Δ9,約15.66%)、亞油酸(C18:2Δ9,12,約47.33%)和亞麻酸(C18:3Δ9,12,15,約15.40%)][3-4]。其中高含量的亞油酸可以降低血液中的膽固醇,預防心腦血管疾病。作為一種優(yōu)異的食用植物油,大豆油在全球的需求量日益增加。提高大豆油的產(chǎn)量始終是遺傳育種及大豆生產(chǎn)的一個主攻領域[5]。深入研究大豆種子油脂的生物合成及積累機制可為大豆遺傳改良提供理論基礎。
AP2/ERF(APETALA2/ethylene-responsive factor)蛋白家族包含220 多個成員,被認為是植物界最重要的轉(zhuǎn)錄因子超家族,其典型特征是含有60~70 個氨基酸組成的高度保守的DNA 結合結構域,即AP2結構域。該結構域由3 個β-轉(zhuǎn)角(beta turn)和1 個α-螺旋(alpha helix)構成。基于AP2 結構域的拷貝數(shù),AP2/ERF 家族可簡單分為4 個亞家族:AP2 亞家族、ERF亞家族、DREB亞家族、RAV 亞家族[6]。
WIN1(WAX INDUCER1/SHINE1)具有1個AP2結構域,又名SHN1,屬于ERF-B6 亞家族。此亞家族還具有其他2 個成員,即SHN2、SHN3,且功能與WIN1 相似[7-9],主要參與植物蠟質(zhì)和角質(zhì)的生物合成過程,可提高植物的抗逆性。WIN1也參與植物非生物脅迫反應,激活植物激素等信號通路,進而調(diào)控下游功能基因的表達[10]。蠟質(zhì)和三酰甘油(triacylglycerol,TAG)都屬于酯類化合物,因此,WIN1 在調(diào)控蠟質(zhì)時也能同時調(diào)控若干個油脂基因,顯著影響植物的油脂積累。近年來,人們已經(jīng)從甘藍型油菜(Brassica napus)、擬南芥(Arabidopsis thaliana)、大麥(Hordeum vulgare)等植物中分離得到了WIN1基因,并驗證了該蛋白的活性。例如:過表達甘藍型油菜BnWIN1基因后,其蠟質(zhì)含量增加了20%~22%,種子的含油量亦增加了8%[11]。在酵母中過表達擬南芥WIN1基因,使得酵母棕櫚油酸(C16:1)含量下降10%,然而C16:0、C18:1、C18:0、C20均有上升,且C20 含量增加了20%左右[7]。在轉(zhuǎn)基因擬南芥植物中組成型表達WIN1,與對照植物相比,其葉片表皮蠟質(zhì)累積提高4.5 倍,莖表皮蠟質(zhì)也有明顯的增加[12]。已有研究顯示,植物WIN1基因的表達模式具有時空特異性。如其在擬南芥花序、根中高表達,而在莖、長角果、蓮座葉中低表達[8,13];其在甘藍型油菜花蕾的表達量最高,在葉、根、發(fā)育中的種子、角果壁中的表達高于莖和第10 天的角果[11]。進一步深入研究不同植物中這些差異表達WIN1基因的具體生物學功能,有助于全面解析植物WIN1轉(zhuǎn)錄因子介導的調(diào)控網(wǎng)絡及作用機制。
為解析大豆WIN1 轉(zhuǎn)錄因子是否參與大豆油脂生物合成以及脅迫響應等生物學過程的調(diào)控,鑒定可用于大豆遺傳改良的優(yōu)異基因源,本文通過同源比對分析,從大豆基因組中鑒定獲得一個Gm-WIN1-6 轉(zhuǎn)錄因子,并克隆到該基因的開放閱讀框(open reading frame,ORF),應用生物信息學工具系統(tǒng)分析其蛋白結構及理化性質(zhì)等。采用半定量反轉(zhuǎn)錄PCR(semi-quantitative reverse transcription polymerase chain reaction,sqRT-PCR)和實時熒光定量反轉(zhuǎn)錄PCR(quantitative real-time reverse transcription polymerase chain reaction,qRT-PCR)技術分析Gm-WIN1-6 轉(zhuǎn)錄因子在大豆不同組織和不同發(fā)育種子中的時空表達模式以及對鹽脅迫的響應。研究結果預示著GmWIN1-6 可作為一個遺傳修飾靶標,進一步應用于提高大豆種子油脂富集和大豆抗脅迫的育種實踐中[14]。
1 材料與方法
1.1 材料
本試驗所用的大豆品種Jack,種植于山西農(nóng)業(yè)大學試驗田。試驗取材為:兩周齡的幼苗、根、莖、幼葉、盛花期的花、幼嫩的豆莢以及開花后25 d(種子1)、35 d(種子2)、45 d(種子3)的大豆種子;鹽脅迫處理0、2、6、9、12 h 的大豆幼苗葉片。所有樣品經(jīng)液氮速凍后儲存于-80℃?zhèn)溆谩?/p>
1.2 方法
1.2.1 大豆GmWIN1-6轉(zhuǎn)錄因子的鑒定及結構分析
選用模式生物擬南芥AtWIN1(At1g15360)的蛋白序列作為檢索序列blastp 大豆基因組數(shù)據(jù)庫soybase(https://soybase.org/),以此獲得GmWIN1-6轉(zhuǎn)錄因子的基因組序列、編碼序列(coding sequence,CDS)、氨基酸序列及染色體的位置信息。將檢索到的GmWIN1-6 轉(zhuǎn)錄因子的CDS 用NCBI-ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)數(shù)據(jù)庫檢測是否具有完整的ORF。將檢索到的GmWIN1-6 轉(zhuǎn)錄因子氨基酸序列用SMART(http://smart.embl-heidelberg.de/)和CDD(https://www.ncbi.nlm.nih.gov/cdd)數(shù)據(jù)庫進行分析,鑒定GmWIN1-6 轉(zhuǎn)錄因子蛋白序列的保守結構域。利用網(wǎng)站Gene Structure Display Server(http://gsds.gao-lab.org/index.php)對GmWIN1-6轉(zhuǎn)錄因子進行基因結構分析。
1.2.2 大豆GmWIN1-6蛋白的理化性質(zhì)及結構分析
用ExPASy 數(shù)據(jù)庫(https://www.expasy.org/)中的ProtParam 預測GmWIN1-6 轉(zhuǎn)錄因子的分子量、等電點、氨基酸數(shù)目等理化性質(zhì)[15],同時采用Ex-PASy 數(shù)據(jù)庫中的ProtScale 預測GmWIN1-6 轉(zhuǎn)錄因子的疏水性。通過在線工具TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)預測大豆GmWIN1-6 轉(zhuǎn)錄因子的跨膜結構區(qū)域,利用SOPMA 網(wǎng)站(https://npsaprabi.ibcp.fr/cgibin/npsa_automat.pl?page=/NPSA/npsa_sopma.htmL)預測GmWIN1-6轉(zhuǎn)錄因子的二級結構。用在線網(wǎng)站SWISS-MODEL(https://swissmodel.expasy.org/interactive)對Gm-WIN1-6轉(zhuǎn)錄因子進行三級結構預測分析并建模。
1.2.3 大豆GmWIN1-6 蛋白保守域鑒定及系統(tǒng)進化分析
從NCBI 數(shù)據(jù)庫中調(diào)取水稻(Oryza sativa)、紫花苜蓿(Medicago truncatula)、大麥和擬南芥的WIN1 蛋白序列,利用軟件GeneDoc 進行多序列比對(各物種的WIN1 信息見表1)。運用MEGA7.0軟件對擬南芥AtWIN1、AtSHN3、AtSHN2、水稻Os-SHN1、紫花苜蓿MtWIN1、大麥HvWIN1和大豆Gm-WIN1-6 轉(zhuǎn)錄因子的蛋白序列進行建樹,采用鄰接法(neighbor-joining)構建無根系統(tǒng)發(fā)育樹,自舉檢驗值設置為1 000個循環(huán)[16]。

表1 各物種WIN1信息Tab. 1 Information of WIN1 in different species
1.2.4 大豆RNA的提取、cDNA 的合成及基因克隆
根據(jù)北京全式金生物技術有限公司的Trizol 法提取大豆各組織的總RNA。利用江蘇省愛必夢生物科技有限公司的5×All-In-One RTMasterMix 反轉(zhuǎn)錄試劑盒合成cDNA。以cDNA 為模板,使用基因特異引物及2×GPV8 HF Polymerase Master(安徽通用生物有限公司)高保真酶擴增目的基因的ORF,目的片段經(jīng)凝膠回收和純化后連入pMD18-T 載體,并轉(zhuǎn)入大腸桿菌中。選取陽性菌,并在通用生物公司測序驗證。
1.2.5 大豆GmWIN1-6 轉(zhuǎn)錄因子的表達分析
使用Primer6.0 軟件,依據(jù)GmWIN1-6 轉(zhuǎn)錄因子編碼序列設計特異性引物(表2),采用NCBI 中的Primer-BLAST對引物進行鑒定。以上述大豆各組織的cDNA 為模板,利用GmWIN1-6 的特異性引物進行sqRT-PCR 和qRT-PCR 分析。選用大豆Actin作為內(nèi)參基因。依照TRAN 2×Easy Taq PCR Super Mix說明書提供的方法進行sqRT-PCR 分析。反應體系為:cDNA 模板0.5 μL,2×Easy Taq PCR Super Mix 5.0 μL,正向引物0.2 μL,反向引物0.2 μL,Nucleasefree Water 2.0 μL。反應程序為:94℃預變性5 min;變性94℃ 30 s,退火30 s,延伸72℃ 30 s,30~35 個循環(huán);終延伸72℃ 10 min。
依照TB Green? Premix Ex Taq? II(Tli RNaseH Plus,TaKaRa公司)說明書提供的方法進行qRT-PCR分析。反應體系為:cDNA 模板1.0 μL,TB Green-Premix Ex Taq 5.0 μL,正向引物0.4 μL,反向引物0.4 μL,ROX Reference Dye Ⅱ (50×) 0.2 μL,ddH2O 3.0 μL。反應程序為:95℃預變性30 s;95℃ 3 s,退火58℃ 30 s,40 個循環(huán)。反應在Bio-RadCFX96 TM熒光定量PCR 儀上進行。用公式2-ΔΔCq計算基因表達量,利用IBM SPSS Statistics 19 進行差異顯著性分析。

表2 檢測GmWIN1-6 轉(zhuǎn)錄因子表達的特異性引物Tab. 2 Specific primers for detecting the expression of GmWIN1-6 transcription factors
1.2.6 大豆幼苗的鹽脅迫處理
取大豆品種Jack 的種子,在黑暗條件下進行萌發(fā)。將種子種在營養(yǎng)土中,在光照培養(yǎng)箱中生長。設置培養(yǎng)箱條件為溫度25℃,相對濕度60%,光照/黑暗為14 h/10 h。播種14 d 后,篩選并保留長勢良好、狀態(tài)一致的幼苗,將幼苗移入200 mmol/L NaCl溶液中處理0、2、6、9、12 h 作為鹽脅迫[17]。液氮速凍后-80℃?zhèn)溆谩⒄?.2.4、1.2.5 中的方法分別提取不同時間的鹽脅迫幼苗的總RNA,反轉(zhuǎn)錄后進行GmWIN1-6的qRT-PCR 分析。
2 結果與分析
2.1 大豆GmWIN1-6 轉(zhuǎn)錄因子的鑒定及基因結構分析
利用AtWIN1 蛋白序列在大豆基因組數(shù)據(jù)庫中搜索,鑒定同源WIN1 蛋白。根據(jù)與AtWINI 的蛋白序列的相似性評分,將獲得的GmWIN1 轉(zhuǎn)錄因子命名為GmWIN1-6。通過SMART 和CDD 數(shù)據(jù)庫對獲得的GmWIN1-6 蛋白序列進行結構鑒定分析,發(fā)現(xiàn)GmWIN1-6 轉(zhuǎn)錄因子中含有1 個典型的AP2 保守結構域。利用在線Gene Structure Display Server 網(wǎng)站工具對GmWIN1-6 轉(zhuǎn)錄因子基因組DNA 進行內(nèi)含子、外顯子分析,發(fā)現(xiàn)該基因具5'和3'非翻譯區(qū),含2 個外顯子和1 個內(nèi)含子(圖1)。這與擬南芥AtWIN1 結構相似,應行使相同的功能。
2.2 大豆GmWIN1-6 轉(zhuǎn)錄因子CDS 的克隆
已知GmWIN1-6 轉(zhuǎn)錄因子在花中高表達,故以花的cDNA 為模板,通過高保真酶擴增目的序列,并將其與載體連接后轉(zhuǎn)入大腸桿菌中,涂篩選板挑取單克隆進行PCR 和測序驗證。單克隆菌液PCR 產(chǎn)物的電泳結果顯示(圖2),以空載為對照,GmWIN1-6 轉(zhuǎn)錄因子的3 個單克隆大腸桿菌PCR 產(chǎn)物條帶清晰,大小為529 bp。測序結果顯示,氨基酸沒有變化,只有部分堿基發(fā)生了變化,說明Gm-WIN1-6克隆成功。
2.3 大豆GmWIN1-6 轉(zhuǎn)錄因子的理化性質(zhì)及蛋白結構分析

圖1 GmWIN1-6轉(zhuǎn)錄因子的基因結構Fig. 1 Gene structure of GmWIN1-6 transcription factor

表3 GmWIN1-6 蛋白的理化性質(zhì)Tab. 3 Physicochemical properties of GmWIN1-6 protein
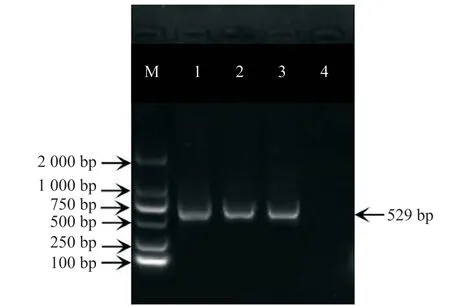
圖2 單克隆大腸桿菌PCR驗證Fig. 2 PCR verification of monoclonal Escherichia coli
用ExPASy 數(shù)據(jù)庫中的工具ProtParam 對Gm-WIN1-6 轉(zhuǎn)錄因子蛋白序列進行理化性質(zhì)分析。該蛋白長度為176 個氨基酸,相對分子質(zhì)量為19.81 kD,等電點為9.54,屬于不穩(wěn)定蛋白(表3)。用ProtScale 軟件預測GmWIN1-6 轉(zhuǎn)錄因子的疏水性,發(fā)現(xiàn)其親水性氨基酸多于疏水性氨基酸,屬于親水性蛋白(圖3)。用TMHMM 軟件預測Gm-WIN1-6 轉(zhuǎn)錄因子蛋白的跨膜結構域,結果發(fā)現(xiàn)其沒有明顯的跨膜結構域,說明GmWIN1-6 轉(zhuǎn)錄因子蛋白不是一個膜蛋白[18]。

圖3 GmWIN1-6 轉(zhuǎn)錄因子蛋白的疏水性Fig. 3 Hydrophobicity of GmWIN1-6 transcription factor protein
二級結構預測結果顯示(表4),GmWIN1-6 轉(zhuǎn)錄因子的氨基酸序列中α-螺旋、延伸鏈(extended strand)、β-轉(zhuǎn)角、無規(guī)則卷曲(random coil)分別占二級結構的31.82%、13.64%、6.25%、48.30%,無規(guī)則卷曲所占比例最高,推測其作用主要為連接其他二級結構元件[19]。用SWISS-MODEL 軟件分析GmWIN1-6 轉(zhuǎn)錄因子蛋白的三級結構(圖4),發(fā)現(xiàn)GmWIN1-6 蛋白與AtERF96 蛋白結構相似性為56.06%,推測其具有相似的功能。

表4 GmWIN1-6 蛋白的二級結構Tab. 4 The secondary structure of GmWIN1-6 protein

圖4 GmWIN1-6 蛋白的三級結構Fig. 4 Tertiary structure of GmWIN1-6 protein
2.4 大豆GmWIN1-6 轉(zhuǎn)錄因子的保守結構域及系統(tǒng)進化分析

圖5 大豆GmWIN1-6 轉(zhuǎn)錄因子的多序列比對和系統(tǒng)發(fā)育樹Fig. 5 Multiple sequence alignment and phylogenetic analysis of GmWIN1-6 transcription factor
利用DNAMAN 軟件將GmWIN1-6 轉(zhuǎn)錄因子的氨基酸序列與4 個不同物種(擬南芥、水稻、紫花苜蓿、大麥)的6 個WIN1 蛋白氨基酸序列進行同源性比對。比對結果(圖5a)顯示,7 個WIN1 轉(zhuǎn)錄因子在N 端均有一段約63 個氨基酸的保守序列,即AP2 結構域,為主要功能結構域。GmWIN1-6 轉(zhuǎn)錄因子包含了AP2 結構域的所有特征。GmWIN1-6還存在其他2 個結構域,分別是中間基序(middle motif,mm)和C端基序(C-terminus motif,cm)。Gm-WIN1-6 轉(zhuǎn)錄因子的中間基序與AtWIN1 的中間基序的關鍵氨基酸最為相似,C 端基序與其他4 個物種幾乎一致,預測其具有相同的功能。利用MEGA 7.0 軟件將GmWIN1-6 轉(zhuǎn)錄因子與其他4 個物種的WIN1 轉(zhuǎn)錄因子構建系統(tǒng)進化樹,結果表明(圖5b),GmWIN1-6 轉(zhuǎn)錄因子與擬南芥AtWIN1 的親緣關系較近。
2.5 大豆GmWIN1-6 轉(zhuǎn)錄因子在不同組織中的表達模式
用超微量核酸分析儀測定提取到的大豆各組織RNA 的濃度及純度,A260/A280的值均在2.0 左右,說明所提RNA 的純度較高。凝膠成像儀觀察分離的RNA 的電泳結果顯示,所提取大豆各組織的RNA 條帶清晰,質(zhì)量好,可用于后續(xù)試驗。
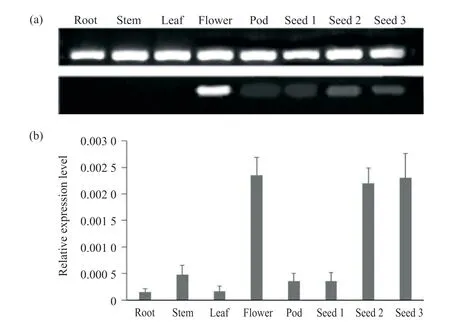
圖6 GmWIN1-6 轉(zhuǎn)錄因子的表達分析Fig. 6 Expression analysis of GmWIN1-6 transcription factor
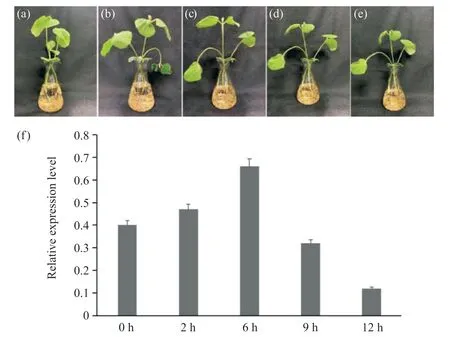
圖7 大豆幼苗鹽處理的不同階段及GmWIN1-6轉(zhuǎn)錄因子表達分析Fig. 7 Different stages of soybean seedlings under salt treatment and GmWIN1-6 expression analysis
為鑒定GmWIN1-6 轉(zhuǎn)錄因子的生物學功能,本文以大豆根、莖、葉、花、莢、種子1、種子2、種子3的cDNA 為模板,采用基因特異性引物進行sqRTPCR 和qRT-PCR。sqRT-PCR 結果顯示(圖6a),Gm-WIN1-6 轉(zhuǎn)錄因子在根、莖、葉中幾乎不表達,在花中表達最高。隨著種子的發(fā)育,該基因表達逐漸上調(diào),在種子發(fā)育中后期表達量較高,且與種子油脂積累時期相吻合。qRT-PCR 結果進一步表明(圖6b),該基因在花中的表達量最高,其次是種子發(fā)育中后期。這與sqRT-PCR 結果幾乎一致,說明Gm-WIN1-6 轉(zhuǎn)錄因子可能在花的發(fā)育和種子油脂積累的過程中行使功能。
2.6 大豆幼苗鹽脅迫下GmWIN1-6 轉(zhuǎn)錄因子的表達譜
鹽脅迫條件下,GmWIN1-6 轉(zhuǎn)錄因子在大豆幼苗的定量分析結果顯示(圖7),其在2、6、9、12 h與0 h 處理相比有明顯的變化,是先下降再上升,而后再下降的一個過程,在6 h 達到極值。說明Gm-WIN1-6 轉(zhuǎn)錄因子可能參與大豆幼苗鹽脅迫響應相應機制的調(diào)控。
3 討論
近年來,植物油在生物柴油、食品保健、化工制藥等方面的應用越來越廣泛,需求大于供給的市場極大地促進了油脂合成相關基因的研究[20]。WIN1作為蠟質(zhì)、油脂合成的關鍵轉(zhuǎn)錄因子,已成為人們研究的重點。現(xiàn)今,WIN1 轉(zhuǎn)錄因子在擬南芥、甘藍型油菜等植物中均有所報道,而大豆的WIN1 研究還未深入,因此有必要在大豆中進行更深入的研究。大豆作為重要的油料作物,對其研究可以為提高大豆油脂含量提供理論依據(jù)。
本文根據(jù)擬南芥AtWIN1 序列,在大豆數(shù)據(jù)庫中獲得GmWIN1-6 成員,并對其進行了生物信息學分析。該蛋白由176 個氨基酸組成,屬于親水性蛋白。蛋白二級結構的無規(guī)則卷曲較多,預測其主要用于連接其他二級結構元件。蛋白三級結構與AtERF96 相似性很高。多序列比對分析發(fā)現(xiàn),Gm-WIN1-6 在N 端有一段約63 個氨基酸的保守序列,與其他物種的WIN1 轉(zhuǎn)錄因子相似性很高,中間基序和C端基序與其他物種也很相似。進化樹分析發(fā)現(xiàn)GmWIN1-6 轉(zhuǎn)錄因子與擬南芥AtWIN1 的親緣關系很近。綜上可推測,GmWIN1-6蛋白也具有WIN1的活性。
本研究證實,GmWIN1-6 轉(zhuǎn)錄因子在大豆不同組織中均有表達,在根、莖、葉、莢中表達較低,在花中的表達量最高。已有研究發(fā)現(xiàn),大多數(shù)高等植物均是在花蕾中具有較高的表達[11],推測Gm-WIN1-6 可能與TAG 參與有性生殖相關。TAG 占據(jù)了花粉塊質(zhì)量的30%~40%,但其在花粉中的具體作用還不清楚,可能是為花粉管生長所需膜脂的快速合成提供脂肪酸原料[21]。同時在整個種子發(fā)育階段,尤其是中后期,GmWIN1-6 也具有較高的表達量,與種子油脂積累時期吻合,推測其參與了種子形成過程中油脂的積累。進而本文又對Gm-WIN1-6 轉(zhuǎn)錄因子進行了鹽脅迫研究,發(fā)現(xiàn)在高鹽脅迫下,GmWIN1-6 轉(zhuǎn)錄因子具有響應鹽脅迫的機制,可能激活了植物激素信號通路,進而促進下游功能基因的表達[22-23]。總體而言,GmWIN1-6 轉(zhuǎn)錄因子不僅在蠟質(zhì)、脂質(zhì)合成方面起到關鍵作用,還在脅迫響應機制中起調(diào)控作用。
轉(zhuǎn)錄因子在植物發(fā)育過程中有重要作用。大部分轉(zhuǎn)錄因子都有轉(zhuǎn)錄調(diào)控區(qū)和DNA 結合區(qū),其中轉(zhuǎn)錄調(diào)控區(qū)決定轉(zhuǎn)錄因子對基因的表達起激活作用還是抑制作用。一個轉(zhuǎn)錄因子可以參與調(diào)控多個相關基因,從而達到改變植物性狀的目的[24]。本文主要針對GmWIN1-6 轉(zhuǎn)錄因子進行了分析,對其下游功能基因的研究仍需進一步的試驗驗證。本研究結果為了解油脂積累過程中的機制和抗鹽性以及后期轉(zhuǎn)基因功能分析奠定了基礎。

