HLA-DRB1等位基因和抗HLA-DRB1抗體在尿毒癥患者中的分布特征
郭旭麗,朱 權,王慧鵬,謝 敏,羅奇志*
(1. 河北工程大學醫學院免疫學教研室,邯鄲 056038;2. 中南大學基礎醫學院免疫學教研室,長沙 410008)
人類白細胞抗原(human leukocyte antigen,HLA)分為HLA-I、HLA-II、HLA-III 三個區域,與免疫系統密切相關,其中HLA-II 區域編碼的HLA-DR抗原是與移植排斥有關的最重要的抗原[1-3],是導致移植后發生排斥反應的最主要因素,也是引發同種異基因排斥反應的主要抗原[4]。尿毒癥是終末期腎病的表現形式,腎移植是目前唯一根治尿毒癥的手段[5]。晚期尿毒癥患者進行腎移植前需檢測供受者HLA 的基因型別,通過選擇更多的HLA等位基因匹配的供者來盡可能地降低排斥反應。有些患者由于接觸過同種HLA 抗原(輸血、妊娠、再移植等),體內預先產生了相應的抗HLA 抗體[6],即群體反應性抗體(population reactive antibody,PRA),一旦接觸到相應抗原就會損傷供者的組織器官,因此必須在術前加以檢測,從而避免可能發生的移植排斥反應。
根據移植體液免疫理論,造成器官移植受者對移植物排斥的原因是機體對HLA 抗原存在致敏效應[7]。該效應在移植受者中普遍存在,尤其是在再移植受者中更為多見。研究發現,幾乎所有的等待腎臟再移植的受者體內都存在抗HLA 抗體[8],該類抗體與相應抗原的反應性以及交叉反應現象是幾十年來研究的焦點。HLA 分子上的氨基酸序列在很大程度上有助于了解抗原抗體反應的本質,然而解析抗體與HLA 抗原上的特異表位之間的反應則能夠更準確地描述抗原抗體反應的本質。有些表位是獨有的,僅在一種抗原上出現;有些表位則能出現在多個抗原中[9]。例如:HLA-DQ 分子β 鏈上第56 位氨基酸為亮氨酸(L)時,就可確定為HLADQB1 分子,表明該表位為獨特表位,而表位82LR(第82位與第83位氨基酸分別為亮氨酸與精氨酸)在HLA-A2、B57、B58 等HLA 分子中都有出現,甚至有些表位能同時出現在HLA-A、B、C 分子中。近些年,基于重組HLA 單抗原包被的懸液芯片技術在確定抗HLA 抗體的特異性方面有著很大的作用[10],通過該項技術還能確定表位的分布特征。
供受者間的HLA 絕大部分表位匹配時,即使基因型不匹配,也不會引發過強的排斥反應。但是傳統的HLA 配型未能充分考慮表位匹配的問題,而表位的重要性遠高于當前針對移植受者體內抗體特異性的研究。國際上已有大量有關移植受者表位匹配的報道,如Duquesnoy[11]報道了一項基于HLA表位匹配的器官移植案例;Wiebe 等[12]提出,表位匹配能最大化地降低供者特異性抗體的產生,并提高移植治療的效果;Walton 等[13]研究表明,表位匹配程度與慢性移植肺功能紊亂程度呈負相關。
HLA-DR基因是引發移植排斥反應最重要的位點,同時在對腎移植受者進行HLA 配型時,我們發現HLA-DRB1基因座位與尿毒癥發病及腎移植排斥有一定的關聯。目前學術界對HLA-DRB1基因與尿毒癥及腎移植之間的關系尚未闡明,其影響移植腎存活的機制還未明確。為了在移植前更好地對尿毒癥患者進行HLA 表型檢測,利于其配型,我們對尿毒癥患者的HLA-DRB1基因進行檢測,對因尿毒癥而進行了腎移植的患者進行抗HLA-DRB1抗體的篩查,以期了解HLA-DRB1等位基因的分布特征和腎移植后HLA-DRB1 抗體的分布特征,探索基于表位的新型配型理論。本研究將為深入了解HLA-DRB1基因與尿毒癥的關系奠定基礎,對闡明HLA-DRB1基因在尿毒癥及腎移植中的作用提供試驗依據。
1 材料與方法
1.1 研究材料
連續收集2014 年至2019 年就診于湘雅醫院、湘雅二醫院與湘雅三醫院的358 例因尿毒癥進行腎移植的患者(所有研究對象無其他重大疾病,相互之間無親緣關系)的血樣本,同時收集3 664 例健康志愿者的血標本。所有研究對象均采集3 mL 靜脈血,分離出血清,并從外周血樣本中提取DNA。所有研究對象或家屬均簽署知情同意書。
1.2 HLA-DRB1 的基因分型
用HLA-II 類分型試劑盒(Immucor,Peachtree Corners,GA,美國)對所有患者的HLA-DRB1進行基因分型。從樣品中提取DNA,最終質量濃度為15~20 ng/μL。將2.0 μL DNA 與0.2 μL Taq 酶、11.8 μL ddH2O 和6.0 μL 探針混合物混合至總體積為20 μL。接著,啟動聚合酶鏈反應(polymerase chain reaction,PCR)擴增系統:95℃ 5 min,1 個循環;95℃ 30 s,60℃ 45 s,72℃ 45 s,8 個循環;95℃ 30 s,63℃ 45 s,72℃ 45 s,32 個循環;72℃15 min,1 個循環。使用2.5 μL PCR 產物和7.5 μL探針混合物混合,97℃反應5 min,接著47℃反應30 min,最后56℃反應30 min 進行DNA 雜交。56℃反應5 min 后加入稀釋液和藻紅蛋白-鏈霉親和素混合物(體積比為200∶1),置于Lumiex 儀器中進行檢測。
1.3 抗HLA-DRB1 抗體的檢測
按說明書要求,用單抗原流式細胞術對抗HLADRB1的免疫球蛋白G(immunoglobulin G,IgG)抗體進行檢測。將15 μL 患者血液標本與45 μL 含10%綿羊血清的磷酸鹽緩沖溶液(phosphate buffered solution,PBS)混合,然后添加Luminex檢測磁珠(Lambda,Themo,CA,USA)。陽性對照組為正常血清和磁珠(含10%綿羊血清),陰性對照組為質控血清和磁珠(含10%綿羊血清)。加入磁珠后,充分搖勻混合物,室溫靜置30 min,然后用PBST(含0.05%吐溫20的PBS)洗滌4次,每次均以900g離心2 min,棄去上清液后加入60 μL 藻紅蛋白標記的綿羊抗人IgG 并混合,置于Luminex儀器中讀出平均熒光強度(mean fluorescence intensity,MFI)值。
1.4 穩定表達HLA-DRB1*01/*13/*14細胞株的構建
將人HLA-DRB1*01/*13/*14基因序列全長經過PCR 擴增后分別克隆到pEGFP-N1 載體中,分別獲得載有HLA-DRB1*01/*13/*14基因全長序列的重組質粒。測序驗證后分別轉染至HMy2.C1R細胞中[不表達HLA-A、B,僅表達少量的HLACw4(ATCC,Rockville MD,USA)],在含500 μg/mL G418 的RPMI-1640 完全培養基中培養,成功轉染的細胞呈綠色熒光。再經細胞流式分選培養獲得穩定表達HLA-DRB1*01/*13/*14的細胞株。
1.5 抗體吸附試驗
分別收集穩定表達HLA-DRB1*01/*13/*14 的細胞1.0×107個,并用pH 7.4 的PBS 洗滌3 次。將50 μL 含有與細胞表面HLA-DRB1 抗原對應抗體的血清(MFI >5 000)分別與穩定表達HLA-DRB1 抗原的細胞混合,37℃反應1 h,然后離心收集血清。用Luminex 懸液分析系統對吸收后的血清進行MFI值檢測,并與吸收前進行比較。
1.6 統計方法
計算出研究對象的HLA-DRB1等位基因頻率,并與健康志愿者比較;計算出抗HLA-DRB1 抗體的分布頻率特征,以百分率表示;將各個抗體的MFI值取平均數并進行平均MFI 值的比較。用SPSS 20.0 軟件進行統計學分析,計數資料以百分數表示,基因頻率的比較采用卡方檢驗,以P<0.05 為有顯著差異。
2 結果與分析
2.1 抗HLA-DRB1 抗體頻率在性別之間的比較
在358 名尿毒癥患者中,有35 名患者(10 名男性和25 名女性)具有抗HLA-DRB1 抗體,其余患者(173 例男性和150 例女性)沒有抗HLA-DRB1 抗體。其中女性患者中抗HLA-DRB1抗體的頻率高于男性,Student’st檢驗結果表明差異顯著(P<0.05)。
2.2 尿毒癥患者和健康對照組之間HLA-DRB1等位基因頻率的比較
為了確定HLA-DRB1是否與尿毒癥相關,本研究通過聚合酶鏈反應-序列特異性寡核苷酸(polymerase chain reaction-sequence specific oligonucleotide,PCR-SSO)方法對358 名尿毒癥患者和3 664 名健康對照者的HLA-DRB1基因進行分型,并對基因頻率進行統計。結果顯示,尿毒癥患者組HLA-DRB1*13等位基因的頻率顯著低于健康對照組(4.33% vs. 13.37%,P<0.001),相比之下,尿毒癥患者組HLA-DRB1*14等位基因的頻率顯著高于健康對照組(12.01% vs. 4.12%,P<0.001)。即尿毒癥患者的HLA-DRB1*13等位基因頻率較低,而HLA-DRB1*14等位基因頻率較高;在健康對照者中,HLA-DRB1*13等位基因的頻率高,而HLA-DRB1*14等位基因的頻率低(表1)。這些結果表明:在基因頻率上,HLA-DRB1*13與尿毒癥患病率呈負相關,可能對個體具有保護作用;HLADRB1*14與尿毒癥患病率呈正相關,可能是尿毒癥的易感因素。
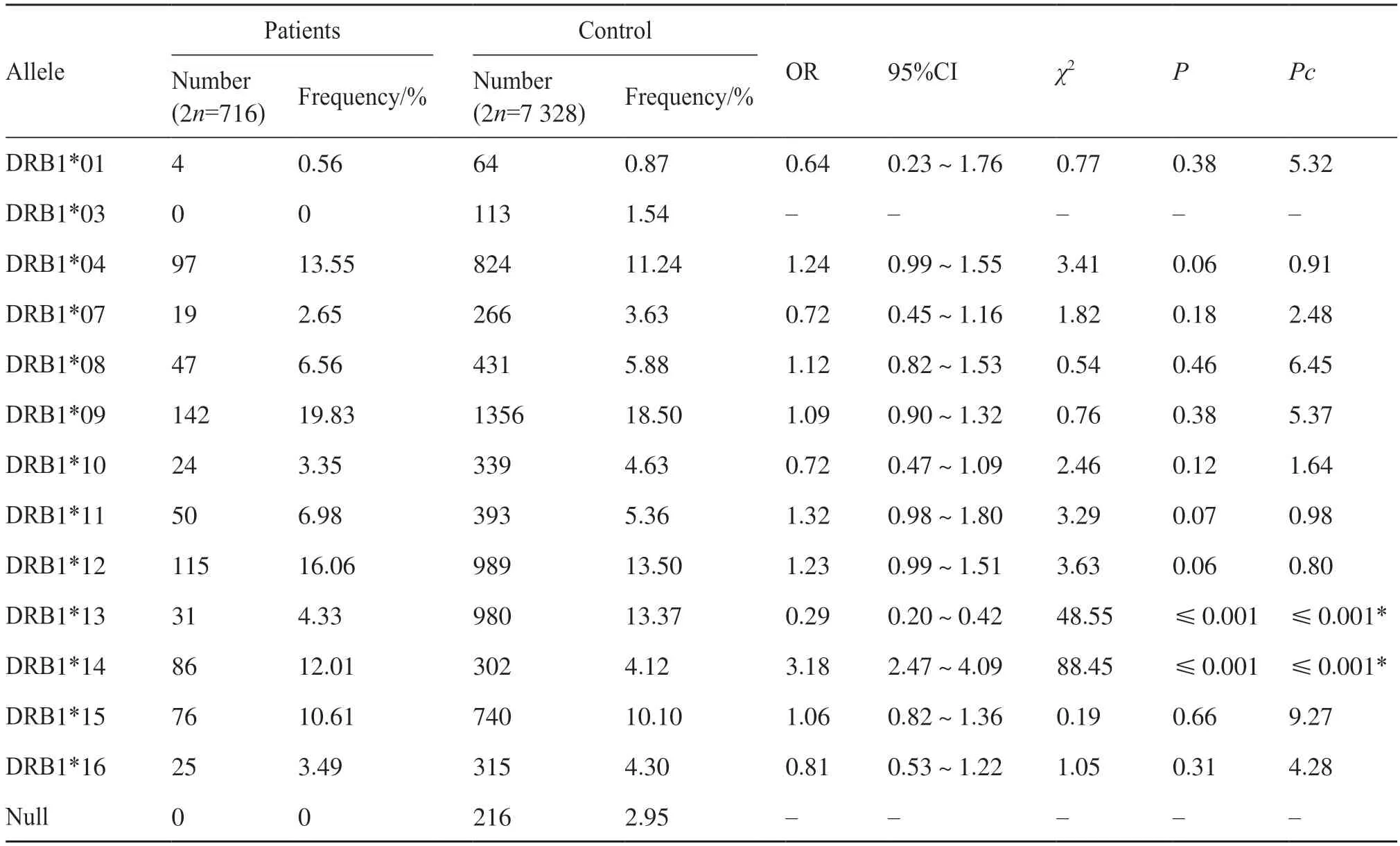
表1 358例尿毒癥和3 664健康對照者HLA-DRB1等位基因的頻率分布Tab. 1 Frequency distribution of HLA-DRB1 alleles in 358 patients with uremia and 3 664 health controls
2.3 HLA-DRB1*13/*14 基因型尿毒癥患者放療后腎臟移植的存活率
為了分析HLA-DRB1*13/*14等位基因對尿毒癥患者生存的影響,我們對攜帶這兩種HLA-DRB1基因的尿毒癥患者進行了生存分析。 由圖1 可知,HLA-DRB1*13基因型患者的生存率顯著高于HLA-DRB1*14基因型患者的生存率,而沒有HLADRB1*13/*14基因型的尿毒癥患者在腎移植后的移植腎的存活率介于HLA-DRB1*13和HLA-DRB1*14基因型的尿毒癥患者的存活率之間。
2.4 腎移植后尿毒癥患者體內抗HLA-DRB1抗體的產生情況

圖1 尿毒癥患者移植后的腎臟的存活率Fig. 1 Survival rate of transplanted kidneys after kidney transplant in uremia patients
本研究對358 位因尿毒癥進行腎移植的患者進行抗HLA-DRB1 類抗體的檢測,其中120 例為抗HLA-DRB1 類抗體陽性。結果統計如表2 所示,抗HLA-DRB1*01/*13/*14 抗體的頻率顯著低于其他一些HLA-DRB1 類抗體(P<0.05),差異具有統計學意義。
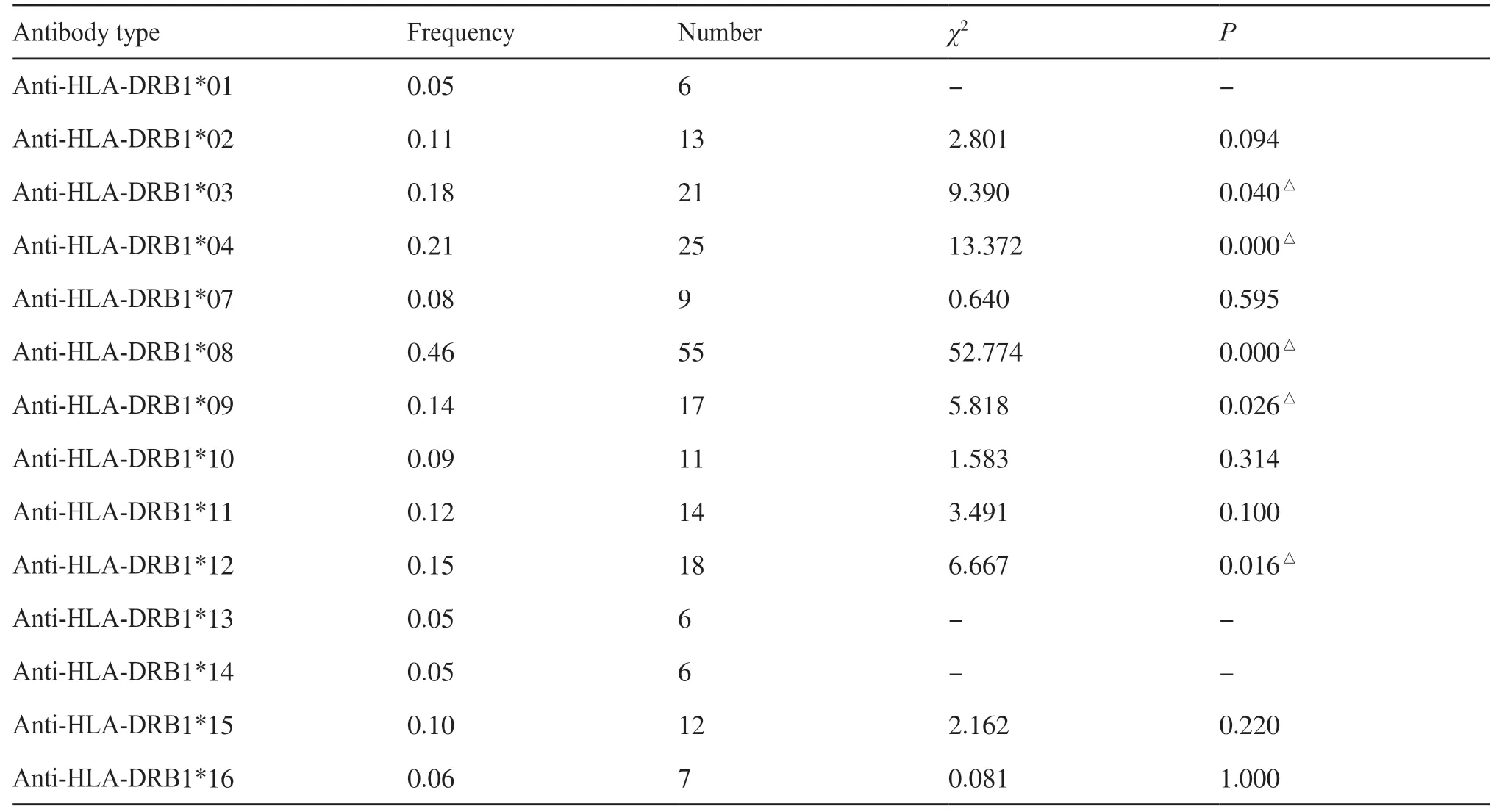
表2 腎移植后尿毒癥患者體內抗HLA-DRB1抗體產生情況Tab. 2 Anti-HLA-DRB1 antibody producing situation in uremic patient after renal transplantation
2.5 HLA-DRB1 抗原的表型分析
為了探究腎移植后尿毒癥患者體內抗HLADRB1*01/*13/*14 抗體的頻率顯著低于其他抗HLA-DRB1 抗體的原因,我們用HLA Matchmaker(www.epitopes.net/)對HLA-DRB1基因序列進行了分析,結果顯示,HLA-DRB1*01/*13/*14等位基因的編碼產物具有共同的表位77T(圖2),而其他HLA-DRB1 抗原沒有,故尿毒癥患者中抗HLA-DRB1*01/*13/*14 抗體的水平顯著低于其他抗HLA-DRB1 抗體可能是由存在的共同表位77T所致。
2.6 驗證HLA-DRB1*01/*13/*14具有共同表位
為了明確HLA-DRB1*01/*13/*14 蛋白具有共同表位,我們利用吸附試驗進行驗證。結果發現,用表達HLA-DRB1*01 的細胞與含有抗HLADRB1*01/*13/*14 抗體的血清共同孵育后,再次對抗HLA-DRB1 抗體進行檢測時,三種抗體的MFI 值顯著降低(P<0.01),差異具有統計學意義。用表達HLA-DRB1*13/*14 的細胞與含有這三種抗HLADRB1 類抗體的血清孵育后也得到與上述HLADRB1*01 抗原試驗相似的結果(圖3),說明HLADRB1*01/*13/*14具有共同表位。
為了進一步了解表位的特征,我們通過免疫多態性數據庫-國際免疫遺傳學數據庫(www.ebi.ac.uk/ipd/imgt/hla/align.html)找到了相應的氨基酸序列(僅100 個氨基酸)。表3 為相應的氨基酸信息。三種HLA-DRB1 抗原的第77 位為蘇氨酸(T),這與HLAMatchmaker的分析結果一致。

表3 HLA-DRB1*01:01、HLA-DRB1*13:01和HLA-DRB1*14:01分子的氨基酸信息Tab. 3 Information of the amino acids of HLA-DRB1*01:01,HLA-DRB1*13:01 and HLA-DRB1*14:01 molecules
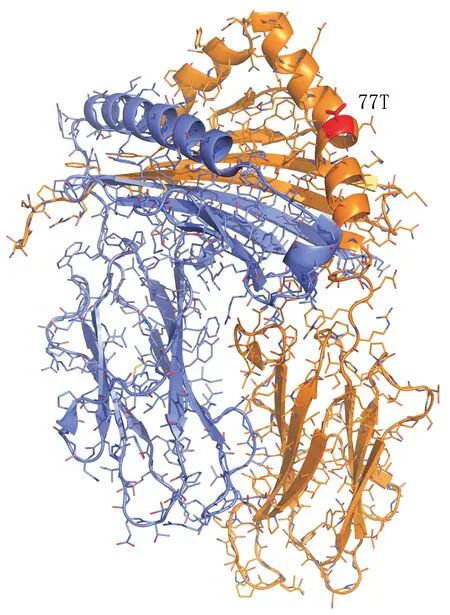
圖2 HLA-DRB1*01/*13/*14分子共同表位77T的結構圖Fig. 2 The structure of common epitope 77T in HLA-DRB1*01/*13/*14 molecules
3 討論
腎移植是治療終末期腎病的最有效方法,通過替換失去功能的腎能達到根治效果。然而移植排斥反應的存在限制了治療的效果。HLA 不匹配是造成移植排斥的主要因素,而表位不匹配則是HLA不匹配的主要原因。我們發現,HLA-DRB1*14與尿毒癥患病率呈正相關,并且它可能是尿毒癥的易感因素。尿毒癥患者中抗HLA-DRB1*13/ *14 抗體的頻率顯著低于其他抗HLA-DRB1 抗體,推測其根本原因是:1)HLA-DRB1*13是保護性基因,即使錯配也難以誘導抗體;2)HLA-DRB1*14在健康人群中的頻率較低,在尿毒癥患者中的頻率較高,因而不能輕易產生相應的抗體。
為了進一步研究HLA-DRB1*13/ *14 的特征,我們用HLA Matchmaker 數據庫搜索每個等位基因攜帶的表位,在比較后篩選出通用表位77T。有研究顯示,HLA-DRB1*01/*13/*14 蛋白存在第77 位的蘇氨酸(T)的表位,這與我們的試驗結果相符合[14]。
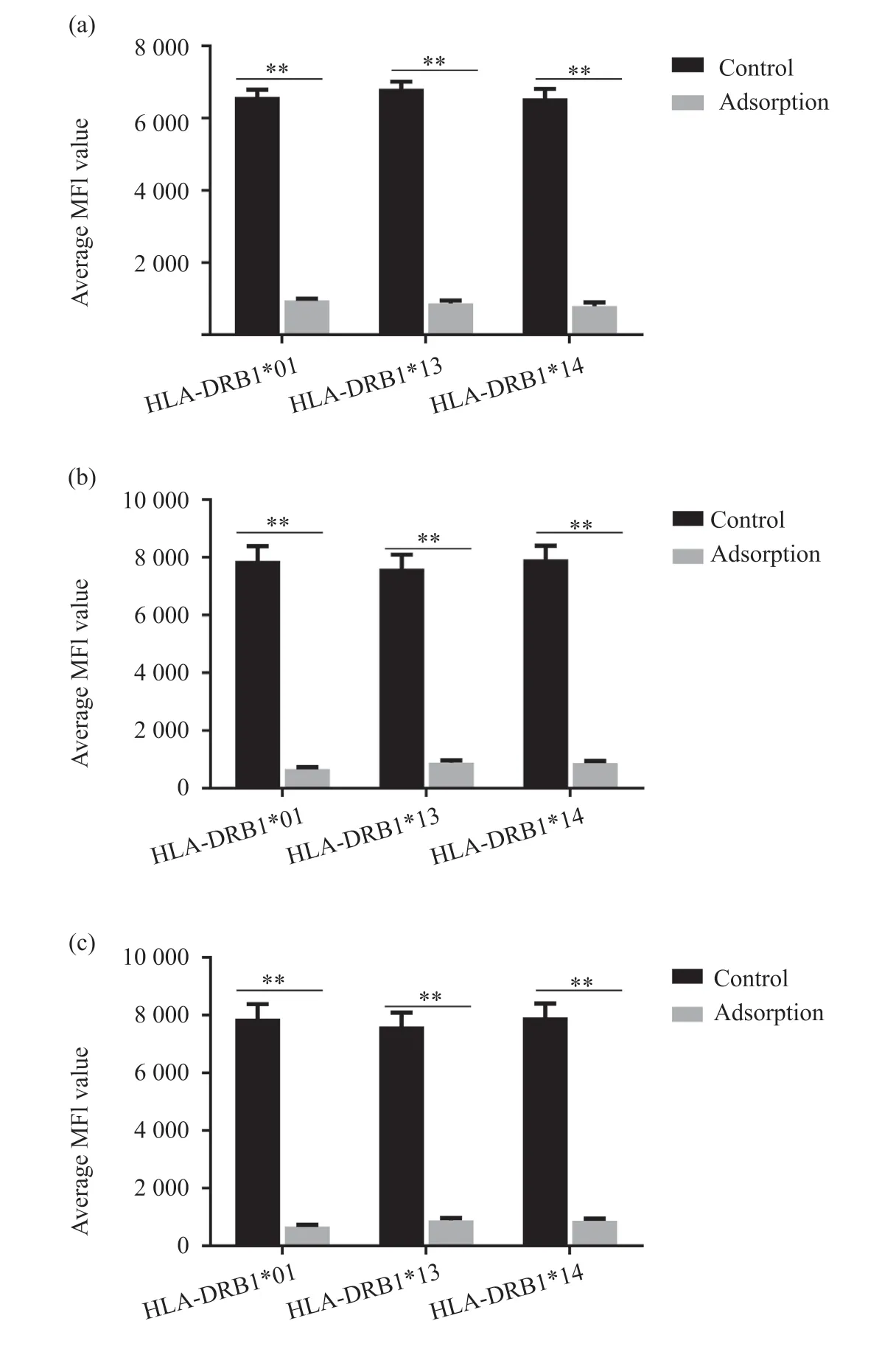
圖3 穩定表達HLA-DRB1的細胞對抗體的吸附Fig. 3 Adsorption of antibodies by cells stably expressing HLA-DRB1
長期的臨床研究表明,HLA 的匹配程度與腎移植的效果密切相關[15-17]。從理論上講,完全匹配可以確保幾乎沒有移植排斥的風險。Terasaki 等[18]發現,與HLA-A、B 和DR 這6 個等位基因都錯配的腎移植受者的10 年生存率比這6 個位點完全匹配的受者降低了30%,半衰期縮短了大約12 年。但也有與之相反的結果,如HLA-DR17 位點為純合子時更能誘發移植排斥反應,而錯配或雜合子卻不容易引起移植排斥反應[19]。因此當腎移植受者帶有HLADR17等位基因時,應選擇不含該位點的供者,從而降低排斥反應發生的可能性。這與我們發現的HLA-DRB1*13有類似之處,即尿毒癥患者進行腎移植時,雖然HLA-DRB1*13的錯配可能性大,但卻不易產生抗HLA-DRB1*13 的抗體。同時回顧性研究中發現,某些存在多個HLA 抗原錯配的移植亦能取得較好的效果[20-21]。這些現象提示我們,傳統的基于HLA等位基因分型的方法在預測移植排斥中的能力明顯低于基于表位的分型方法,表位匹配比傳統的等位基因匹配更能預防排斥反應的發生。
供受者之間HLA 匹配程度是腎移植后影響移植物存活的重要因素,隨著HLA-I/II 類抗原錯配程度的增高,發生急性排斥反應以及移植物失功的風險也在上升。即使在廣泛使用免疫抑制劑的時代,HLA 匹配仍然是全世界范圍內選擇供腎的主要標準。對HLA-A、B、DR 位點的血清學分型是常用的判斷移植抗原錯配的方法,同時也是評估預測潛在的具有免疫兼容性的供受者的標準。我們用HLA Matchmaker 軟件篩選了可能的表位,并通過數據庫查詢了其氨基酸序列,證實了HLADRB1*01/*13/*14這幾種抗原中含有同一種表位。
腎移植是挽救終末期腎臟病患者的最佳手段。有效控制移植排斥反應,延長移植腎存活時間是腎移植中亟待解決的問題。本研究提供的數據可能支持進一步研究和開發有關移植腎排斥反應的新理論,也為以后闡明HLA-DRB1*13/*14 如何對個體具有保護或易感效應及其機制提供了參考。

