非小細胞肺癌治療致心功能不全1例報告
梁 琳, 翟 玫, 張宇輝
中國醫學科學院北京協和醫學院,國家心血管病中心,阜外醫院心力衰竭中心,北京 100037
近年來,現代醫學迅速發展,放化療、靶向治療、免疫治療等多種對抗腫瘤的手段使腫瘤患者的生存期明顯延長,腫瘤患者人群年齡逐漸升高,但相關心血管毒性和心血管并發癥嚴重干擾了腫瘤的治療,降低了患者的生活質量[1-2]。然而,目前關于腫瘤治療患者的心臟監測和預警評價體系仍不完善,臨床醫師對其認識仍不足。現將1例經歷多線化療、靶向治療及免疫治療后發生心臟相關不良反應的非小細胞肺癌(non-small cell lung cancer,NSCLC)患者診治情況報告如下,以期為腫瘤患者心臟監測和評估提供參考。
1 病例資料
1.1 既往資料 患者男性,60歲,身高178 cm,體質量90 kg,因“間斷胸痛12年、發現右肺腺癌4年、胸悶憋氣1月余”于2020年12月29日入本院治療。患者既往高血壓史10年余,入院時使用美托洛爾緩釋片降壓治療,未監測血壓。無糖尿病病史。12年前患者勞累后出現胸痛,于當地醫院行冠脈造影,冠狀動脈左前降支(LAD)植入支架2枚、左旋回支(LCX)植入支架1枚(具體不詳)。術后規律服用阿司匹林腸溶片100 mg qd、硫酸氯吡格雷片75 mg qd、阿托伐他汀鈣片20 mg qn,無特殊不適。4年前患者勞累后再發胸痛,再次行冠脈造影檢查,顯示原支架通暢,右冠狀動脈(RCA)狹窄90%,于RCA植入支架1枚(具體不詳)。患者4年前診斷為右肺腺癌(pT1bN2M0,ⅢA期),于2016年12月開始接受多西他賽聯合卡鉑化療4個周期。2018年11月復查PET-CT,示雙肺、右鎖骨上、縱膈、右肺門淋巴結多發轉移;術后病理組織基因檢測示EGFR21、L858R突變,ERBB2拷貝數增加。遂于2018年11月至2020年7月口服阿法替尼。2020年7月復查CT,示雙肺轉移瘤較前增大,患者自行口服奧西替尼1個月后,CT示病灶仍有進展。2020年8月行支氣管鏡取組織,經病理診斷為腺癌。組織及外周血基因檢測示EGFR21、L858R突變,ERBB2基因擴增,GNAS基因擴增,程序性死亡配體-1(programmed cell death ligang 1, PD-L1)表達陽性。2020年9月起,予培美曲塞、卡鉑聯合貝伐單抗治療2周期,10月復查CT,示雙肺轉移瘤較前增大。10月13日予特瑞普利單抗(240 mg,靜脈滴注,第1日)治療1周期。10月26日、11月29日分別予白蛋白紫杉醇、安羅替尼聯合特瑞普利單抗(240 mg,靜脈滴注,第1日)治療。
1.2 入院資料 2020年12月初,患者訴胸骨后及心前區不適,伴胸悶、憋氣,舌下含服硝酸甘油后稍有好轉。12月17日外院心電圖示竇性心律、室內傳導阻滯;心臟彩超示左心擴大,左心收縮功能減低(LVEF 35%),左心舒張功能減低,升主動脈增寬。對比2019年9月19日超聲心動圖[左房擴大,左室壁厚度高值,左室順應性減低,左心功能正常(LVEF為62%)],提示患者左室射血功能明顯下降,遂暫停抗腫瘤治療。2020年12月29日患者入住我院,生命體征平穩,雙肺呼吸音清、未聞及干濕性啰音,心律齊,各瓣膜聽診區未聞及病理性雜音,雙下肢無水腫。
1.3 實驗室檢查 心臟標志物:肌鈣蛋白I(cTnI)0.005 ng/mL,肌紅蛋白(myoglobin,MYO)12.1 ng/mL,肌酸激酶同工酶(CK-MB)1.51 ng/mL,腦鈉肽(brain natriuretic peptide,BNP)30.6 pg/mL,氨基末端BNP前體(NT-proBNP)246 pg/mL,D-二聚體 0.53 mg/L,C-反應蛋白(C-reactive protein,CRP) 5.24 mg/L,紅細胞沉降率(erythrocyte sedimentation rate, ESR)18 mm/h。肝功能、腎功能、凝血功能、甲狀腺功能均未見明顯異常。
1.4 心電圖及影像檢查 心電圖結果(圖1A)示竇性心律,偶發室性早搏。心臟超聲心動圖(圖1B)示左心擴大,室間隔增厚(室間隔厚度11 mm、左室后壁厚度11 mm),左室壁運動異常,左心功能減低(雙平面Simpson法估測LVEF約41%)。24 h動態血壓:夜間平均血壓增高(夜間平均121/85 mmHg、白天平均118/82 mmHg、全天平均119/83 mmHg,1 mmHg=0.133 kpa)、晝夜節律消失、清晨血壓明顯增高。24 h動態心電圖:竇性心律,頻發室性早搏,短陣室性心動過速,ST-T改變。冠脈CT:冠脈支架植入術后,LAD近段至第二對角支支架近端存在有意義狹窄;LCX支架近端未見狹窄,支架遠端存在中-重度狹窄;RCA支架近端未見狹窄,中段局部管腔狹窄50%~70%(有偽影)。靜息心肌灌注顯像(SPECT)及心肌代謝顯像(PET)示:心尖部部分心肌梗死,部分心肌存活,以前間隔心肌存活為主,梗死心肌約占左心室的5%,冬眠心肌共占左心室的6%;其余心肌節段(占左心室的89%)血流灌注/代謝正常;左室心腔增大,間隔無運動至反向運動,廣泛心尖部、前壁及下壁運動減弱,LVEF為34%。
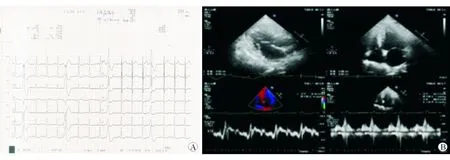
圖1 本病例2020年12月31日心電圖(A)和超聲心動圖(B)
1.5 心肌活檢 2021年1月5日行右室心內膜下心肌活檢,結果示心肌細胞輕度肥大,間質纖維組織增生明顯,未見炎細胞浸潤及心肌細胞壞死;病理診斷為心肌細胞非特異性改變,未見化療后心肌炎改變。
1.6 診療經過及預后 患者入院后予阿司匹林腸溶片、阿托伐他汀鈣片、硝酸異山梨酯片、富馬酸比索洛爾片、鹽酸伊伐布雷定片、沙庫巴曲纈沙坦片、托拉塞米片、螺內酯片治療,患者胸悶、憋氣較前好轉,2021年1月3日復查心臟標志物:cTnI 0.001 ng/mL,MYO 23.3 ng/mL,CK-MB 0.622 ng/mL,NT-proBNP 59.8 pg/mL,超聲心動圖較前無明顯變化。1月6日心肌活檢病理回報未見心肌炎改變,遂繼續入院時治療方案,并根據出入量調整利尿劑劑量。患者經治療后無胸悶、憋氣等癥狀,1月27日復查示心臟標志物正常,超聲心動圖示左心擴大、室間隔增厚、左室收縮功能正常低值(LVEF為50%)。患者出院。
患者出院后隨訪,勞累時偶有胸痛,無胸悶、憋氣,舌下含服硝酸甘油后1~2 min好轉。出院后繼續于中國醫學科學院腫瘤醫院使用白蛋白紫杉醇聯合安羅替尼治療3周期,未再繼續使用特瑞普利單抗。
2 討 論
肺癌是腫瘤相關死亡的主要原因之一,且80%~85%肺癌病例為NSCLC[3]。近10年來,免疫治療成為NSCLC治療的一個里程碑,針對PD-1及PD-L1的單克隆抗體顯著改善了NSCLC患者的預后[4]。目前常用的PD-1抑制劑有帕博利珠單抗(pembrolizumab)、特瑞普利單抗(toripalimab)等。然而,免疫檢查點抑制劑(immune checkpoint inhibitors, ICIs)為患者帶來顯著生存獲益的同時,ICIs免疫相關不良事件(immune-related adverse events,irAS)的報道也越來越多[5]。ICIs相關心臟不良事件(cardiac adverse events,CAE)常出現在注射ICIs后早期或中期(<90 d),主要表現為急性和暴發性心肌炎,確診心肌炎的患者死亡率為27%~46%[6-7],而接受ICIs聯合治療的患者心肌炎發病率和死亡率升高近2倍[6,8-9]。
2.1 ICIs相關CAE鑒別診斷 本病例雖然在使用特瑞普利單抗60 d后出現心電圖改變及LVEF下降,但患者既往有心臟病史,且接受多種化療及靶向藥物治療,需進行鑒別診斷。(1)急性冠脈綜合征(acute coronary syndrome,ACS):患者臨床表現、心電圖與ACS相似,但心臟損傷標志物未升高,故考慮ACS可能性較小。本例患者既往有冠心病病史,支架植入術后,近期冠脈CT仍然提示:LAD近段至第二對角支支架近端存在有意義狹窄;LCX支架遠端存在中-重度狹窄;RCA中段局部管腔狹窄50%~70%(有偽影)。SPECT及PET:心尖部部分心肌梗死,部分心肌存活,前間隔心肌存活為主。患者出現心功能不全加重,難以明確是心臟病本身的進展,還是抗腫瘤治療的不良反應。(2)ICIs相關心肌炎:患者使用特瑞普利單抗后可出現胸悶、憋氣等不適,伴心電圖改變。但本例患者使用ICIs前未行超聲心動圖評估,尤其是使用特瑞普利單抗前無超聲報告,使得析因分析困難。根據《免疫檢查點抑制劑相關心肌炎監測與管理中國專家共識(2020版)》,約90%的ICIs相關心肌炎患者出現肌鈣蛋白(cTn)水平升高,伴臨床癥狀患者常有明顯升高,約70%的心肌炎患者出現BNP或NT-proBNP升高[10]。本病例心臟生物標志物未見升高,且心肌活檢病理未見炎細胞浸潤及心肌細胞壞死,故可排除該診斷。(3)其他導致心力衰竭的藥物或毒素所致心臟毒性:本例患者有紫杉醇、鉑類(卡鉑)、血管內皮生長因子抑制劑(vascular endothelial growth factor inhibitors,VEGFI;貝伐單抗)、酪氨酸激酶抑制劑(阿法替尼、奧西替尼、安羅替尼)用藥史,這些藥物均可致心肌缺血、左室功能障礙[11]。考慮多種抗腫瘤藥物所致心功能不全可能性大。
2.2 心功能不全風險評估 本病例使用多種抗腫瘤藥物,且有高血壓等心血管疾病高危因素,但治療前及治療過程中并沒有進行心血管風險因素評估和心臟監測,致使沒有早期識別心臟毒性、給予心臟保護策略。根據歐洲腫瘤內科學會2020年腫瘤患者心臟病管理共識(ESMO-2020)[12]、美國臨床腫瘤學會兒童腫瘤幸存者心血管疾病管理專家意見(ASCO-2017)[13]、歐洲心臟病學會腫瘤治療和心血管毒性實踐指南(ESC-2016)[14],建議對該類患者開始抗腫瘤治療前進行全面的心血管風險因素評估,識別并監測有可能發生心血管毒性的高危患者。2020年歐洲心臟病學會心衰協會心臟腫瘤研究組與國際心臟腫瘤學會共同提出基線心血管風險分層表[15],用于與心血管疾病顯著風險相關的抗腫瘤治療:若心血管風險評價為中/低風險,可以開始/繼續腫瘤治療;若評價為高風險/極高風險,應慎重考慮開始/繼續腫瘤治療,或考慮換用心臟毒性較小的治療方案。接受有潛在心臟毒性的抗腫瘤治療前,必須對風險因素控制進行嚴格的優化,也可考慮使用預防性心臟保護藥物。本病例基線心血管風險評價為高風險,應由腫瘤科醫師和心臟科醫師共同評估病情,可考慮使用心血管毒性較小的抗腫瘤治療方案,并在開始治療前及治療過程中嚴格管理血壓、血脂等高危因素,也可嘗試使用β-受體阻滯劑、血管緊張素轉換酶抑制劑等預防性心臟保護藥物。
2.3 心功能不全發生率及監測指標 另外,目前對腫瘤治療過程中心臟監測頻率仍沒有定論。ESMO-2020推薦[12],對于LVEF正常的無癥狀患者,每3~6周或每個治療周期前監測cTn、BNP或NT-proBNP。ASCO-2017建議[13]對于有心衰癥狀的腫瘤患者,還應進行包含整體縱向應變(GLS)的心臟超聲及磁共振監測,監測頻率由腫瘤科和心臟科醫師共同決定。根據ESMO-2020[12],抗腫瘤治療相關心功能不全定義為“LVEF降低≥20%或LVEF降低≥10%至絕對值<50%或LVEF絕對值降低為50%以下”,并建議根據患者心衰癥狀及體征、心衰分類和腫瘤治療情況,依據心衰指南進行管理。抗腫瘤治療相關心功能不全發病率方面,對10 647例惡性腫瘤患者應用VEGFIs(包括阿昔替尼、帕佐帕尼、索拉非尼、舒尼替尼和萬達尼布)治療的薈萃分析[16]顯示,無癥狀左室收縮功能不全(left ventricular systolic dysfunction, LVSD)的發生率為2.4%,其中1.2%發展為癥狀性心力衰竭(heart failure,HF)。然而,在納入薈萃分析的21個試驗中,只有5個有基線和隨訪過程中的心臟檢查。在有心臟監測要求的試驗中,LVSD和HF的發生率明顯高于沒有心臟監測要求的試驗,并且幾乎所有的試驗都排除了有心血管病史的患者,這提示LVSD的發生率可能被低估。故臨床工作者應提高警惕,在治療腫瘤過程中,不應忽略潛在心血管風險。
為了早期識別腫瘤治療相關心臟毒性,各指南均建議[12-14]使用cTn和GLS作為監測指標:如果cTn水平相較于基線升高并超過實驗室的參考值上限(相同類型cTn及相同測量方法),則可視為心肌毒性的早期跡象;關于GLS截斷值,ESMO-2020指南[12]使用的定義“絕對GLS下降≥5%或相對下降≥12%”最敏感。另外,心臟磁共振、心肌灌注顯像也可用于監測腫瘤治療相關心肌損傷。一些專家還提出[17],對腫瘤患者的心臟管理框架應擴展到心血管疾病危險因素的“ABCDE”管理,即風險評估、抗血小板/抗凝治療、血壓、膽固醇、戒煙、飲食和體質量管理、糖尿病預防和治療以及鍛煉等,以降低患者心血管事件和冠心病死亡風險,改善患者遠期預后并提高生活質量。
綜上所述,心血管監測和腫瘤治療相關心血管毒性的管理是對腫瘤患者治療過程中應考慮的重要問題。隨著新的抗腫瘤藥物的應用,更需關注心血管不良事件,早期識別、制訂相應的預防和治療方案,防止其發展成為嚴重不良反應。

