腹腔鏡胃癌根治術患者圍手術期營養支持治療情況
潘 艷, 廖慶武, 蓋曉冬, 葛圣金
復旦大學附屬中山醫院麻醉科,上海 200032
近年來,營養支持已成為臨床治療的一部分。其中,腫瘤患者的營養管理已成為腫瘤多學科綜合治療的重要組成部分。臨床醫師已經意識到營養狀況和圍手術期營養支持治療對患者臨床結局的重要性,但營養支持治療在臨床工作中的具體實施情況仍不樂觀。研究[1-2]顯示,美國只有1/5的醫療機構具有正規的營養篩查程序,而胃腸道腫瘤外科手術患者營養風險達70%,術前和術后接受營養支持治療者僅分別占21%和22%。我國近年來營養支持理念、技術及制劑等均取得了巨大進步,但具體實施仍欠規范[3-5]。本研究通過回顧性分析微創外科胃癌患者圍手術期營養支持治療情況,為圍手術期營養支持治療的合理實施提供參考。
1 資料與方法
1.1 一般資料 選擇2017年1月1日至2019年12月31日于我院行限期腹腔鏡輔助胃癌根治術的患者為研究對象,對其臨床資料進行回顧性分析。入選標準:(1)術后病理證實為胃惡性腫瘤;(2)年齡18~90歲;(3)接受腹腔鏡輔助胃癌根治術。排除標準:(1)殘胃癌;(2)合并其他惡性腫瘤或術中證實伴有遠處轉移者;(3)出血、梗阻、穿孔等急診手術患者;(4)病歷資料不完整者。收集患者性別、年齡、身高、體質量等一般資料,分析營養支持情況。
1.2 營養風險篩查和營養不良判斷標準 采用營養風險篩查工具2002 (nutritional risk screening 2002,NRS2002)進行營養風險篩查。NRS2002量表包括營養狀態受損評分、疾病嚴重程度評分和年齡評分3部分,最終得分為3項的總和,最高7分,其中評分≥3分者提示存在營養風險,評分<3分者則提示暫時無營養風險。營養不良定義:體質量指數(body mass index,BMI)<18.5 kg/m2,伴一般狀況差。
1.3 觀察指標及方法 查閱手術室排班系統、病歷及醫囑系統等,收集腹腔鏡胃癌根治術患者圍手術期營養支持治療相關資料,包括術前及術后營養支持治療率、途徑、開始時間、治療時間以及營養液種類等。
營養支持包括腸外營養(parenteral nutrition, PN)與腸內營養(enteral nutrition, EN)。PN定義為經胃腸外途徑給予糖、脂肪和氨基酸;EN定義為經鼻胃管給予EN制劑或經口補充營養(oral nutritional supplements,ONS)。能量計算:一般按照商品制劑的能量標識計算;未標識的制劑則按1 g葡萄糖產生3.4 kal熱量、1 g蛋白質產生4 kal熱量、1g脂肪產生9 kal熱量來計算。

2 結 果
2.1 患者總體情況 排除腹腔鏡手術中轉開腹、術中聯合其他臟器切除(膽囊除外)、術后病理證實為良性腫瘤等不符合入組條件的患者,共納入410例。其中,男性235例(57.32%)、女性175例(42.68%),年齡21~87歲,平均(58.27±11.79)歲,平均BMI (22.40±2.83) kg/m2(15.43~32.60 kg/m2)。
2.2 營養風險及營養不良情況 410例患者中,NRS評分≥3分者179例,營養風險發生率為43.66%;術前存在營養不良患者33例(8.05%)。以年齡和BMI分層的營養風險評分見表1。

表1 以BMI和年齡分層的營養風險評分 n(%)
2.3 營養支持治療情況 術前使用營養支持治療者為13例(3.17%),其中有營養風險組7例(3.91%),無營養風險組6例(2.60%);術后使用者為265例(64.63%);術前和術后均接受營養支持治療者11例(2.68%)。術后有營養風險組中有121例接受營養支持(67.60%);無營養風險組中有144例接受營養支持(62.34%)。術前采用PN者中,僅1例輸注AIO者經中心靜脈,余均經外周靜脈,采用EN者均為ONS;術后采用PN者均經中心靜脈,采用EN者中有2例經鼻飼管,余均為ONS。
術前PN中采用AIO者1例(14.29%),采用單瓶氨基酸者6例(85.71%);術后采用AIO者22例(9.40%),采用單瓶氨基酸212例(90.60%,表2)。采用EN支持者中僅有2例接受腸內營養混懸液(500 mL,500 kcal,每日1次)鼻飼,分別治療13、10 d。僅AIO營養液中添加免疫營養素,包含ω-魚油脂肪乳和谷氨酰胺。

表2 圍手術期營養支持治療情況
2.4 腸外營養液能量及氮量 AIO中營養素的能量高于單瓶氨基酸,提供的氮量低于單瓶氨基酸,差異均有統計學意義(P<0.001);兩種營養液熱氮比差異無統計學意義;術后AIO支持開始時間晚于單瓶氨基酸(P<0.001)。

表3 術后腸外營養液配方基本情況
2.5 各年份術后營養支持治療情況 2017年、2018年及2019年行腹腔鏡胃癌根治術患者分別為126、125、159例,術后營養支持率逐年升高(P<0.001,表4)。

表4 各年份術后營養支持治療情況 n(%)
2.6 術后并發癥及住院時間 存在營養風險的患者中,接受營養支持治療者術后并發癥發生率低于未接受者(P<0.01)、住院時間長于未接受者(P<0.01,表5)。
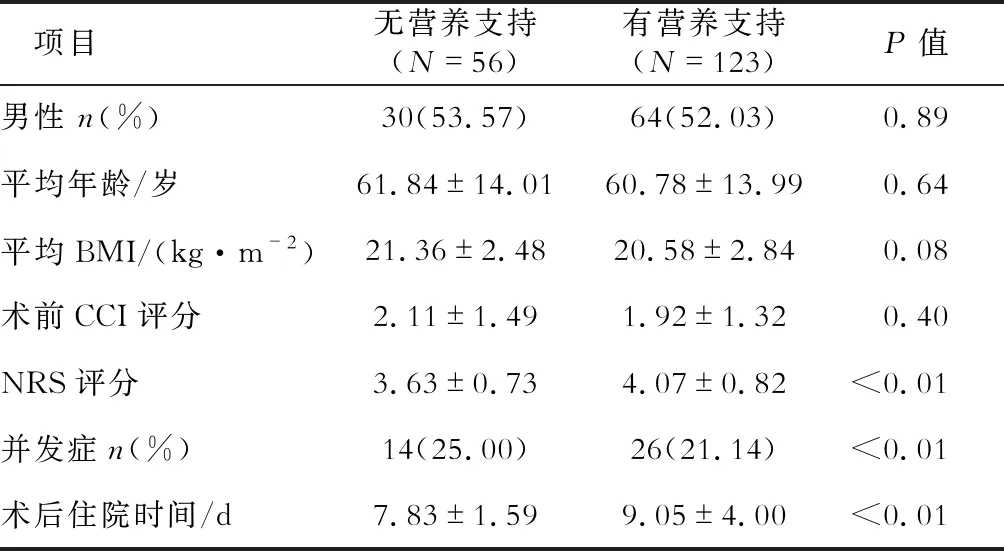
表5 NRS≥3分者一般資料及術后情況 n(%)
3 討 論
胃癌患者的預后不僅與手術操作及腫瘤行為有關,與患者的免疫及營養狀況也有重要關系,其中圍手術期營養不良是增加患者術后并發癥和死亡的獨立危險因素[6-7]。本研究發現,臨床醫師對腹腔鏡胃癌根治術圍術期營養支持治療越來越重視,術后營養支持治療率從2017年的50.00%升至2019年的79.25%(P<0.001)。目前,國際上對于營養不良的定義尚未統一。本研究使用NRS 2002進行營養風險篩查,結果顯示,患者術前營養風險發生率為43.66%,與既往文獻[8-11]報道類似;而營養不良的發生率為8.05%,說明目前胃癌患者術前營養狀況依然嚴重,且老年人和低BMI者更容易發生營養風險。本研究還發現,臨床醫生多根據患者一般情況、實驗室檢查指標及臨床經驗等判斷患者營養狀況,進而給予相應的營養支持治療,全程無營養師參與。本研究中,術前營養支持治療率較低,僅有3.17%,這可能與術前患者選擇有一定關系。
胃癌患者的營養狀況決定患者能否接受手術治療,而手術帶來的創傷、應激等也增加了營養不良的發生甚至使其惡化。各國指南均鼓勵術后早期經口進食,對于ONS無法提供目標需要量或無法經口進食的患者,首先推薦經管飼進行EN支持,其臨床獲益已被多項研究[12-13]證實。EN提供的能量和蛋白質低于患者目標需要量的60%時,則由PN來補足,即補充性PN(SPN)。然而,目前對于術后SPN的給予時機尚未達成共識。而胃癌根治術由于創傷較大、手術操作對解剖結構及胃腸功能影響嚴重等,加之早期EN的使用依然存在爭議[14-15],EN及SPN的應用依然不理想。本研究中,患者術后禁食時間為(4.73±2.78) d,EN支持開始時間為(7.07±3.16)d;SPN的使用率為46.83%,支持天數為(1.92±1.19)d,使用時機為恢復流質飲食后。由此看出,臨床實際情況更加復雜多樣,早期經口進食和EN的實施均具有一定難度。
PN中補充的蛋白質(氨基酸)發揮作用的前提是提供足夠的能量,即給予足夠的非蛋白熱量(non-protein calorie,NPC),否則,補充的氨基酸會被用來產能而不能發揮糾正負氮平衡、修復損傷的作用。術后患者多存在炎癥反應、胰島素抵抗等,機體對葡萄糖的攝取和利用能力受損,脂肪成為患者重要的供能物質[16-18]。因此,雖然腫瘤患者能量底物中碳水化合物與脂肪的最佳比例尚不確定,但PN支持仍推薦AIO,不推薦單瓶氨基酸。當能量和蛋白質均達到目標需要量時,患者死亡風險才能明顯降低[19-20]。本研究中,PN支持方式以單瓶氨基酸靜脈滴注為主,AIO僅占9.40%;術后AIO開始時間晚于單瓶氨基酸(P<0.001)。深入分析發現,患者多在發生術后并發癥后接受AIO。AIO中營養素提供的能量及熱氮比更符合指南推薦,但氮量低于指南推薦;單瓶氨基酸所提供能量為(8.63±2.29)kcal·kg-1·d-1,遠低于AIO,差異具有統計學意義(P<0.05);氮量和熱氮比平均值較接近指南推薦,提供的氮量高于AIO,且有統計學差異(P<0.05)。該結果說明,臨床醫師已認識到足量蛋白質供給的重要性,但是營養素配比的科學性仍有待改善。
美國腸外腸內營養學會腫瘤指南、歐洲腸外腸內營養學會指南和加速康復外科(ERAS)指南均建議對腫瘤患者圍手術期使用免疫增強型營養制劑,并建議術前給予,以改善機體免疫抑制狀態、減少術后并發癥、縮短住院時間[21-22]。指南推薦使用的免疫營養素有谷氨酰胺、精氨酸、ω-多不飽和脂肪酸等。本研究中僅AIO營養液中添加丙氨酰谷氨酰胺和ω-魚油脂肪乳注射液,說明臨床醫生已知曉免疫營養理念,但具體實施還未全面展開。
本研究對有營養風險患者營養支持治療情況分析發現,接受營養支持治療者術后并發癥發生率更低、住院時間明顯延長。兩組患者術前年齡、BMI、合并癥指數(CCI)評分雖無差異,但接受營養支持治療者NRS評分高于無營養支持治療組者(P<0.01),說明接受營養支持治療的患者可能術前營養狀況更差,雖給予營養支持治療,術后住院時間仍明顯延長。然而,對于此結果,還需更多高質量的前瞻性臨床研究來驗證。
綜上所述,微創外科的發展和ERAS的不斷完善為患者帶來諸多益處,同時也對各指南、共識提出新的挑戰。其中,圍手術期規范的營養風險篩查和營養評估還需引起臨床醫師的重視。目前臨床醫師對營養支持治療的認識雖有所提高,但規范性還需進一步提升。

