化痰祛瘀方在肝豆狀核變性模型小鼠海馬神經細胞增殖中的作用及相關機制研究
房如意,謝道俊
(1.安徽中醫(yī)藥大學,安徽 合肥 230038;2.安徽中醫(yī)藥大學第一附屬醫(yī)院,安徽 合肥 230031)
細胞信號通路在機體內的作用顯著,正常細胞的增殖、分化等進程均受細胞信號通路的調控[1-2]。然而,信號轉導通路的異常可能誘發(fā)機體發(fā)生一系列變化。PI3K-AKT-mTOR信號通路已被證實與人類疾病的發(fā)展關系密切[3],PI3K、AKT和mTOR是該通路的關鍵信號靶點,與組織細胞的增殖、凋亡、侵襲和轉移等能力密切相關[4-6]。Wilson病又稱威爾遜病,是先天性銅代謝障礙性疾病[7]。
近年來,中藥方和天然動植物提取物已被證實在抵抗細胞增殖、凋亡、抑制促癌基因表達、誘導抑癌基因表達等方面發(fā)揮重要作用[8-9];同時,其具備易獲得、效果優(yōu)良等優(yōu)點,在延長患者生存期和減少復發(fā)轉移上作用顯著[10]。本研究基于前人研究成果[11],進一步探討化痰祛瘀方在Wilson病模型小鼠海馬神經細胞增殖中的作用及PI3K-AKT-mTOR信號通路相關機制。
1 資料與方法
1.1 實驗試劑、儀器及藥物 胎牛血清、0.25%胰蛋白酶和DMEM培養(yǎng)基(Hyclone公司,中國);RIPA裂解液(Beyotime,中國);二甲基亞砜(Beyotime,中國);聚偏氟乙烯膜和脫脂奶粉(PVDF;Millpore,USA);甲醇(富宇精細化工,中國);電泳試劑盒(Sigma,USA);Western blot一抗和二抗(Boster,中國);微量移液槍(Eppendorf,Research?plus);細胞培養(yǎng)板(Corning,USA);二氧化碳恒溫飽和濕度培養(yǎng)箱(Sanyo,日本);SDS-PAGE試劑盒(Sangon,USA);化痰祛瘀方配方溶液由本院制備。
1.2 Wilson病小鼠模型分組和藥物處理
1.2.1 實驗小鼠分組:購買20只健康4月齡Wilson病模型TX小鼠,平均體重為(22±2)g,將其飼養(yǎng)于室溫18~26 ℃、相對濕度50%~60%、模擬自然照明周期12/12 h的獨立通氣籠具。給予TX小鼠標準飼料,自由攝取食物和水。同時購買10只健康4月齡DL小鼠,平均體重為(22±2)g,雌雄對半,作為正常對照,同上法飼養(yǎng)。
1.2.2 實驗小鼠藥物處理:中藥化痰祛瘀方組方為,澤瀉、金錢草各24 g,大黃、姜黃、黃連各20 g,三七3 g。將姜黃、黃連、澤瀉、金錢草和三七以蒸餾水浸泡0.5 h后,高火煎煮,后加大黃,文火煎煮。過濾網過濾,重復添加蒸餾水,再次煎煮和過濾,濃縮至生藥量2.2 g/ml,藥液密封儲存于4 ℃冷藏箱。
模型組TX小鼠(n=10)飼養(yǎng)環(huán)境和飼養(yǎng)方法同上所述。選用純凈飲用水,2次/d,每次0.2 ml/10 g體重的劑量灌胃。而實驗組小鼠(n=10)則按上述制備中藥湯劑按0.2 ml/10 g體重的劑量灌胃(2次/d)。兩組前述處理時間為期28 d。另設正常對照組,將DL小鼠以前述同樣飼養(yǎng)方法置于相同環(huán)境,按照模型組TX小鼠灌胃方式進行處理。
1.3 實驗方法
1.3.1 腦組織取材:末次給藥12 h每組各取5只小鼠處死取材。以10%水合氯醛深度麻醉小鼠,斷頭脫頸處死。快速取實驗小鼠全腦,預冷PBS沖洗腦組織表面血液,快速獲取海馬區(qū)組織,低溫凍存于液氮中,一部分用于HE染色,一部分用于Western blot檢測。
1.3.2 Western blot檢測PI3K-AKT-mTOR信號通路相關因子蛋白表達水平:采用 Western blot 檢測PI3K-AKT-mTOR信號通路相關因子p-PI3K、PI3K、p-AKT、AKT、p-mTOR、mTOR及PCNA、Ki-67等細胞增殖相關蛋白的表達。取適量組織,加裂解液,快速研磨組織,冰上充分裂解。離心取上清液,部分上清液用于BCA法測定蛋白含量;其余蛋白樣品變性凍存后,上樣,通過聚丙烯酰胺凝膠電泳、轉膜、封閉后,將PVDF膜置于孵育盒,加入適量稀釋后一抗(兔抗人p-PI3K、PI3K、p-AKT、AKT、p-mTOR、mTOR及PCNA、Ki-67單克隆抗體),于4 ℃下孵育過夜;后經HPR標記二抗室溫下孵育1.5 h后,進行ECL顯色。選取β-actin為內參,圖像分析使用Image J軟件。
1.3.3 Brd U摻入法檢測化痰祛瘀方處理Wilson病模型小鼠海馬神經細胞增殖:采用Brd U摻入法檢測化痰祛瘀方處理Wilson病模型小鼠海馬神經細胞增殖。每組剩余5只小鼠備用。將Brd U溶液以生理鹽水稀釋制備成待用實驗溶液(5 mg/ml)。配制后按50 mg/kg進行腹腔注射,每4 h注射1次,共計3次。末次注射后間隔4 h處死實驗小鼠取材。石蠟包埋制備組織切片,行免疫熒光染色。觀察小鼠海馬齒狀回神經細胞增殖情況。于200倍熒光顯微鏡下選取5個視野,計數(shù)Brd U陽性細胞,計算細胞增殖率。
1.4 統(tǒng)計學方法 采用SPSS 20.0統(tǒng)計學軟件進行分析,兩組間樣本均數(shù)比較采用t檢驗。計量資料用均數(shù)±標準差表示,以P<0.05表示差異具有統(tǒng)計學意義。
2 結 果
2.1 HE染色觀察三組海馬組織病理學變化 檢測結果顯示對照組海馬區(qū)神經細胞排列緊密,核圓而大,神經纖維排列整齊而密集;模型組神經細胞排列稀疏,核小深染,膠質細胞增生;同時,實驗組神經細胞排列排列較模型組整齊,核固縮減輕,膠質細胞輕度增生(圖1)。
2.2 Western blot檢測PI3K-AKT-mTOR信號通路相關因子蛋白相對表達水平比較 見表1。檢測結果顯示,與正常對照組比較,模型組總PI3K、AKT和mTOR蛋白水平以及p-PI3K、p-AKT和p-mTOR水平明顯升高,差異具有統(tǒng)計學意義(均P<0.05);提示PI3K-AKT-mTOR信號通路的激活。同時,與模型組相比,實驗組總PI3K、AKT和mTOR蛋白水平以及p-PI3K、p-AKT和p-mTOR水平則明顯抑制(均P<0.05);提示PI3K-AKT-mTOR信號通路的抑制。且與正常對照組比較,實驗組總PI3K、AKT和mTOR、p-PI3K、p-AKT和p-mTOR水平比較,差異無統(tǒng)計學意義(均P>0.05)。

圖1 三組海馬組織病理學表現(xiàn)(HE染色,×400)
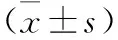
表1 三組PI3K-AKT-mTOR信號通路相關因子蛋白相對表達水平比較
2.3 Western blot檢測增殖相關因子蛋白相對表達水平比較 見表2。與正常對照組比較,模型組PCNA和Ki-67蛋白相對表達水平明顯降低,差異具有統(tǒng)計學意義(均P<0.05)。同時,與模型組比較,實驗組PCNA和Ki-67蛋白相對表達則明顯升高(均P<0.05)。與正常對照組比較,實驗組PCNA和Ki-67蛋白相對表達水平差異無統(tǒng)計學意義(均P>0.05)。
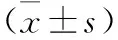
表2 三組增殖相關因子蛋白相對表達水平比較
2.4 Brd U摻入法檢測化痰祛瘀方處理Wilson病模型小鼠海馬神經細胞增殖 Brd U摻入法檢測化痰祛瘀方處理Wilson病模型小鼠海馬神經細胞增殖情況。模型組Brd U陽性細胞數(shù)(10.65±3.24)較正常對照組(60.22±9.37)明顯降低,差異具有統(tǒng)計學意義(P<0.05)。同時,與模型組相比,實驗組Brd U陽性細胞數(shù)(144.68±14.60)則顯著增加,差異具有統(tǒng)計學意義(P<0.05)。與正常對照組相比,實驗組Brd U陽性細胞數(shù)亦明顯增加,差異具有統(tǒng)計學意義(P<0.05)。
3 討 論
Wilson病得名于1911年Wilson的首次報道,又稱肝豆狀核變性,或威爾遜變性[7]。該病好發(fā)于青少年,是一種常染色體隱性遺傳性疾病,主要表現(xiàn)為先天性銅代謝障礙[12]。Wilson病的臨床表現(xiàn)包括食欲不振、輕度黃疸、肝臟腫大和腹水,部分患者可能出現(xiàn)進行性脾臟腫大和脾功能亢進等[13]。Wilson病的治療受益于早期診斷,以糾正患者銅代謝平衡。肝、腦、腎、角膜等臟器的銅沉積可進一步導致患者組織損害及病變,因此及早診療對于Wilson病患者至關重要。在中醫(yī)學角度而言,考慮到Wilson病的病機,銅在維持人體正常新陳代謝上發(fā)揮重要作用。然而,病理條件下,機體水液代謝失常,導致血淤痰堵,進而痰淤互結,最終構成Wilson病的主要病機[14-15]。基于前述內容,痰淤互結構成Wilson病治療的關鍵。
在本研究中,針對Wilson病痰淤互結的病因以及銅代謝障礙的病理,筆者研究團隊選用Wilson病模型4月齡TX小鼠設置治療方案實驗組和模型對照,并選用4月齡DL小鼠作為模型對照,探究本研究組方對Wilson病模型小鼠海馬神經細胞增殖的影響,明確該組方的效果。本研究所選化痰祛瘀方以大黃、姜黃、黃連、澤瀉、金錢草和三七六味藥為主,其中,大黃和黃連可有助于促進機體銅排泄,發(fā)揮解毒功效[16-17];姜黃和三七可活血化瘀[18-19],澤瀉可利水滲濕、泄熱泄?jié)幔疱X草可解毒散瘀[20-21]。
成年鼠的神經干細胞一般處于相對靜息狀態(tài),而腦損傷或缺血等病理狀態(tài)可引起海馬神經再生[22]。同時,Brd U是胸腺嘧啶的衍生物,其摻入具有穩(wěn)定性,可隨DNA復制進入細胞[23]。因此,Brd U特異性抗體的使用可檢測Brd U摻入情況,從而反映細胞增殖能力。本研究發(fā)現(xiàn)與正常小鼠相比,模型小組Brd U陽性細胞數(shù)降低,提示銅代謝障礙導致海馬神經細胞增殖的抑制;而實驗組Brd U陽性細胞數(shù)升高,提示化痰祛瘀方可有助于促進海馬神經細胞增殖。模型組PCNA和Ki-67蛋白表達水平與正常對照組相比明顯降低;而與模型組相比,實驗組PCNA和Ki-67蛋白表達則明顯升高。PCNA和Ki-67為常見細胞增殖相關標志物,二者水平變化與細胞增殖呈正相關[24]。此外,與正常對照組相比,模型組總PI3K、AKT和mTOR以及p-PI3K、p-AKT、p-mTOR蛋白水平較正常對照組明顯升高;而實驗組前述指標水平則較模型組顯著降低。眾所周知,PI3K、AKT和mTOR為PI3K-AKT-mTOR信號通路關鍵蛋白,其中PI3K可通過磷酸化產生磷脂酰基磷酸酶酯;AKT是PI3K下游關鍵蛋白;而mTOR是保守絲氨酸/蘇氨酸蛋白激酶,是該通路的關鍵位點;三者可參與細胞生長、增殖和凋亡等[25]。以上結果提示化痰祛瘀方對Wilson病具有明顯的抑制作用。因此,我們初步認為化痰祛瘀方是通過抑制PI3K-AKT-mTOR信號通路激活從而發(fā)揮抑制Wilson病模型小鼠海馬神經細胞增殖作用的。
綜上所述,本研究通過Wilson病模型TX小鼠實驗證實,化痰祛瘀方處理可有助于促進Wilson病小鼠海馬神經細胞增殖,上調PCNA和Ki-67蛋白表達水平。其機制可能與抑制PI3K-AKT-mTOR信號通路激活,下調PI3K、AKT和mTOR磷酸化水平相關。

