B6-Co 小鼠眼瞼成纖維細胞生長曲線及HSP70表達研究
姬桂青邱 天景 瑾朱順星邵義祥*
(1.南通大學神經再生重點實驗室,江蘇 南通 226001; 2.華東師范大學第二附屬中學,上海 201203;3.南通大學比較醫學研究所,江蘇 南通 226001)
先天性的角膜混濁(congenital corneal opacities,CCO)在新生兒中患病率只有1.4‰,雖然罕見但患病嚴重易致盲,如不能得到診治,將會導致弱視,影響新生兒的視覺發育,或者波及其全身發育(引發生長遲緩等)[1]。 因此能夠及早發現并治療CCO,具有重要意義。 一般研究認為常見的CCO 病因主要有兩種:一是外胚葉發育障礙性的角膜混濁,由于外胚葉的晶狀體和囊泡不能正常地分離外胚葉;二是炎癥引起角膜混濁(母體內血液或羊水感染)[2]。 前一種發育障礙主要是常染色體顯性遺傳因素導致,但深入機制尚不明確,這與先天性眼瞼閉合不全(eyelid open at birth,EOB)模型鼠[3]的現象極為相似。
EOB 小鼠在出生時眼瞼開放,這種異常現象可能是導致后代小鼠眼部疾患的重要原因[4]。 有研究發現通過ENU 誘變建立的B6-Co 突變系小鼠即具有EOB 特征[5-7]。 兩種小鼠角膜組織全蛋白二維凝膠電泳結果顯示,相比C57BL/6 小鼠(以下簡稱:B6 小鼠),B6-Co 小鼠電泳結果發現蛋白質點顯著上調的有6 個,顯著下調的蛋白質點有13 個,其中HSP70 下調最為顯著[8]。 熱休克蛋白70(HSP70)是熱休克蛋白家族中被研究最多的一種,尤其是對HSP70 家族的結構、功能以及表達調控機理的研究較多[9-10],HSP70 在細胞的周期調控[11]、胚胎發育[12-14]、衰老中具有重要的生物學功能[15]。而前期實驗[8]檢測兩種老鼠眼瞼組織內HSP70 蛋白表達差異性顯著,所以HSP70 與B6-Co 小鼠EOB表型出現可能存在聯系。
因此,本實驗選取從突變系B6-Co 小鼠和正常B6 小鼠(取18.5 d 孕鼠腹中胚胎)中取材培養的成纖維細胞[16-20],驗證HSP70 在兩種細胞中的含量是否存在差異,通過小干擾敲低B6 成纖維細胞HSP70 表達,檢測其遷移能力變化。 為體外驗證HSP70 的表達能否調控兩種細胞的生物學行為提供前期基礎。
1 材料和方法
1.1 實驗動物
實驗所用SPF 級C57BL/6 小鼠雌鼠20 只、雄鼠10 只(18~22 g,誤差小于10%)以及其突變系B6-Co 小鼠(SPF 級,18 ~22 g 誤差小于10%)雌鼠10 只、雄鼠5 只,選用小鼠均為8 周齡,均由南通大學實驗動物中心提供[SCXK(蘇)2019-0001]。 前期實驗取材于南通大學實驗動物中心[SYXK(蘇)2017-0045]完成。 實驗鼠飼養于SPF 級屏障動物房內,室內溫度(21 ± 1)℃,相對濕度(55 ± 5)%,自由采食和自由飲水,晝夜明暗交替時間12 h/12 h,定期更換籠具、墊料,實驗過程中所有操作符合實驗動物福利要求,獲得南通大學實驗動物倫理委員會批準(IACUC:20180808-001)。 B6 雄性與B6雌性小鼠以1 ∶2比例配對,共5 籠;B6-Co 雄性小鼠與B6 雌性或B6 雄性與B6-Co 雌性小鼠以1 ∶2比例配對,共5 籠。 每天早上8 點前檢栓,見栓當日胚齡記為0.5 d。
1.2 主要試劑與儀器
CO2細胞培養箱(Thermo);倒置相差顯微鏡(Leica);Transcriptor First Strand cDNA Synthesis kit(Roche,REF:04897030001);0.25% 胰蛋白酶(含EDTA)(Hyclone)、總RNA 提取試劑(TRIzol)(生工,Lot:FB06KB3578);SDS - PAGE Preparation kit凝膠試劑盒(生工,C631100-0200);GAPDH 一抗(Abcam,ab9485);HSP70 一抗(Abcam,ab2787);lysis buffer(生工,G301DB0009);胎牛血清,FBS(Gibico,美國);DMEM 高糖培養基(Gibico,美國)

表1 根據HSP70 基因設計siRNA 序列Table 1 Design siRNA sequence based on HSP70 gene
1.3 實驗方法
1.3.1 分離和培養小鼠眼瞼成纖維細胞
取妊娠期18.5 d 的孕鼠麻醉消毒,剖腹取胎鼠(觀察B6-Co 胎鼠的眼瞼部開閉,眼瞼開啟則為EOB 表型小鼠,眼瞼關閉則舍棄,B6 孕鼠腹中胎鼠則全部可用)的眼瞼組織剪碎,胰酶消化,100 目、40目網篩梯度過濾,離心,完全培養基重懸,放于37℃、5% CO2培養箱中培養;24 h 后換新鮮完全培養基。 細胞按照1 ∶3傳代,傳代3 次以上待用。
1.3.2 小鼠眼瞼成纖維細胞的觀察
將細胞傳代培養到第3 代時,將細胞接種于圓玻片上,進行細胞爬片;待細胞密度約80%,棄去培養基,PBS 洗滌,70%乙醇固定過夜,PBS 輕洗細胞;蘇木素染色20 min,自來水清洗。 伊紅染色2 s,自來水清洗。 乙醇梯度脫水透明,滴加中性樹膠蓋玻片,拍照。
1.3.3 小鼠眼瞼成纖維細胞的鑒定
將細胞傳代培養到第3 代時,將細胞接種于圓玻片上,進行細胞爬片;待細胞密度約80%,棄去培養基,PBS 洗滌細胞,進行固定、通透、封閉等常規細胞免疫熒光染色步驟,在熒光顯微鏡下觀察拍照。
1.3.4 檢測小鼠眼瞼成纖維細胞的生長曲線
取對數生長期細胞,每孔種2×104個細胞。 將接種好的細胞培養板放入培養箱中培養過夜,每組設3 個復孔取均值,實驗重復3 次。 在培養1 d、2 d、3 d、4 d、5 d、6 d 和7 d 后直接血球計數板進行細胞計數。
1.3.5 兩種成纖維細胞內HSP70 mRNA 含量檢測
從18.5 d 的孕鼠體內獲取B6-Co 和B6 胎鼠,從其眼瞼部位取材培養成纖維細胞待其傳代3 次之后種六孔板,重復3 次。 通過常規方法提取RNA、逆轉錄和Real-time PCR(目的基因以內參基因的GAPDH進行校正,每個樣本3 次重復。 根據HSP70 基因mRNA 設計RT-PCR 反應引物:GAPDH:Primer-F:5’-GGAGCGAGACCCCACTAAC-3 ’; Primer-R: 5 ’-GGCGGAGATGATGACCCT-3’. HSP70:Primer-F:5’-CCAAGGTGCAGGTGAAC TACAAGG-3’; Primer-R:5’-GCCGCTGAGAGTCGTTGAAGTAG-3’.)使用2-ΔΔCT法進行相對定量分析。
1.3.6 Western blot 檢測眼瞼成纖維細胞內HSP70蛋白相對表達量
在兩種細胞培養至第3 代后,接種細胞,收集3次樣本,提取兩種細胞的全蛋白、電泳(80 V,120 V)、轉膜(300 mA,90 min),室溫封閉2 h。 一抗4℃孵育過夜(1/1000),PBST 洗3 × 10 min。 二抗室溫孵育2 h(1/1000),PBS 洗3 × 20 min,顯影。
1.3.7 siRNA-HSP70 的設計與合成
在NCBI 數據庫查詢小鼠HSP70 基因序列(Accession Number:NM_010478.2),最終設計3 條siRNA 序列、1 條NC 序列進行合成,見表1。 siRNAHSP70 的合成委托上海吉瑪制藥技術有限公司。
1.3.8 siRNA-HSP70 轉染B6 小鼠眼瞼成纖維細胞
B6 小鼠眼瞼成纖維細胞種于12 孔板中,待密度達到50%~60%時,取2 μL siRNA-HSP70 溶于100 μL Opti-MEM 基 培 中, 再 取 2 μL Lipofectamin2000 溶于100 μL Opti-MEM 基培中,混勻后,室溫各孵育5 min;再將兩者混勻,室溫孵育20 min;成纖維細胞換液,更換成基礎培養液800 μL;混合液加入12 孔板中,混勻,細胞37℃,5%CO2培養箱中培養6 h 后更換成完全培養液。 細胞轉染后48 h 提取總RNA、72 h 提取總蛋白。
1.3.9 Transwell 檢測眼瞼成纖維細胞遷移能力的變化
本實驗選用直徑6.5 mm, 孔徑8 μm 的Transwell 小室;0.25%胰酶將轉染的細胞消化,以DMEM 基礎培養基重懸并調整細胞濃度至每毫升5×105個細胞;加100 μL 細胞懸液至Transwell 上室,加入500 μL DMEM 培養基(含5%胎牛血清)至Transwell 下室,于CO2培養箱中培養24 h;取出Transwell 小室,吸盡培養基,PBS 清洗3 次;放入4%多聚甲醛中固定20 min;棄固定液,PBS 搖床洗10 min;放入結晶紫中室溫染色10 min;PBS 輕洗2 次,每次5 min;用脫脂棉擦去小室上表面細胞,顯微鏡下取5 個視野拍照計數,以備后續統計、分析。
1.4 統計學方法
采用STATA V16.1 統計學軟件進行數據處理,用GraphPad Prism 8 軟件進行統計作圖。 數據結果用平均數±標準差(±s)表示,獲得數據分析為正態性分布,采用配對t檢驗,當P<0.05 視為差異有統計學意義。
2 結果
2.1 成纖維細胞形態
使用倒置相差顯微鏡觀察從B6 和B6-Co 小鼠眼瞼取出的成纖維細胞,在400 倍鏡下可以看出兩種成纖維細胞都呈現梭形、星型、多角型。 但是B6小鼠的成纖維細胞更為舒展,且胞體較大;而B6-Co小鼠的眼瞼成纖維細胞在400 倍鏡下發現其邊緣較為粗糙,形態與B6 相比更為狹小,見圖1。
2.2 通過免疫熒光法鑒定B6 和B6-Co 小鼠成纖維細胞
使用免疫熒光技術鑒定原代取材的細胞,根據文獻查閱發現:使用眼瞼部位皮膚進行原代取材一般存在兩種細胞:成纖維細胞與角質形成細胞。 因此使用Vimentin (波形蛋白)和Cytokeratin (細胞角蛋白)進行免疫熒光染色(圖2、圖3),因為波形蛋白是成纖維細胞的標志性蛋白,而細胞角蛋白是角質形成細胞的標志性蛋白。 所以從圖2、圖3 中發現,在B6 與B6-Co 兩種成纖維細胞中的細胞質里,發現被染色的波形蛋白,而沒有出現細胞角蛋白,說明成纖維細胞純度達到100%。 因此,可以證明原代取材B6 和B6-Co 小鼠眼瞼部位成纖維細胞成功。
2.3 通過HE 染色觀察B6 和B6-Co 小鼠成纖維細胞
HE 染色方法主要是用蘇木素染核呈藍色,而伊紅染色主要是染細胞胞漿。 從圖4 可以發現,絕大多數細胞呈長梭形,胞漿為紅色,細胞核被染成藍色,符合成纖維細胞特征。 B6 和B6-Co 小鼠成纖維細胞在HE 染色上沒有顯著性差別。
2.4 通過血球計數板法檢測B6 和B6-Co 小鼠成纖維細胞生長
通過血球計數板計數法,原代取材培養三代以后,胰酶消化后離心棄上清,重懸沉淀,人工計數,種板——每孔約2×104個。 之后7 d 定時通過數值統計,得出圖5 的兩種細胞生長曲線。 可以發現兩種細胞都呈現增殖趨勢,但在第7 天略微下降,細胞長滿進入平臺期。 而B6 小鼠成纖維細胞數量統計每天都略高于B6-Co 小鼠成纖維細胞數量,B6 小鼠成纖維細胞第1 天后即進入指數增長期,B6-Co 則在第2 天進入指數增長期,因此由圖5 可以判定,B6-Co 小鼠成纖維細胞增殖速度顯著低于B6 正常成纖維細胞增殖速度(P<0.01)。
2.5 通過Real-time PCR 法檢測B6-Co 和B6 小鼠成纖維細胞內HSP70 mRNA 的表達
通過常規方法提取RNA 進行Real-time PCR 實驗,從圖中發現,B6-Co 小鼠眼瞼部位成纖維細胞HSP70 mRNA 表達量低于B6 小鼠眼瞼成纖維細胞,且二者具有顯著性差異(圖6)。
2.6 通過Western blot 檢測B6-Co 和B6 小鼠成纖維細胞內HSP70 蛋白表達量
通過Western blot 實驗發現,B6-Co 小鼠眼瞼部位成纖維細胞的HSP70 蛋白表達量低于B6 小鼠成纖維細胞,且二者具有顯著性差異(圖7)。
2.7 siRNA-HSP70 對HSP70 基因的干擾效率
在轉染48 h 后,通過Real-time PCR 驗證HSP70 基因mRNA 水平的干擾效率;在轉染72 h后,通過Western blot 驗證HSP70 基因蛋白水平的干擾效率。 結果表明(圖8):各組均能對靶基因的mRNA 及蛋白表達產生抑制作用,siRNA-HSP70-3組較其他組抑制作用最強,B6 小鼠眼瞼成纖維細胞HSP70 基因的表達量下降最為顯著,干擾效率高達70%以上(P<0.01),以上結果表明siRNA-HSP70-3 能夠有效靶向抑制HSP70 基因的表達,保證后續實驗的有效開展。
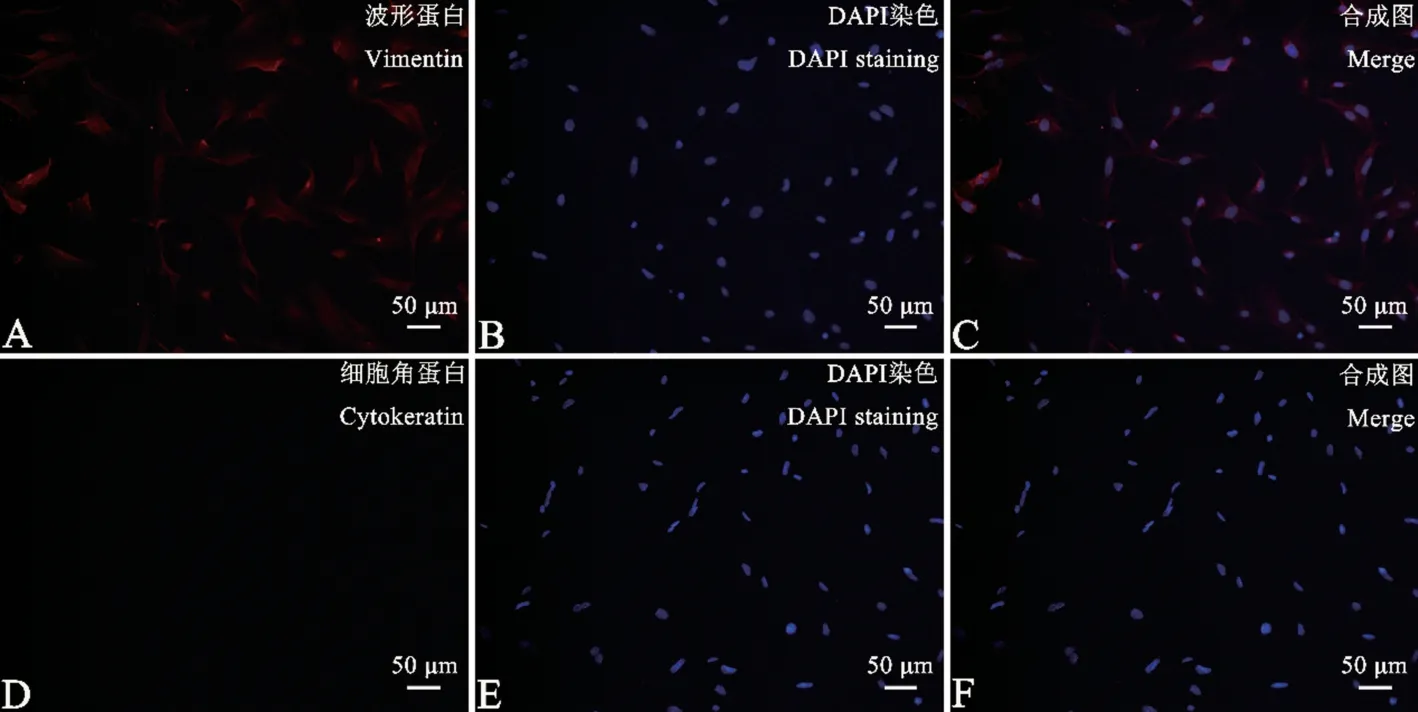
注:A:波形蛋白;D:細胞角蛋白;B、E:DAPI 染色;C、F:合成圖。圖2 免疫熒光鑒定B6 小鼠的眼瞼成纖維細胞Note. A, Vimentin. D, Cytokeratin. B/E, DAPI staining. C/F, Merge.Figure 2 Immunofluorescence identification of orbital fibroblasts from B6 mice
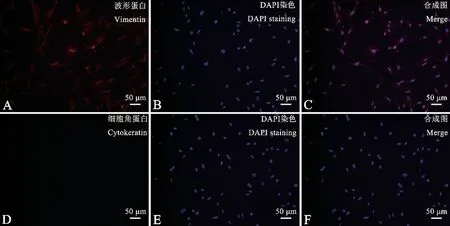
注:A:波形蛋白;D:細胞角蛋白;B、E:DAPI 染色;C、F:合成圖。圖3 免疫熒光鑒定B6-Co 小鼠的眼瞼成纖維細胞Note. A, Vimentin. D, Cytokeratin. B/E, DAPI staining. C/F, Merge.Figure 3 Immunofluorescence identification of orbital fibroblasts from B6-Co mice
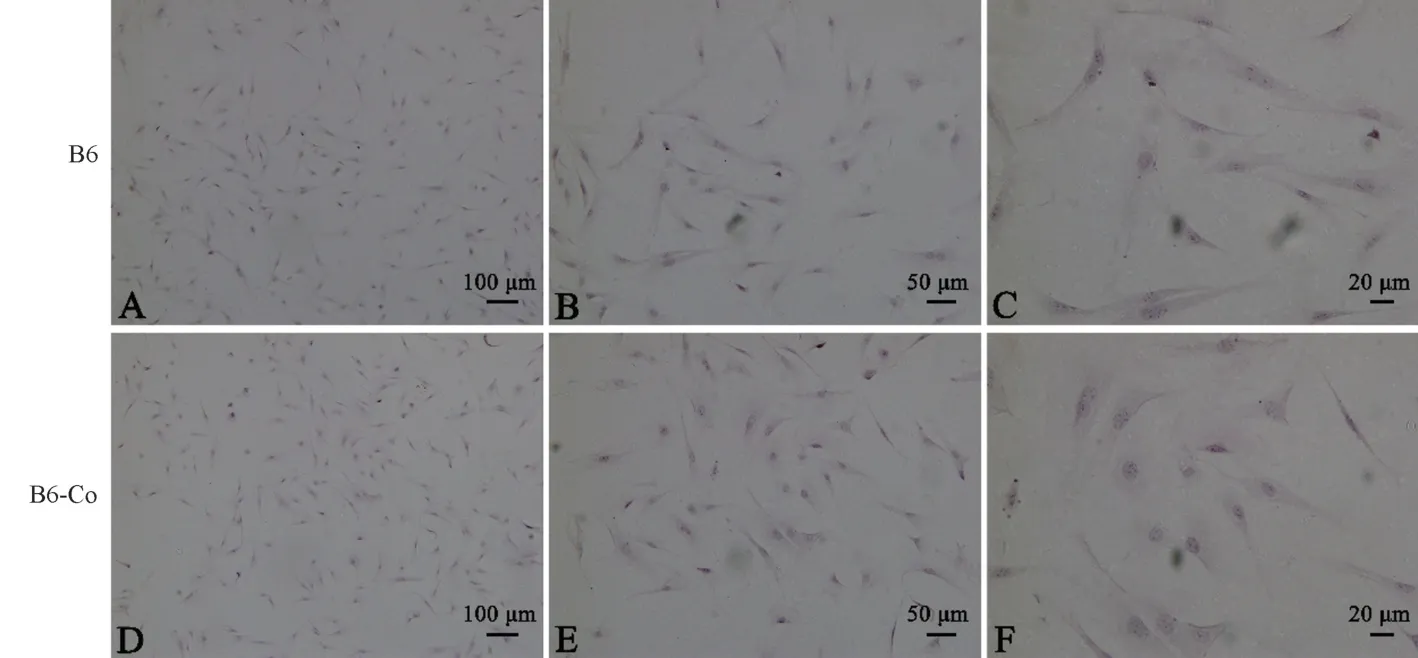
注:A/B/C:B6 小鼠眼瞼成纖維細胞;D/E/F:B6-Co 小鼠眼瞼成纖維細胞。圖4 HE 染色鑒定B6 與B6-Co 小鼠眼瞼成纖維細胞Note. A/B/C, B6 mouse orbital fibroblasts. D/E/F, B6-Co mouse orbital fibroblasts.Figure 4 HE staining of B6 and B6-Co mouse orbital fibroblasts
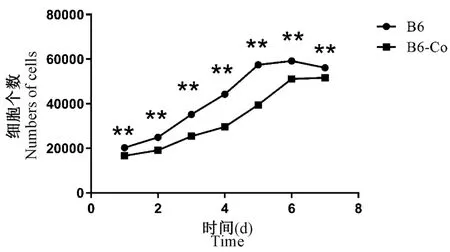
注:血球計數板計數B6 和B6-Co 小鼠成纖維細胞個數,與B6 組相比,**P <0.01。圖5 B6 和B6-Co 小鼠成纖維細胞生長曲線Note. The number of fibroblasts in B6 and B6-Co mice was counted by blood cell counting plate. Compared with the B6 group, **P <0.01.Figure 5 Growth curve of fibroblasts in B6 and B6-Co mice

注:Real-time PCR 檢測B6-Co 和B6 小鼠成纖維細胞內HSP70 mRNA 表達量。 與B6 組相比,**P <0.01。圖6 B6-Co 和B6 小鼠成纖維細胞內HSP70 mRNA 表達量對比Note. The expression of HSP70 mRNA in B6-Co and B6 mouse fibroblasts was detected by Real-time PCR.Compared with the B6 group, **P<0.01.Figure 6 Comparison of HSP70 mRNA expression in fibroblasts of B6-Co and B6 mice
2.8 siRNA-HSP70 對B6 成纖維細胞遷移能力的影響
通過Transwell 遷移實驗檢測HSP70 基因下調后成纖維細胞的體外遷移能力,由實驗結果(圖9)可知,siRNA -HSP70 組的成纖維細胞,在Transwell 小室接種培養24 h 后,其穿過小室的細胞數量極顯著低于siRNA -NC 組(P<0.01),這表明敲低HSP70 基因能夠顯著降低B6 成纖維細胞的體外遷移能力。
3 討論
先天性角膜混濁(congenital corneal opacities,CCO)是一種較為罕見的遺傳性疾病,目前對于CCO 的診斷治療仍在不斷探索之中,而對發育障礙引發的角膜混濁一直廣受眼科學研究者關注。
發育障礙引發角膜混濁主要由遺傳因素導致,這與EOB 模型鼠的現象類似。 人類胚胎時期眼睛的發育過程一般有以下幾個過程:眼瞼生長——覆蓋眼球——全部融合——重新打開(出生后)[16]。在小鼠胚胎期眼睛發育過程中,同樣經歷上下眼瞼生長——覆蓋眼球——全部融合——重新打開的過程[4],與人類不同的是正常小鼠出生時閉眼,至出生后12 ~14 d 才睜眼。 而EOB 表型的小鼠在出生時即睜眼,這種異常現象是導致后代小鼠眼部患病的重要原因之一。 B6-Co 突變系小鼠出生時眼瞼即張開,使得幼年期眼部易受病原體感染[5],不能保護小鼠眼睛的正常發育,從而易患角膜炎,進而逐步發展為角膜混濁,與人類角膜混濁的發病機制極為相似,是研究人類CCO 的良好疾病動物模型。

注:Western blot 檢測B6-Co 和B6 小鼠眼瞼成纖維細胞內HSP70 蛋白表達及其統計圖。 與B6 組相比,*P <0.05。圖7 B6-Co 和B6 小鼠眼瞼成纖維細胞內HSP70 蛋白表達量對比Note. Western blot was used to detect the expression of HSP70 protein in B6-Co and B6 mouse eyelid fibroblasts and its statistical diagram. Compared with the B6 group, *P <0.05.Figure 7 Comparison of HSP70 protein expression in fibroblasts of B6-Co and B6 mice
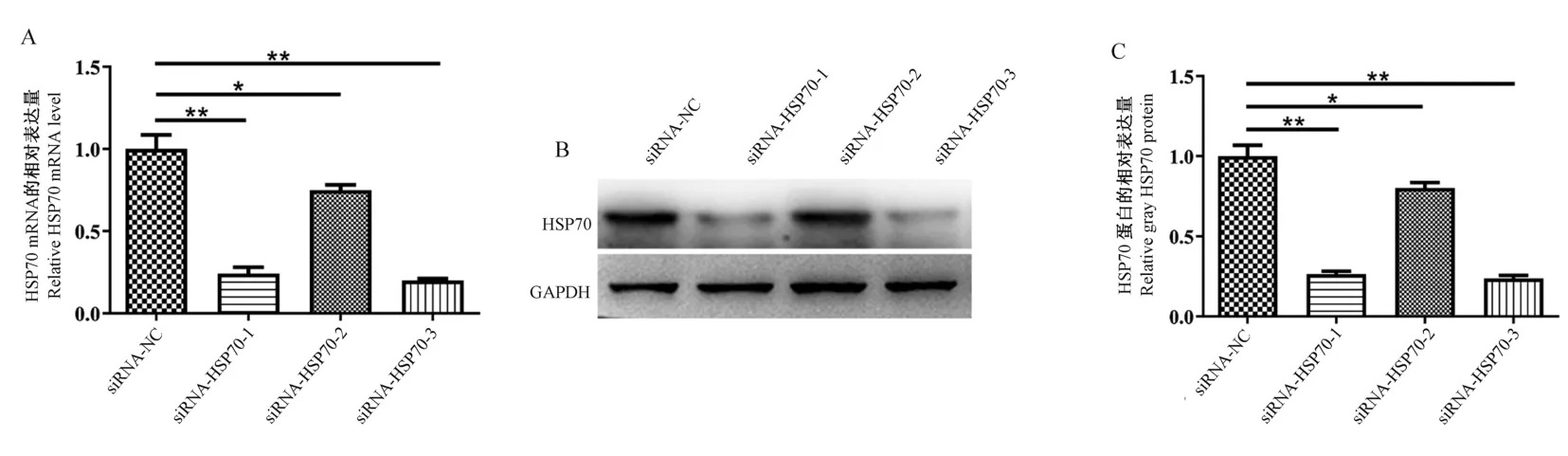
注:A:Real-time PCR 檢測成纖維細胞在轉染siRNA-HSP70 后HSP70 mRNA 的相對表達量;B:Western blot 檢測HSP70 蛋白的表達量;C:B 的統計結果。 與siRNA-NC 組相比,*P<0.05,**P<0.01。圖8 siRNA-HSP70 對HSP70 基因的干擾效率Note. A, Real-time PCR was used to detect the relative expression of HSP70 mRNA in fibroblasts after transfection with siRNA-HSP70. B,Western blot to detect HSP70 protein expression. C, B statistical results. Compared with the siRNA-NC group, *P<0.05, **P<0.01.Figure 8 The interference efficiency of siRNA-HSP70 on HSP70 gene
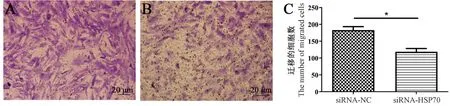
注:A:siRNA-NC 組穿過Transwell 小室的成纖維細胞;B:siRNA-HSP70 組穿過Transwell 小室的成纖維細胞;C:A、B 的統計圖。 與siRNA-NC 組相比,*P<0.05。圖9 siRNA-HSP70 對成纖維細胞遷移能力的影響Note. A, Fibroblasts passing through Transwell chamber in siRNA-NC group. B, Fibroblasts passing through Transwell chamber in siRNAHSP70 group. C, Statistical charts for A and B. Compared with the siRNA-NC group, *P <0.05.Figure 9 Effect of siRNA-HSP70 on migration ability of fibroblasts
HSP70 蛋白是熱休克蛋白家族中被研究較多的一種蛋白,大多數研究者關注在HSP70 家族的結構、功能以及表達調控機理方面的研究[11-14]。 在前期實驗中通過比較兩種小鼠角膜組織蛋白分析發現突變系B6-Co 小鼠中HSP70 基因的表達量顯著下調[8],所以B6-Co 小鼠體內HSP70 表達量的進一步降低可能影響了眼瞼成纖維細胞增殖遷移[16]能力,導致其胚胎期上下緣眼瞼無法正常生長融合,導致該小鼠出生時的EOB 表型。 有研究表明,HSP70 在細胞內的含量可能與胚胎發育中保護與被保護有關[21],細胞內HSP70 的表達量的高低可能影響成纖維細胞在胚胎期發育[22-27]。 眼瞼邊緣部位細胞遷移障礙是引發B6-Co 出現EOB 表型的重要原因,因而成纖維細胞的遷移運動能力強弱是小鼠出生前眼瞼愈合重要因素。 而實驗(圖9)通過小干擾實驗敲低B6 小鼠成纖維細胞HSP70 的表達,使用Transwell 檢測細胞遷移能力,發現成纖維細胞的遷移能力被顯著性降低(P<0.05)。
本實驗結果表明,B6 和B6-Co 小鼠胚胎期眼瞼成纖維細胞內HSP70 的mRNA 表達量和蛋白表達量存在顯著差異,與兩種小鼠角膜組織蛋白二維凝膠電泳的結果一致。 說明HSP70 基因及蛋白表達下調影響了B6-Co 的成纖維細胞生長曲線,同時下調HSP70 表達降低了成B6 纖維細胞遷移能力。 因此HSP70 基因可能參與成纖維細胞胚胎期發育的調控,最終造成B6-Co 小鼠EOB 表型。 HSP70 基因如何調控成纖維細胞的增殖、遷移和凋亡? 其他相關基因又是如何影響成纖維細胞的生長發育? 眼瞼、眼附屬器以及眼角膜等胚胎發育過程中的協調機制又是如何實現的? 這一系列問題均有待于持續深入研究才能闡明,而B6-Co 小鼠將來能否作為眼病研究的動物模型還需進一步探討。

