三文魚中晚期糖基化終末產物含量測定及產地特征因子分析
徐正華,吳家麗,朱克衛,梁玉燊,楊雪嬌,趙 勇,凌 菁,鄭思珩,周衡剛,張 昆,朱玉珍,曾茂茂,*
(1.黃埔海關技術中心,廣東 廣州 510770;2.江南大學 食品科學與技術國家重點實驗室,江蘇 無錫 214122;3.廣州海關技術中心,廣東 廣州 510000)
晚期糖基化終末產物(advanced glycation end products,AGEs)是由還原糖和蛋白質、脂質、多肽、氨基酸的末端游離氨基等通過美拉德反應生成的一系列共價加成物總稱[1-2]。研究表明,AGEs可以通過食物攝入,其在人體內的積累與糖尿病及其肝病、腎病、心臟病等并發癥以及動脈粥樣硬化、阿爾茨海默癥、骨性關節炎、視網膜病變、白內障、尿毒癥等有著密切關系[3-5]。因此,AGEs在醫學和生物學上引起了廣泛的關注,但國內外對食品中AGEs的研究相對較少,相關檢測標準與規范尚處于空白狀態,不同食品中的安全限量也尚未明確。目前有20多種AGEs被鑒定[6],包括羧甲基賴氨酸(N-carboxymethyllysine,CML)、羧乙基賴氨酸(N-carboxyethyllysine,CEL)、戊糖苷素、吡咯素、丙酮醛-賴氨酸二聚體與乙二醛-賴氨酸二聚體等,其中,CML和CEL是最具代表性的AGEs,可以作為食品體系中美拉德反應程度的指標[7]。因此,食品領域相關研究主要圍繞這2 種AGEs開展[8-9]。
三文魚被譽為“魚中至尊”,含有豐富的蛋白質、8 種人類必需氨基酸、ω-3高不飽和脂肪酸、礦物質及微量元素,具有極高的營養價值[10-11]。目前查到與三文魚中AGEs有關的文獻有4 篇,但這些研究都只集中在CML,并且得出的結果缺乏一致性。Charissou等[12]報道在三文魚中未檢出CML;Chao Peichun等[13]在鮮三文魚中檢出CML,含量為100 ng/g;Uribarri等[14]使用酶聯免疫法檢測到冷凍三文魚中CML含量為517 kU/100 g,新鮮三文魚中CML含量為527 kU/100 g,但是酶聯免疫法得出的是樣品中CML相對值,不是絕對值,與儀器法得出的絕對含量無法進行比較;Chen Gengjun等[15]檢測鮮三文魚中CML含量為1 920 ng/g樣品,烤三文魚中CML高達10 780 ng/g樣品,與之前報道的含量有顯著性差異,在其他食品中CML含量與變化規律方面與Chao Peichun等[13]研究也存在一定出入。
本實驗以源自3 個國家的21 條三文魚為實驗樣品,經過脫脂、還原、蛋白質水解、固相萃取凈化等步驟后,采用同位素內標稀釋超高效液相色譜-串聯三重四極桿質譜(ultra-high performance liquid chromatographytandem mass spectrometry,UPLC-MS/MS)法測定其CML和CEL含量。對所獲數據進行統計分析,以期更加全面地反映三文魚中AGEs整體含量,為不同研究小組報道的三文魚中CML含量存在顯著性差異的原因提供可能的解釋。本實驗測定三文魚中CEL含量,并提出CEL有望成為鑒別挪威三文魚與智利、法羅群島三文魚的產地特征因子,研究成果為三文魚的產地溯源及真偽鑒別提供新思路,為后續更深入的研究打下基礎。
1 材料與方法
1.1 材料與試劑
21 份冰鮮三文魚(品種均為大西洋鮭)樣品分別來自3 個主要進口國挪威(n=7)、智利(n=7)和丹麥法羅群島(n=7),均在廣州白云機場口岸空運進境,由原出入境檢驗檢疫局監管科抽樣送入實驗室檢驗,冰鮮三文魚去皮后將魚身肉(包含魚頭肉)取下混勻待測。
CML標準品、CEL標準品、D4-CML同位素內標、D4-CEL同位素內標(純度均大于98%) 美國Santa Cruz Biotechnology公司;甲醇、乙腈和正己烷(均為色譜級) 美國Fisher Scientific公司;硼酸、硼氫化鈉、濃鹽酸、濃硫酸、氫氧化鈉、正辛醇(均為分析純)上海國藥集團化學試劑有限公司。
1.2 儀器與設備
Oasis MCX固相萃取柱(60 mg,3 mL,60 μm)、ACQUITY UPLC TQD UPLC-MS/MS聯用儀 美國Waters公司;AX205型十萬分之一電子天平 瑞士梅特勒-托利多公司;QGC-12T型氮氣吹干儀 上海泉島科貿公司;Fotector-04HT型固相萃取儀 美國睿科公司。
1.3 方法
1.3.1 樣品前處理
脫脂:稱取約2 g三文魚樣品,加入3 mL正己烷,劇烈振蕩混勻后10 000 r/min離心15 min,移去上清液,重復該步驟3 次以徹底脫脂。將脫脂后的樣品放置于通風櫥中自然揮干正己烷殘留[16]。
樣品還原:向揮干后的樣品中加入0.2 mol/L硼酸鹽緩沖液(pH 9.2)1.5 mL,硼氫化鈉(1 mol/L,溶于0.01 mol/L氫氧化鈉溶液)溶液[17]1 mL,加入3 滴左右的正辛醇消泡[18],于4 ℃過夜充分還原。
酸水解:向還原后的樣品液加入濃鹽酸2.5 mL,真空密封后置于烘箱中110 ℃水解24 h[19]。水解完過濾,并定容至10 mL。準確吸取水解液600 μL,于60 ℃氮氣吹干,再加入150 μL內標溶液[20](1.0 μg/mL的D4-CML與D4-CEL混標)。
凈化:將吹干后的樣品用2 mL超純水復溶后過固相萃取柱凈化[21]。將該柱先使用3 mL甲醇、3 mL 0.1 mol/L的HCl溶液進行活化平衡,再將所有復溶后的樣液上樣,而后使用3 mL 0.1 mol/L的HCl溶液和3 mL甲醇依次進行淋洗,再用6 mL甲醇氨混合溶液(甲醇-氨水,95∶5,V/V)洗脫,活化和淋洗流速小于2 mL/min,上樣和洗脫流速小于0.5 mL/min。最后洗脫液用氮氣吹干,并使用200 μL水復溶、0.22 μm針式過濾器過濾后得到CML和CEL待測液,取5 μL進樣分析。
1.3.2 儀器條件
UPLC條件:色譜柱為ACQUITY UPLC HSS T3柱(2.1 mm×150 mm,1.8 μm);柱溫45 ℃;流動相A為100%乙腈,B為0.1%甲酸[22];梯度洗脫程序:0~0.1 min,1% A,99% B;0.1~5 min,1%~8% A,99%~92% B;5~5.5 min,8%~100% A,92%~0% B;5.5~6.5 min,100% A,0% B;6.5~7 min,100%~1% A,0%~99% B;流速0.2 mL/min。
MS條件:電噴霧離子源正離子采集方式;離子源溫度110 ℃;脫溶劑氣溫度400 ℃,流速600 L/h,毛細管電壓3.55 kV,氬氣碰撞器流量0.15 mL/min,氦氣錐孔氣流量50 L/h,錐孔電壓20 V。
目標物CML母離子m/z205,子離子m/z84和m/z130,錐孔電壓20 V,碰撞能量14 eV,駐留時間20 ms。目標物CEL母離子m/z219,子離子m/z88和m/z130,錐孔電壓20 V,碰撞能量16 eV,駐留時間20 ms;內標D4-CML母離子為m/z209,子離子為m/z88和m/z134,錐孔電壓20 V,碰撞能量15 eV,駐留時間20 ms;內標D4-CEL母離子為m/z223,子離子為m/z88和m/z134,錐孔電壓20 V,碰撞能量13 eV,駐留時間為20 ms。
1.4 數據處理
采用Microsoft Office Excel 2007軟件進行樣品中CML含量和CEL含量統計及差異比較分析,采用IBM SPSS Statistics 19.0分析軟件對樣品中CML含量和CEL含量進行主成分分析(principal component analysis,PCA)。
2 結果與分析
2.1 三文魚樣品中CML和CEL的UPLC-MS/MS分析
m/z205/84和m/z209/88離子對分別用于CML和D4-CML定量,m/z219/84和m/z223/84離子對分別用于CEL和D4-CEL的定性[23],標準品及同位素內標在多反應監測模式下都能得到良好的鑒定,見圖1。
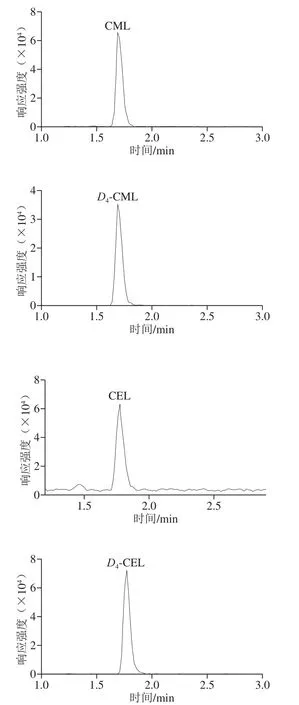
圖1 CML、D4-CML、CEL和D4-CEL的多反應監測模式色譜圖Fig. 1 Chromatograms of CML, D4-CML, CEL and D4-CEL in MRM mode
2.2 方法學考察結果
2.2.1 線性范圍、檢出限及定量限結果
將CML、D4-CML、CEL及D4-CEL分別配成20 mg/mL儲備液,再稀釋配制成標準工作液。以目標物的質量濃度為橫坐標(x),以目標物峰面積與對應內標物的峰面積的比值為縱坐標(y),繪制標準曲線。不斷稀釋CML與CEL的質量濃度,當目標峰信噪比為3時得到目標物檢出限,當目標峰信噪比為10時得到目標物定量限。如表1所示,該法完全能滿足三文魚中CML和CEL的定量分析需求。

表1 UPLC-MS/MS方法的標準曲線、線性范圍、相關系數、檢出限和定量限Table 1 Standard curves, linear ranges, correlation coefficients (r2),LOQs and LODs of the UPLC-MS/MS method
2.2.2 回收率及精密度結果
根據不加標三文魚樣品中CML和CEL含量分布,CML選取200、400、1 500 ng/g,CEL選取50、200、1 200 ng/g作為加標量進行加標回收實驗,每個添加水平重復測定6 次,見表2。結果顯示,3 個添加水平下的三文魚中CML和CEL平均回收率在90%~95%之間,相對標準偏差小于5%,說明本法檢測三文魚中CML和CEL的準確度和精密度良好。
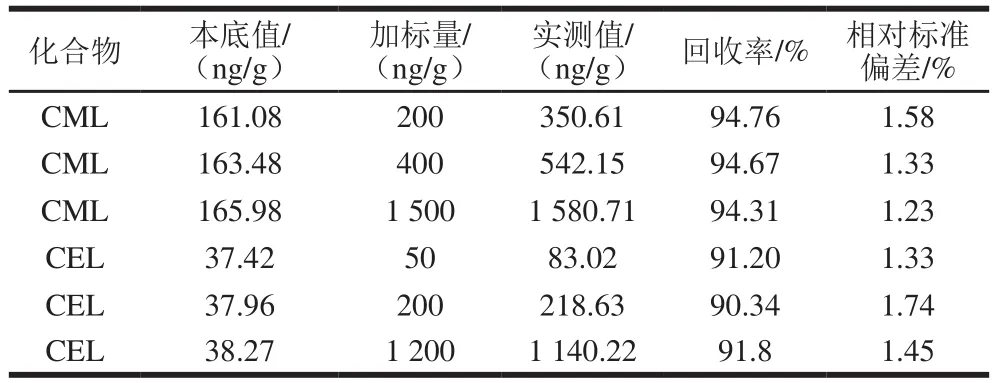
表2 三文魚中回收率和相對標準偏差Table 2 Recoveries and RSDs of CML and CEL in spiked salmon
2.2.3 三文魚樣品含量測定結果
從表3得知,在產自3 個不同國家的21 份三文魚樣品中均檢出CML和CEL,只是在含量上有所差異。這與Charissou等[12]在三文魚中未檢出CML的報道矛盾,這可能與其使用的衍生前處理步驟及氣相色譜-質譜聯用儀器有關。而與Chao Peichun等[13]檢出CML含量為100 ng/g,Chen Gengjun等[15]檢出CML含量為1 920 ng/g,在檢出含量上有比較大的差異,這可能與研究重點、樣本數量、三文魚產地及品種等有關。本實驗樣品數量大,產地及品種明確,樣品處理過程可控,可真實反映三文魚中CML含量分布。同時,本實驗測定三文魚中CEL含量高達1 002.02 ng/g,低至37.92 ng/g,含量相差顯著,這說明對CEL進行定量很有必要,一是可以更加全面了解AGEs整體在三文魚中的含量,二是可以為后續更深入的研究提供理論依據。

表3 不同產地三文魚中CML和CEL含量(n=3)Table 3 Contents of CML and CEL in salmon samples from different geographical origin (n= 3)
2.2.4 數據分析
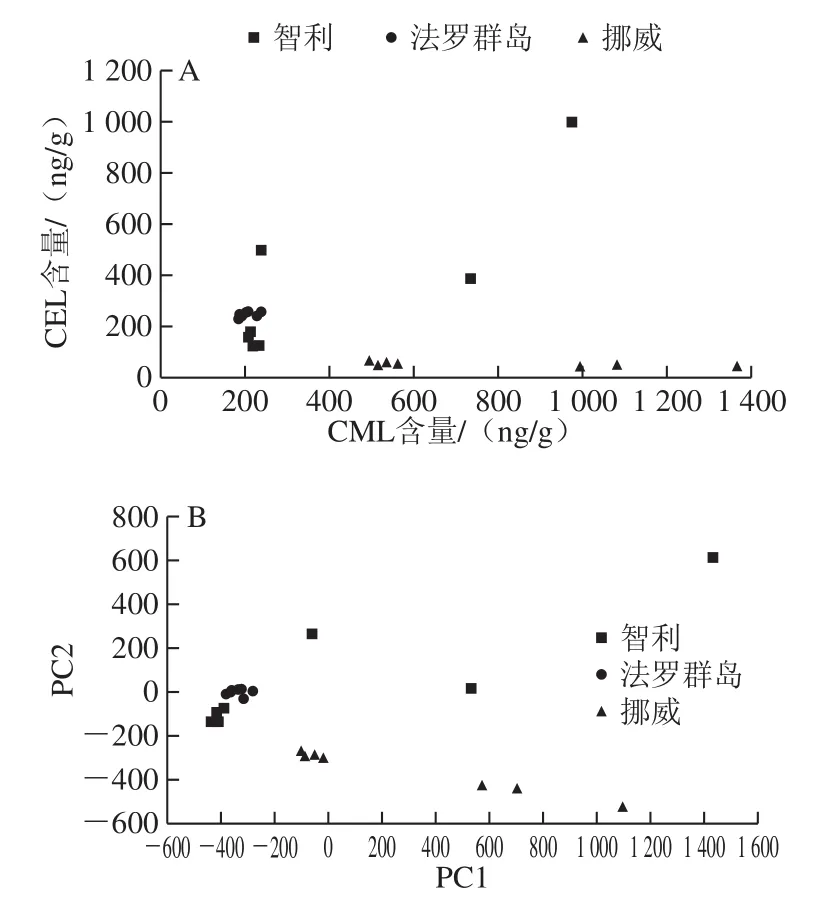
圖2 21 份三文魚樣品CML與CEL含量分布(A)和PCA(B)圖Fig. 2 Distribution of CML and CEL contents (A) and PCA (B) plot for 21 salmon samples
為更直觀分析不同國家三文魚中AGEs含量特點及規律,分別以CML含量和CEL含量為x軸和y軸繪制坐標圖,同時利用SPSS軟件對來自3 個國家的21 份樣品進行PCA[24-25],如圖2所示。以CML含量為PC1(66.6%),CEL含量為PC2(33.4%),無論是坐標圖還是PCA法得分投影圖,趨勢大體一致。
全球三文魚以挪威產量大,知名度高[26-27],因此國內市場上常出現以其他三文魚冒充挪威三文魚的現象[28-30]。本實驗表明,挪威三文魚CEL含量最低,且其在PC2(CEL)上能與其他2 個國家明顯分開,這說明PC2(CEL)可以顯示挪威三文魚的區域特征,有望作為產地特征因子用于鑒別挪威三文魚和智利、法羅群島三文魚。而智利和法羅群島三文魚樣本在PC1和PC2上都有不同程度的重疊,分類效果不理想,但是法羅群島的三文魚在PC1和PC2的得分分布成簇聚集,表明該國三文魚樣品間存在較好的相似性,即穩定性較好。而智利三文魚在PC1和PC2的得分分布較分散,表明智利三文魚個體間存在較大的相異性,即差異顯著。
3 結 論
本實驗建立穩定可靠的UPLC-MS/MS同時檢測三文魚中CML和CEL方法,并利用該法對源自3 個不同國家的21 份三文魚樣品進行CML和CEL含量測定。通過對所獲數據進行分析后,指出即使是相同品種的三文魚在不同國家和不同個體之間CML和CEL含量存在很大的生物差異性,為不同研究小組對三文魚中CML含量報道的結果不一致性提供了最大可能的解釋。與大多數研究食源性AGEs的報道都集中于CML不同的是,本實驗測定挪威、智利和法羅群島3 個國家三文魚(大西洋鮭)中CEL含量,并提出CEL有望作為產地特征因子用于挪威三文魚區別其他2 個國家三文魚的產地鑒別,肯定CEL的重要性,為后續研究提供理論依據。后期本研究團隊也會考慮進一步豐富樣品批次和產地數量加以確證和擴展該實驗成果。

