鐵皮石斛多糖對糖尿病性白內障大鼠氧化應激及ERK信號通路的影響
張曄,胡艷紅,柯發杰,陳勝,陳子揚,胡俊
隨著科技水平及生活水平的不斷提高,糖尿病的發病率逐年提升,預計到2040年,全球糖尿病患者將達到6.42億[1]。作為糖尿病致盲病中的第二大并發癥糖尿病性白內障,其治療仍以眼科手術為主。但如果是老年人和高血糖情況下更易發生如感染、角膜水腫和眼壓增高等諸多術后并發癥,且有些人因自身其他原因不能手術。近年來研究糖尿病性白內障的發病機制已成為眼科領域的熱點,其中氧化損傷無疑是研究的熱門[2-3],而氧化應激與絲裂原活化蛋白激酶MAPK信號通路的ERK、Raf等活化密切相關[4-5]。鐵皮石斛中的活性成分鐵皮石斛多糖(dendrobium officinale polysaccharide,DOP)有抗氧化、降血糖、抗細胞凋亡、抗腫瘤等作用[6]。本研究應用鏈脲菌素(streptozocin,STZ)建立糖尿病大鼠模型,檢測DOP對糖尿病性白內障大鼠血清中丙二醛(malondialdehyde,MDA)含量、超氧歧化物酶(superoxide dismutase,SOD)及谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)活力的變化,晶狀體ERK1、ERK2、MEK、Raf、Ras mRNA的表達水平,以明確DOP對糖尿病性白內障大鼠抗氧化作用的影響及其可能的潛在機制。
1 材料與方法
1.1 實驗動物
清潔級Wistar雄性大鼠50只,體重(180±20)g(福建省中醫藥研究院提供,許可證號:SCXK (閩)2012-0001),實驗動物條件符合《實驗動物管理條例》 要求。實驗動物飼養于濕度60%±10%和溫度(25±1)℃的環境中。實驗過程中對動物的處置符合《關于善待實驗動物的指導性意見》的要求,并經福建省中醫藥研究院動物倫理委員會批準。
1.2 主要試劑及儀器
DOP(批號:S20181201,純度≥85%)和STZ(批號:Sigma8050-20180601,純度≥98%)均購自上海源葉生物科技有限公司;MDA試劑盒(批號:20181012),SOD試劑盒(批號:20181112)和GSH-Px試劑盒(批號:20191102)均購自福州安布瑞生物科技有限公司;熒光定量PCR儀(美國ABI,7300)。
1.3 分組與建模
50只Wistar大鼠,經裂隙燈顯微鏡檢查所有大鼠雙眼晶狀體均透明。隨機分5組,對照組(control group,CG)、模型組(model group,MG)、鐵皮石斛多糖低(DOP low dose,DOPL)、中(DOP medium dose,DOPM)、高(DOP high dose,DOPH)劑量組,每組10只。模型組與DOP組大鼠建立糖尿病模型,4組大鼠均給予禁食不禁水12 h以上,按50 mg·kg-1體質量腹腔注射用檸檬酸緩沖液配制的10 g·L-1的STZ,對照組注射等量的檸檬酸緩沖液。注射2 h后喂食,72 h后取尾血測隨機血糖,血糖≥11.1 mmol/L者為糖尿病模型造模成功,取血糖值11.1~16.7mmol/L大鼠進行實驗。分別在造模前、后對所有大鼠進行裂隙燈檢查晶狀體透明度,晶狀體混濁者為糖尿病性白內障。
DOPL、DOPM、DOPH組分別給予DOP 25、50和100 mg·kg-1灌胃,對照組(CG)、模型組(MG)按相同容量生理鹽水灌胃,每日2次,時間為上午9點和下午3點,以維持一定的血藥濃度,且灌胃前后2 h禁止飲食,其余時間正常喂養。共用藥12周。
12周后處死大鼠,摘除眼球,在顯微鏡下后入路剪除眼球后壁,完整分離出晶狀體組織,用生理鹽水漂洗后液氮速凍,于-80℃冰箱中保存備用,每組10個樣本進行檢測。
1.4 晶狀體混濁程度評定
12周后在裂隙燈下觀察晶狀體,并使用晶狀體混濁分類系統(lens opacities classification system II,LOCS II)方法評定晶狀體混濁程度[7]。評定標準如下:C0,皮質透明;Ctr,皮質少量點狀混濁;C1,皮質點狀混濁擴大,瞳孔區內出現少量點狀混濁;C2,皮質車輪混濁,超過兩個象限;C3,皮質車輪狀混濁擴大,瞳孔區約50%混濁;C4,瞳孔區90%混濁;C5,混濁程度超過C4。N0,透明核,胚胎核清楚可見;N1,早期核混濁;N2,中等程度核混濁;N3,嚴重核混濁。
1.5 氧化應激指標檢測
12周后,腹腔靜脈采血,用硫代巴比妥酸法和黃嘌呤氧化酶法檢測大鼠血清中MDA、SOD、GSHPx的活性,具體操作按試劑盒說明操作:酶標板加入標準品,每孔加入血清樣本100 μL,37℃下孵育20 min,洗滌液洗滌3次;加入顯色劑,避光顯色5 min,加入終止液50 μL,在酶標儀412 nm測GSH-Px光密度值(optical density,OD),在酶標儀450 nm測MDA、SOD的OD值,計算樣品濃度。
1.6 晶狀體組織中ERK1、ERK2、MEK、Raf、Ras基因表達
采用熒光定量PCR檢測:用Trizol試劑提取并純化晶狀體RNA,并逆轉錄成cDNA。20 μL反應體系中含有:2×plus SYBR real-time mixture 10 μL、上下游引物各0.4 μL、cDNA模板2 μL、重蒸水6.8 μL、ROX I 0.4 μL。95 ℃預變性30 s后,進入40個循環:95 ℃×10 s、56 ℃×30 s、72 ℃×30 s,最后95 ℃×15 s、60℃×1 min、95℃×15 s、60℃×15 s。檢測ERK1、ERK2、MEK、Raf、Ras基因表達時以GAPDH作為內參(表1)。采用2-ΔΔCt方法用于比較每組中各基因的表達水平,ΔCT=CTERK1/ERK2/MEK/Raf/Ras-CTGAPDH,ΔΔCT=ΔCTMG組-ΔCTCG組,ΔΔCT=ΔCTDOP組-ΔCTMG組。所有PCR一式三份進行,并通過熔解曲線對單峰的存在進行驗證。
1.7 統計學方法
采用SPSS 21.0軟件對數據進行統計學分析,計量資料用均數±標準差()表示,多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗進行。計數資料采用Kruskal-Wallis檢驗。當P<0.05時,則認為差異具有統計學意義。
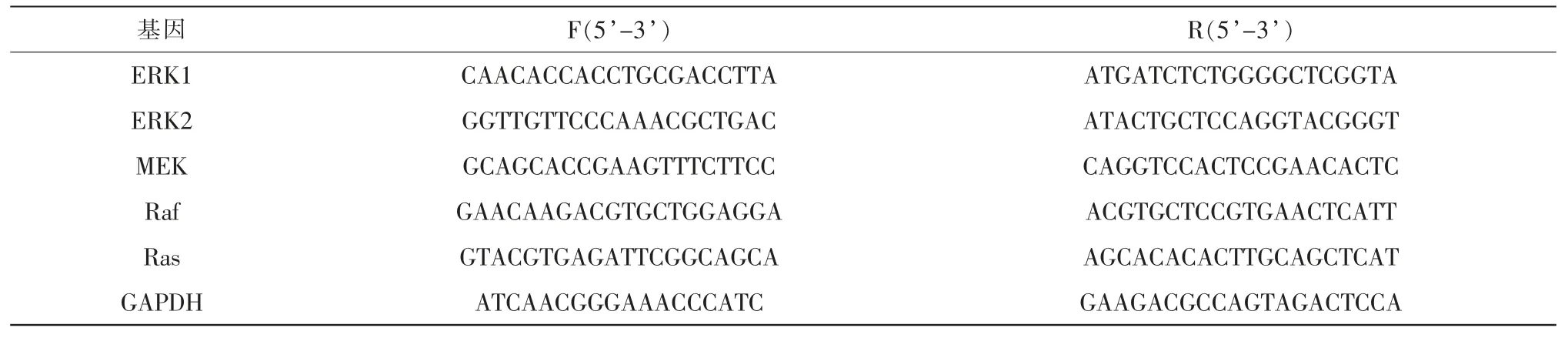
表1 RT-qPCR引物序列
2 結果
2.1 各組大鼠晶狀體混濁程度對比
注射STZ后12周在裂隙燈下大鼠晶狀體照相及混濁評定結果,可見對照組晶狀體混濁評定幾乎都在C0N0,模型組絕大多數晶狀體混濁程度在C3-4、N1-2,DOP組晶狀體混濁程度評定大部分在C1-2、N0-1,對照組大鼠晶狀體基本未發生混濁,保持透明;模型組晶狀體幾乎完全混濁;DOPH組晶狀體出現絮狀、片狀等部分混濁,混濁程度較模型組明顯減輕(表2、圖1)。三組間比較,差異有統計學意義(χ2皮質=49.401,χ2核=43.914,均P=0.000)。
2.2 DOP對糖尿病大鼠血清中氧化應激指標的影響
MDA含量:模型組大鼠血清MDA含量較對照組明顯升高,差異有統計學意義(t=4.615,P=0.000),DOP作用后大鼠血清MDA含量較模型組明顯下降,DOP劑量越高,MDA含量下降越明顯,組間比較差異均有統計學意義(tDOPL=4.046,tDOPM=6.504,tDOPH=6.587,均P=0.000)。
GSH-Px活力:模型組大鼠血清GSH-Px較對照組升高,但差異無統計學意義(P>0.05),DOPL組和DOPM組與對照組和模型組差異均無統計學意義(P>0.05),DOPH組較對照組(CG)和DOPL組明顯升高,差異有統計學意義(tCG=2.728,P=0.011;tDOPL=2.068,P=0.048)。
SOD活力:模型組大鼠血清SOD活力較對照組明顯降低,差異有統計學意義(t=9.809,P=0.000),DOP作用后,DOPL組與模型組差異無統計學意義(P>0.05),DOPM和DOPH組均較模型組升高,差異有統計學意義(tDOPM=2.914,P=0.007;tDOPH=13.305,P=0.000),但DOPM組與DOPH組之間差異無統計學意義(P>0.05)(表3)。
2.3 DOP對糖尿病大鼠晶狀體ERK1、ERK2、MEK、Raf、Ras mRNA表達的影響
與對照組比較,模型組(MG)、DOPL組、DOPM組的ERK1 mRNA呈高表達,差異有統計學意義(tMG=4.569,P=0.000;tDOPL=2.072,P=0.041;tDOPM=2.423,P=0.017);隨著DOP濃度增高,ERK1 mRNA表達水平逐漸降低,DOPH組ERK1 mRNA表達水平較對照組更低,差異有統計學意義(t=7.849,P=0.000);與對照組比較,模型組、DOPL組、DOPM組的ERK2 mRNA呈高表達,差異有統計學意義(tMG=3.710,P=0.000;tDOPL=2.542,P=0.013;tDOPM=2.934,P=0.024);隨著DOP劑量增高,ERK2 mRNA表達水平逐漸降低,DOPH組ERK2 mRNA表達水平與對照組比較,差異無統計學意義(P>0.05);與對照組比較,模型組與DOP三個劑量組的MEK mRNA呈高表達,差異均有統計學意義(tMG=4.091,P=0.000;tDOPL=4.046,P=0.001;tDOPM=4.493,P=0.000;tDOPH=4.403,P=0.000);但模型組與DOP三個劑量組比較,差異均無統計學意義(P>0.05);與對照組比較,模型組、DOP三個劑量組的Raf mR-NA呈高表達,差異有統計學意義(tMG=4.546,P=0.000;tDOPL=2.911,P=0.036;tDOPM=6.195,P=0.000;tDOPH=8.494,P=0.000);隨著DOP濃度增高,Raf mRNA表達水平逐漸降低;與對照組比較,模型組、DOPM組的RasmRNA呈高表達,差異有統計學意義(tMG=3.083,P=0.020;tDOPM=4.297,P=0.000);DOPM組的Ras mRNA表達水平較DOPL組升高,差異有統計學意義(t=2.913,P=0.036)(表4)。
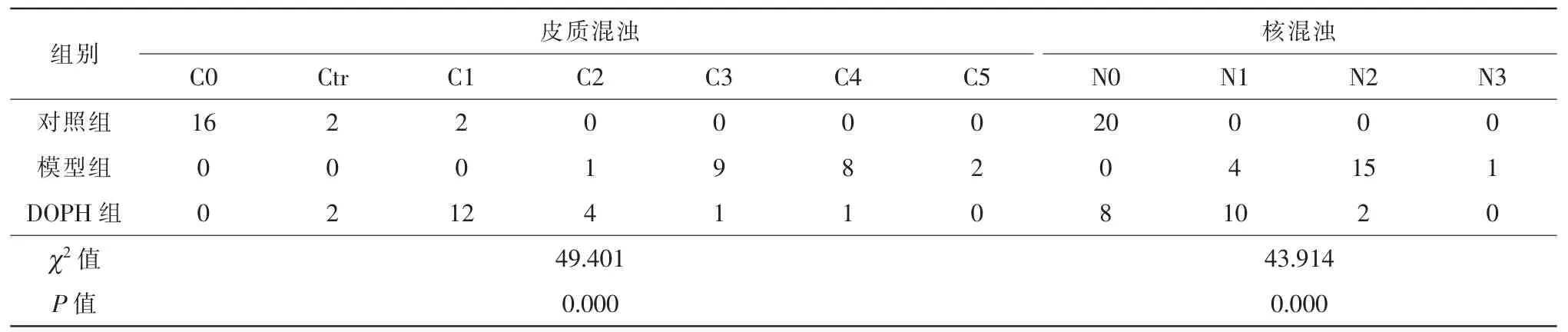
表2 DOP對糖尿病大鼠晶狀體混濁程度的影響(眼只數,n=20)

圖1 各組晶狀體在體裂隙燈顯微鏡下照片(×10)。1A對照組;1B模型組;1C DOPH組。DOPH鐵皮石斛多糖高劑量組
表3 DOP對糖尿病大鼠血清中氧化應激指標的影響(,n=10)
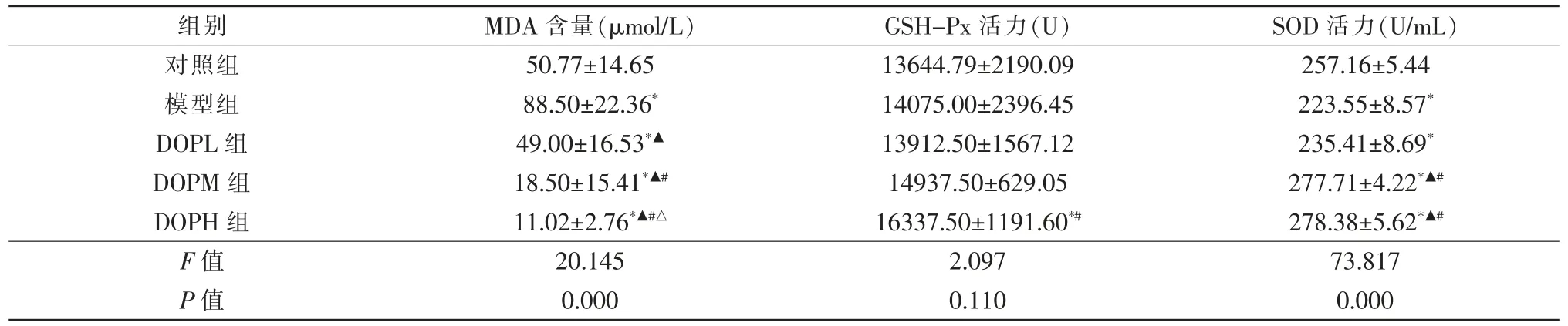
表3 DOP對糖尿病大鼠血清中氧化應激指標的影響(,n=10)
注:* 與對照組比較,P<0.05;▲與模型組比較,P<0.05;# 與DOPL組比較,P<0.05;△與DOPM組比較,P<0.05;MDA丙二醛;SOD超氧歧化物酶;GSH-Px谷胱甘肽過氧化物酶;DOPL鐵皮石斛多糖低劑量組;DOPM鐵皮石斛多糖中劑量組;DOPH鐵皮石斛多糖高劑量組
3 討論
糖尿病性白內障是糖尿病第二大眼部并發癥,因其高發病率和高致盲率,糖尿病性白內障成為越來越多的學者研究的熱點。目前,對于糖尿病性白內障的發病機制尚未完全明確,主要有多元醇滲透學說、氧化損傷學說和晶狀體蛋白非酶糖基化學說,其中氧化應激在糖尿病性白內障的發生發展過程中意義尤為重要。糖尿病性白內障的產生與高糖環境下機體內活性氧及其代謝產物、衍生的活性物質等增多,抗氧化酶相對不足,或氧化物與抗氧化物間的比例失調密切相關[8]。
糖尿病性白內障屬中醫學“消渴病圓翳內障”范疇,晶珠屬腎,肝藏血,腎藏精,肝血依賴腎精的滋養,腎精亦賴肝血才能化生。若肝腎不足,臟腑精血之氣不能上榮于目,導致晶珠失養,則易生內障,“因知肝腎無邪,則目決不病”,說明肝腎不足,陰精虧損是本病的主要病因。鐵皮石斛味甘微寒,歸胃、腎經,具有益胃生津、滋陰清熱等功效,主治熱病津傷、口干煩渴、胃陰不足、食少干嘔、病后虛熱不退、陰虛火旺、骨蒸勞熱等癥。DOP是鐵皮石斛主要成分之一,其現代藥理作用廣泛,如DOP能夠顯著提高糖尿病小鼠肝臟和胰腺的抗氧化能力,修復肝臟和胰腺氧化損傷,從而提高胰島素含量和緩解胰島素抵抗,具有降血糖的作用。同時,DOP也有改善糖尿病小鼠血脂代謝紊亂、改善腎臟損傷的作用;DOP可通過清除羥基自由基從而抑制其誘導的SH-SY5Y細胞凋亡;其還具有增強免疫、抗腫瘤等作用[6]。
本研究結果發現,STZ注射后的糖尿病性白內障模型組大鼠血清SOD活力較對照組下降,MDA含量較對照組升高,SOD是生物體內天然的超氧化物陰離子自由基()清除劑,它能使變為H2O2與O2,MDA是膜脂質過氧化最重要的產物之一,說明高糖可通過氧化損傷介導糖尿病性白內障的產生。而DOP作用后,SOD活力增強,MDA含量降低,說明DOP可能通過減輕晶狀體的氧化損傷從而防治糖尿病性白內障。這與既往學者的報道一致[9-10]。本研究結果還發現模型組GSH-Px雖然升高,但與對照組比較并無統計學意義,研究結果與其他學者[11-12]的STZ注射后的糖尿病大鼠的GSH-Px活力值升高不同,考慮可能因為GSH-Px值的影響因素較多,如體內硒類物質的蓄積、底物GSH的量等[13]。但從目前臨床上關于糖尿病患者紅細胞GSH-Px活力值報道也存在不一致,糖尿病患者GSH-Px可升高也可降低[14-15],具體原因尚需進一步實驗研究證實。本研究中在觀察DOP對糖尿病性白內障大鼠氧化應激相關的ERK信號通路活化中關鍵分子mRNA表達時發現,STZ誘導的糖尿病性白內障大鼠晶狀體組織中Ras、Raf、MEK、ERK1/2的基因表達水平均高于對照組。經不同濃度的DOP干預后,ERK1、ERK2和Raf的基因表達隨濃度升高而降低,這種變化規律與MDA和SOD的變化一致,且與黃亞琳等[16]的研究結果一致,說明DOP可能通過介導ERK/Raf信號通路減輕糖尿病大鼠晶狀體的氧化損傷。
表4 DOP對糖尿病大鼠晶狀體ERK1、ERK2、MEK、Raf、Ras的mRNA表達的影響(,n=3)

表4 DOP對糖尿病大鼠晶狀體ERK1、ERK2、MEK、Raf、Ras的mRNA表達的影響(,n=3)
注:* 與對照組比較,P<0.05;▲與模型組比較,P<0.05;# 與DOPL組比較,P<0.05;△與DOPM組比較,P<0.05;DOPL鐵皮石斛多糖低劑量組;DOPM鐵皮石斛多糖中劑量組;DOPH鐵皮石斛多糖高劑量組
綜上所述,DOP可通過降低糖尿病大鼠血清中MDA含量,提高血清中SOD的活力,增強其抗氧化能力,其中氧化應激介導的ERK/Raf信號通路可能是DOP延緩糖尿病性白內障的重要機制之一。

