檢測VKORC1、CYP2C9*3基因多態性指導急性肺血栓栓塞癥患者華法林抗凝治療的價值*
鄧文 周燕虹 劉丹 李為民 陳勃江
(四川大學華西醫院 1.呼吸與危重癥醫學科;2.實驗醫學科,四川 成都 610041)
急性肺血栓栓塞癥(Pulmonary thromboembolism, PTE)是臨床常見危急重癥[1],抗凝是非高危急性PTE治療的基石[2],其中華法林是最常用的抗凝藥物。華法林具有效果確切、價格低廉等優勢,但因與多種藥物或食物存在相互作用,且不同個體表現出不同代謝速度,劑量差異大,需定期監測凝血功能,尤其是國際標準化比值(International normalized ratio,INR)[3]。華法林的主要靶點是維生素K環氧化物還原酶復合物1(Vitamin K epoxide reductase complex 1, VKORC1)[4]。野生型VKORC1基因為AA型,突變型則包括GA 型和GG 型兩種類型。VKORC1基因多態性是影響華法林使用劑量的重要因素,且亞洲人群中VKORC1的突變比例高[5]。因此,臨床中有患者在接受華法林使用前進行VKORC1基因多態性檢測。華法林主要通過肝臟代謝,細胞色素P450酶2C9(Cytochrome P450 2C9,CYP2C9)基因所編碼的蛋白是介導其代謝的關鍵因子[6]。CYP2C9有多個突變位點,其中CYP2C9*3是最重要的亞型之一[7]。國家衛生計生委發布的《藥物代謝酶和藥物作用靶點基因檢測技術指南》明確指出:臨床應根據VKORC1和CYP2C9*3基因型為患者制定華法林抗凝治療方案,減少調整次數并快速達到目標劑量[8];但2018年發布的《肺血栓栓塞癥診治與預防指南》[9]不推薦常規進行藥物基因組檢測指導華法林的劑量選擇和調節。為探索臨床實踐中VKORC1、CYP2C9*3基因多態性檢測的意義,本研究回顧性分析VKORC1、CYP2C9*3基因多態性檢測在急性PTE患者接受華法林治療中的價值。
1 資料與方法
1.1 一般資料 回顧性收集2016年1月~2018年12月于四川大學華西醫院呼吸與危重癥醫學科住院接受華法林抗凝治療的411例成人PTE患者,其中119例自愿接受VKORC1和CYP2C9*3基因多態性檢測,并根據檢測結果確定華法林劑量為指導組;292例未接受VKORC1和CYP2C9*3檢測,醫生按臨床經驗使用、監測和調整華法林為對照組。納入標準:①按照2018年《肺血栓栓塞癥診治與預防指南》[9]標準,確診為急性PTE,且為非高危組。②接受華法林抗凝并達到穩定維持劑量。③臨床、隨訪資料齊全。④年齡≥18歲。排除標準:①同時使用維生素K、阿司匹林、胺碘酮、磺胺、甲硝唑、克拉霉素、環丙沙星、氟康唑、奧美拉唑、雌激素、利福平等可能影響華法林代謝的藥物。②合并有嚴重血常規、肝腎功能等重要臟器功能不全。③雖診斷急性PTE,但因活動性咯血、消化道出血、凝血功能異常等原因不能接受華法林治療者。④妊娠或哺乳期婦女。基于電子病歷系統收集兩組患者的性別、年齡、民族、吸煙、基礎疾病、華法林維持劑量信息;查閱指導組的VKORC1和CYP2C9*3基因多態性檢測結果。所有病例通過電話隨訪,詢問使用華法林后6個月內的死亡、大出血、新發血栓事件。相關定義:國際標準化比值(INR)達標:以INR 2-3視為達標。大出血:需要停止華法林使用的全身出血,一般INR≥4。新發血栓:除診斷PTE時所發現的血栓之外的血栓。指導組患者均知情同意行基因多態性檢測。本研究經過四川大學華西醫院醫學倫理委員會批準。
1.2 基因多態性檢測 在使用華法林前,抽取清晨空腹外周靜脈血4 mL,于EDTA抗凝管保存,立即送實驗醫學科檢測。首先加入紅細胞裂解液裂解紅細胞,獲得白細胞;再利用全血基因組提取試劑盒提取全血DNA,于-20 ℃保存,采用“人類 VKORC1 和 CYP2C9*3基因多態性檢測試劑盒(PCR-熒光探針法)進行基因多態性檢測;e-Hyb全自動雜交儀(BR-526-24)雜交顯色;生物芯片識讀儀(BE2.0)識別讀數[10]。
1.3 華法林初始劑量及調整 指導組第1~3 d的華法林初始劑量登陸網站www.WarfarinDosing.org進行計算,需納入CYP2C9*3和VKORCI 基因型及其他相關臨床資料參數。對照組第1~3 d則由臨床醫師根據經驗給藥,通常為每天2.5 mg。用藥第4 d查INR,并據此調整劑量。達到目標INR值(2-3)前,每3 d監測和調整一次,直至達標。
1.4 觀察指標 主要指標:從開始使用華法林到INR第一次達標(2-3)的時間(d)。次要指標:穩定時(INR 2-3)的華法林維持劑量(mg)。隨訪兩組患者自接受華法林抗凝開始到第6個月末時的不良反應,包括死亡、大出血、新發血栓。
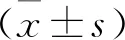
2 結果
2.1 兩組基本資料比較 兩組患者在性別、年齡、吸煙史、基礎疾病等方面均無顯著性差異(均P>0.05)。見表1。

表1 兩組患者基本資料比較[n(×10-2)]
2.2 主要與次要終點
2.2.1 主要終點 本研究的主要終點為從診斷PTE到INR第一次達標(2-3)的時間,指導組較對照組未顯示出統計學優勢(P=0.494)。對指導組進一步進行亞組分析,VKORC1和CYP2C9*3均以AA野生型多見;兩個位點均突變5例,占4.20%。從指導組達到INR目標值的時間看,不同VKORC1和CYP2C9*3基因型組合的INR達標時間差異無統計學意義(P=0.382)。見表2。

表2 從開始使用華法林到INR第一次達標(2- 3)的時間
2.2.2 次要終點 本研究的次要終點為穩定時華法林的維持劑量。指導組與對照組無顯著性差異(P=0.317)。不同VKORC1和CYP2C9*3基因型組合的劑量也相似,未顯示出統計學差異(P=0.177)。見表3。

表3 穩定時華法林的維持劑量
2.3 不良事件 在隨訪過程中,指導組有2例死亡(1.68%),均為惡性腫瘤患者,死于非華法林相關的全身多器官功能衰竭,且為VKORC1 AA型合并CYP2C9*3 AA型(野生型);對照組有9例死亡(3.08%),其中6例因惡性腫瘤全身廣泛轉移死亡,2例因腦卒中合并肺部嚴重感染死亡,1例慢性心功能不全死亡,也與華法林無直接關系。
指導組有6例(5.04%)出現大出血需要停用華法林,其中3例為肺癌合并明顯咯血(均為VKORC1 AA型合并CYP2C9*3 AA型,野生型),3例分別為肝癌、乳腺癌、腎病綜合征,新發黑便考慮消化道出血(2例為VKORC1AA型合并CYP2C9*3 AA型,1例VKORC1 AA型合并CYP2C9*3AC型)。6例在出血時查INR4.29~6.08,予停用華法林及維生素K拮抗,出血停止,INR下降至3以下,后期予低分子肝素抗凝。對照組12例(4.11%)出現大出血停用華法林,其中6例肺癌抗凝治療過程中咯血停華法林;4例為心功能不全;2例為骨折圍手術期手術部位滲血明顯。對照組12例出血病人的INR波動在4.16~5.92,均停華法林和維生素K拮抗,骨折患者術后1周再次啟動普通肝素抗凝,其余患者改低分子肝素抗凝。
在INR達標后、華法林維持治療期間,指導組有5例(4.20%)出現新發下肢深靜脈血栓,其中1例為結締組織疾病且VKORC1 GA型合并CYP2C9*3 AA型、2例為VKORC1 AA型合并CYP2C9*3 AA型(分別有淋巴瘤和慢性腎功能不全基礎疾病)、2例為VKORC1 AA型合并CYP2C9*3 AC型(均為結締組織疾病患者)。對照組有10例(3.42%)出現新發血栓,其中4例因惡性腫瘤行鎖骨下中心靜脈置管出現導管相關血栓,6例慢性心功能不全出現下肢深靜脈血管。
上述不良事件發生率,兩組比較差異均無統計學意義(均P>0.05),見表4。

表4 兩組不良事件發生率比較[ n(×10-2)]
3 討論
本研究為回顧性觀察性研究,以確診急性PTE且接受華法林抗凝治療的患者為研究對象,其中基因檢測指導組為指導組,常規治療組為對照組。以INR 2-3為達標,主要研究終點為從開始使用華法林到INR第一次達標的時間,次要研究終點為穩定時華法林的維持劑量,評估檢測VKORC1、CYP2C9*3基因多態性檢測指導急性PTE患者華法林抗凝治療的作用,探討藥物基因組檢測的臨床可行性。結果顯示,兩組的主要終點和次要終點均無顯著性差異,提示華法林基因檢測在急性PTE抗凝治療中的意義有限。但本研究為單中心、單病種的回顧性分析,可能還需要多中心、隨機對照、前瞻性干預實驗來進一步驗證。
華法林是非高危急性PTE抗凝治療的主要藥物,在新型口服抗凝藥問世前為一線用藥。但因代謝個體差異明顯、受食物及其它藥物影響大、治療濃度范圍窄,在達到穩定抗凝效果前,需要密切監測和調整。基因遺傳多態性是影響華法林給藥劑量的重要因素,VKORC1和CYP2C9所編碼的蛋白分別介導華法林與靶點的相互作用及華法林代謝而成為近年研究熱點。VKORC1的1639 G/A位于啟動子區,調控VKORC1的表達[11]。既往研究顯示,不同種族人群中VKORC1-1639 A/G 基因多態性各異[12]。本研究顯示,在119例基因檢測組中,AA型VKORC1為89例,占74.79%,與YAN等[13]報道結果基本一致。在突變型(n=30)中,GA型29例,僅1例為GG型,也符合既往研究的趨勢[14]。VKORC1蛋白是影響維生素K代謝的關鍵限速酶,一般認為,VKORC1突變型個體華法林代謝快,所需要的華法林劑量高于野生型[15]。本研究中,GA型VKORC1患者達到目標INR時穩定華法林劑量的平均值分別為5.72 mg(合并CYP2C9*3 AA型)、6.88 mg(合并CYP2C9*3 AC型),似乎高于VKORC1 AA型(5.42 mg、5.16 mg),與其它研究趨勢一致,但并未達到統計學差異。導致這種結果的原因可能與樣本量相對較小有關,尤其是突變組,僅30例(GA型29例,GG型1例)。
CYP2C9有CYP2C9*1、CYP2C9*2和CYP2C9*3三種突變類型,其中CYP2C9*1為野生型,而CYP2C9*2尚無在中國人群中檢出的報道。為此,現有針對中國人群CYP2C9基因多態性的研究多集中于CYP2C9*3。1075A→C是CYP2C9*3的突變主要類型,使華法林的代謝減慢,患者所需的華法林維持劑量減少[16]。本研究發現,CYP2C9*3野生型(AA)106例,占89.08%;僅13例(10.92%)發生突變,為AC型,突變頻率與之前的報道吻合[17]。在CYP2C9*3突變、但VKORC1未發生突變組,患者達到目標INR的華法林維持劑量為(5.16±0.55) mg,較CYP2C9*3野生型組確有所降低,但未達到統計學差異。王森等[18]近期發表的關于高齡非瓣膜性房顫患者接受華法林治療的研究,也得出了類似結果,CYP2C9突變組的華法林理論劑量低于野生型組,但實際用量并無差異。
如上所述,VKORC1突變,所需要的華法林劑量增高;而CYP2C9*3突變則使華法林的維持劑量降低。可見,在復雜的人體中,華法林代謝受到錯綜復雜的影響。有學者納入多變量進行多元線性回歸分析,發現CYP2C9在模型中的系數最高,為0.230;而VKORC1次之,為0.159,提示CYP2C9的基因多態性可解釋23.0%的華法林劑量差異,VKORC1則解釋15.9%的差異[18]。此外,性別、年齡、身體質量指數(BMI)、基礎肝腎功、吸煙、飲酒、飲食、聯合用藥等也是影響華法林代謝不可忽視的因素。本研究為陰性結果,未獲得VKORC1、CYP2C9*3基因多態性與華法林用藥之間的顯著相關性,或許正是因為影響華法林的因素眾多,基因多態性變異在本研究人群中未表現出明顯作用。
4 結論與啟示
VKORC1、CYP2C9*3基因多態性檢測在指導急性PTE患者接受華法林抗凝治療中的意義有限,與《肺血栓栓塞癥診治與預防指南》的推薦吻合,也與Kimmel SE等在美國所開展的多中心臨床研究類似;但和其他眾多陽性結果報道矛盾[6,16,17,19],也與國家衛生計生委所發布指南不一致。但本研究樣本量相對較小、僅為四川大學華西醫院單中心、急性PTE單一病種,代表性有限。若能聯合全國不同地域、不同級別醫療中心開展大樣本、多中心、前瞻性對照研究,可能有望得出更有說服力的結果。

