趨化因子誘導的T細胞對結直腸癌微環境的影響①
徐 輝 唐言華 劉繼武 王 亮(貴陽市第一人民醫院胃腸外科,貴陽550002)
結直腸癌(colorectal cancer,CRC)是胃腸道常見惡性腫瘤,隨人口老齡化及生活飲食習慣改變,其發病率與死亡率呈上升趨勢[1]。醫療技術進步使化療及靶向治療廣泛應用于CRC治療,但患者5年生存率僅為49%左右,研究認為與其侵襲及轉移無法被有效抑制相關[2-3]。近期研究報道,控制CRC侵襲與轉移需抑癌基因、癌基因及其基因產物等基因調控及免疫細胞、細胞因子等應答細胞亞群參與[4]。CRC大鼠體內研究發現,獲得性免疫細胞CD4+T細胞、CD8+T細胞、T輔助細胞1(Thelper cell 1,Th1)、Foxp3+調節性T細胞(regulatory T cells,Tregs)在CRC大鼠癌組織中呈高表達,且與腸道細胞損傷密切相關[5]。臨床研究指出,CRC患者腫瘤組織中可檢測到各種應答細胞亞群及趨化因子CXCL12、CCL20-CCR6、CX3CLI-CX3CR1和CX3CL1,提示趨化因子與應答細胞亞群進入癌組織相關[6]。進一步探討CRC形成機制發現,腸道共生細菌可刺激免疫細胞浸潤腸道固有層釋放促炎細胞因子形成應答細胞亞群,對腫瘤細胞生長起抑制作用,但其與趨化因子的關系尚未闡明。因此,本研究探討CRC組織中應答細胞亞群、趨化因子與腸道微環境間的關系,構建微環境觸發的CRC細胞系以明確腸道微生物群過表達對趨化因子及對CRC細胞免疫應答行為的影響。
1 資料與方法
1.1 資料
1.1.1 研究對象 收集2017年1月至2019年1月我院收治的41例CRC患者的癌組織及癌旁正常組織,男性28例,女性13例,年齡40~79歲,平均年齡(66.14±10.67)歲;高分化6例,中分化27例,低分化8例;Dukes分期A/B期29例,C/D期12例;無淋巴結轉移28例,有淋巴結轉移13例。入選標準:①符合《結直腸癌診療規范(2010年版)》診斷標準[7];②未接受放化療治療;③病例資料齊全;④入院前無重大出血病史;⑤肝、腎、心功能正常。排除標準:①合并其他惡性腫瘤;②治療耐受性差;③術前接受生物學治療或內分泌治療;④患者對本研究有異議;⑤近期使用過免疫調節劑或激素類藥物。本研究經醫學倫理會批準,所有患者及家屬知情同意。
1.1.2 實驗動物 雄性SPF級NSG小鼠24只,體重15.32~19.67 g,6~8周齡,購自北京醫療器械檢驗所,許可證號:SCXK(青)2018-0031。動物使用和處理符合《國家衛生研究院實驗動物保護法和使用指導》要求,經過醫學動物倫理委員會批準,審批號:20180209,于醫學院實驗動物研究中心[SYXK(青)2018-0411]完成實驗,室溫18~22℃、濕度45%~50%、12 h明/12 h暗交替,自由攝食攝水。
1.1.3 主要試劑 總RNA提取試劑盒(上海碩嘉生物);DNA提取試劑盒(邁瑞生物);反轉錄試劑盒(北京中生柏奧生物);miRNA-21引物(蘇州吉瑪基因);瓊脂糖(上海康潤生物);PCR反應液(北京索萊寶);DEPC水(四川康百瑞生物);Trizol溶液(北京百奧森泰生物);RT-PCR擴增試劑盒(Sigma);Trizol裂解液(北京百奧森泰生物技術有限公司);氨芐青霉素鈉/氨芐西林鈉(先泰藥業);鹽酸萬古霉素(浙江海正);BCA試劑盒(上海經科化學科技有限公司);CXCL12、CCL20-CCR6、CX3CLI-CX3CR1、CX3CL1單克隆抗體一抗(北京百奧萊博科技有限公司):GAPDH單克隆抗體一抗(廈門研科);山羊抗兔二抗(武漢賽維爾生物);ECL發光試劑盒(上海古朵)。
1.2 方法
1.2.1 體內實驗 NSG小鼠腹膜和腸內注射LS180細胞生成腫瘤異種移植物構建腸內腫瘤模型;從第10天開始,將1 g/L氨芐青霉素鈉/氨芐西林鈉和0.2 g/L鹽酸萬古霉素溶于飲用水中給藥,第29天,將攜帶腫瘤小鼠采用CFSE標記的CD4+和CD8+T細胞過繼轉移,從主要CRC樣品中分離并于體外擴增(5×106個/只),2 d后采用流式細胞術在消化腫瘤的細胞懸浮液中評估轉移T細胞群頻率。
1.2.2 RT-PCR 采用總RNA提取試劑盒提取CRC和癌旁正常組織中總RNA,RNA中基因組DNA消除并除去DNase1后,采用反轉錄試劑盒逆轉錄為cDNA,以cDNA為模板進行PCR擴增,擴增體系為:SYBR Green Mix 10μl,上游引物5 mol,下游引物5 mol,cDNA模板1μl,ddH2O ddH2O 8μl,總體積20μl;反應條件:95℃預變性3 min,95℃變性5 s,56℃退火10 s,72℃延伸25 s,39次循環。擴增產物經1.5%瓊脂糖凝膠電泳,凝膠成像系統掃描分析,測定各擴增帶吸光度,以目的基因與β-actin吸光度比值計算CD4+、CD8+、Th1、Foxp3+表達。
1.2.3 Western blot 取CRC和癌旁正常組織細胞,裂解,勻漿,離心,提取蛋白,BCA試劑盒進行蛋白定量,取總蛋白上樣,電泳,切膠,濕轉,TBS-T封閉,加入CXCL12、CCL20-CCR6、CX3CLI-CX3CR1、CX3CL1單克隆抗體一抗(1:300)、GAPDH單克隆抗體一抗(1:1 000),4℃孵育過夜,洗膜,加入山羊抗兔二抗,37℃孵育60 min,洗膜,ECL發光試劑盒顯色,洗片,顯影、定影,以GAPDH為內參,成像掃描分析系統測定內參和目的條帶灰度值。
1.2.4 腸道菌群檢測 取濕重糞便樣品反復離心,去除雜質,洗滌獲取菌體,L棒均勻涂抹于不同培養基,采用細菌基因組DNA提取試劑盒提取細菌總DNA,引物根據目標細菌16SrRNA設計;糞便細菌DNA樣品與標準品(1:10稀釋)同時進行RT-PCR反應,每次反應條件及反應體系相同,反應結束后采用溶解曲線分析PCR產物特異性,每g糞便樣品待測細菌基因的拷貝數采用標準曲線及Ct值,通過菌落形態、格蘭染色鏡檢、生化反應等鑒定菌落數作為定量結果。
1.3 統計學分析 采用SPSS22.0軟件進行統計學分析,基因表達水平比較采用Wilcoxon符號秩檢驗;根據公式(Spearmanr值×對應趨化因子受體陽性細胞百分比)計算T細胞標志物顯著相關趨化因子得分;USEARCH軟件(V.8.1.1861)分析序列;DESeq2軟件(V.1.12.4)進行標準化豐度計數的操作分類單位差異分析;Microsynth AG進行基因庫、測序和數據分析。P<0.05表示差異有統計學意義。
2 結果
2.1 T細胞群表達比較 本研究在62個CRC和相應無腫瘤結腸組織中分析了編碼免疫細胞標志物的基因表達,包括總T細胞(CD3)、T輔助細胞(CD4)、細胞毒性T淋巴細胞(CTL)(CD8)、Th1(Tbet和IRF-1)、Th2(IL-4、IL-5和IL-13)、Th17(IL-17)、Tfh(CXCR5)及Tregs(Foxp3+),結果發現CD8+、Th1、Foxp3+T細胞標志物均有表達,IL-4、IL-5在所有樣品中均未檢測到表達(數據未顯示),其余僅在少數樣品中表達,表明CRC中Th1、Th2、Tfh細胞的CRC浸潤微弱。CD4+、CD8+、Th1、Foxp3+在CRC組織中均有表達;CRC組織中CD4+表達低于癌旁正常組織(P<0.05),CD8+、Th1、Foxp3+表達高于癌旁正常組織(P<0.05),見表1。
2.2 趨化因子表達比較 CXCL12、CCL20-CCR6、CX3CLI-CX3CR1、CX3CL1在CRC組織中均有表達;CRC組織CXCL12表達低于癌旁正常組織(P<0.05),CCL20-CCR6、CX3CLI-CX3CR1、CX3CL1表達高于與癌旁正常組織(P<0.05),見表2。
2.3 T細胞群與趨化因子過表達相關性分析 CD4+、CD8+、Th1、Foxp3+與CXCL12、CCL20-CCR6、CX3CLICX3CR1、CX3CL1均呈顯著正相關(P<0.05),見表3。無監督層次分析中,樣本聚集于3個主要組:第1組特征為多數T細胞標志物過度表達(簇高),第2組顯示異質表達(簇中),第3組特征為所有T細胞標記基因表達下調(簇低),見圖1。
2.4 趨化因子與T細胞亞群CRC浸潤的關系 CD4+相關趨化因子特征主要包括CXCL12、CCL20-CCR6、CX3CLI-CX3CR1,CD8+相關趨化因子特征主要包括CXCL12、CX3CLI-CX3CR1、CX3CL,Th1相關趨化因子特征主要包括CX3CLI-CX3CR1、CX3CL,Foxp3+相關趨化因子特征主要包括CXCL12、CCL20-CCR6(圖2)。
表1 T細胞群表達比較(±s,n=41,%)Tab.1 Comparison of T cell subgroups expressions(±s,n=41,%)

表1 T細胞群表達比較(±s,n=41,%)Tab.1 Comparison of T cell subgroups expressions(±s,n=41,%)
Groups CRCtissue Adjacent tissue t P CD4+0.22±0.08 2.69±0.63 24.904<0.001 CD8+4.11±1.33 0.48±0.30 17.048<0.001 Th1 6.77±2.03 3.02±0.59 11.358<0.001 Foxp3+4.32±1.26 0.69±0.05 18.433<0.001
表2 趨化因子表達比較(±s,n=41)Tab.2 Comparison of chemokineexpressions(±s,n=41)

表2 趨化因子表達比較(±s,n=41)Tab.2 Comparison of chemokineexpressions(±s,n=41)
Groups CRCtissue Adjacent tissue t P CXCL12 0.16±0.05 3.67±1.10 20.411<0.001 CCL20-CCR6 4.53±1.20 2.02±0.64 11.818<0.001 CX3CLI-CX 3CR1 2.69±0.54 0.23±0.09 28.773<0.001 CX3CL1 4.77±1.32 3.35±1.01 5.471<0.001

表3 T細胞群與趨化因子過表達相關性分析Tab.3 Correlation analysis between T cell subsets and chemokine overexpression

圖1 無監督層次聚類圖Fig.1 Unsupervised hierarchical clustering image
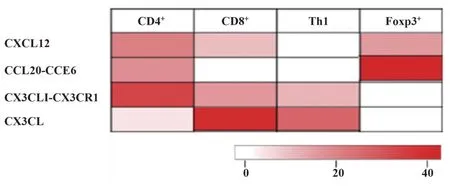
圖2 趨化因子與T細胞亞群CRC浸潤的關系Fig.2 Relationship between chemokines and infiltration of CRC in T cell subsets
2.5 T細胞匯聚趨化因子圖 體內培養CRC細胞中趨化因子均呈高表達,體內CRC組織中CRCCXCL12、CCL20-CCR6、CX3CLI-CX3CR1、CX3CL表達高于體外CRC組織中基因表達水平(P<0.05),見圖3。
2.6 腸道微生物群對CRC細胞趨化因子表達的影響 本研究假設腫瘤細胞中趨化因子的產生可能由腸道菌群衍生微生物刺激引發,采用T細胞激動劑刺激正常細胞系和CRC細胞系誘導其趨化因子基因重新表達,結果發現,激動劑刺激CRC細胞系后 趨 化 因 子CXCL12、CCL20-CCR6、CX3CLICX3CR1、CX3CL與腸道微生物群各因子可同時表達,且趨化因子表達水平與腸道微生物群因子相關,見圖4。
2.7 腸道微生物群與T細胞浸潤的關系 體內腫瘤T細胞群遷移率高于體外腫瘤(P<0.05),見圖5。
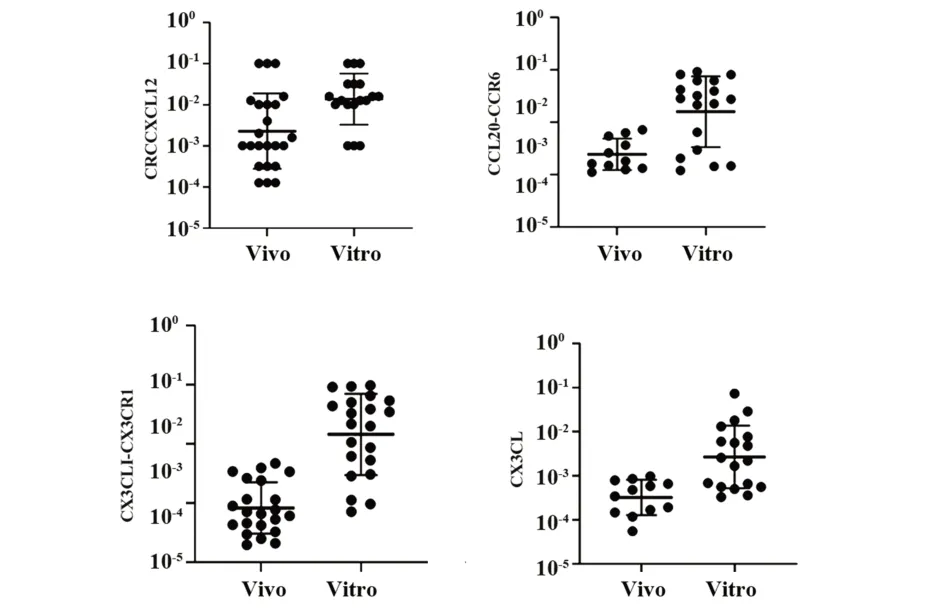
圖3 T細胞募集趨化因子圖Fig.3 Imagesof chemokines recruited by T cells

圖4 腸道微生物群對CRC細胞趨化因子表達的影響Fig.4 Effect of intestinal microflora on expressions of che?mokines in CRC cells

圖5 腸道微生物群與T細胞浸潤的關系Fig.5 Relationship between intestinal microflora and T cell infiltration
3 討論
作為常見消化道惡性腫瘤,CRC發病率與病死率均顯著上升[8]。REX等[9]回顧性分析顯示,CRC患者中位無進展生存期為89.0個月,中位總生存期為129.0個月,與歐美國家相比總生存期延長。但腫瘤侵襲與轉移為多步驟、多因素、多階段的復雜過程,CRC細胞脫落后沿組織間隙侵襲蔓延至淋巴管,在淋巴循環中轉運、滯留、擴散并增殖,單個或幾個CRC細胞發展為微轉移灶,導致CRC患者短期生存率逐年下降。TIAN等[10]認為抑制CRC發生、侵襲及轉移應關注其內環境及細胞因子水平變化。
研究證實,趨化因子是維持腸道正常菌群的必需因子,與患者生存改善相關[11];多個研究結果顯示,C類因子在多種惡性腫瘤發生、進展中發揮重要作用[12-13];趨化因子為腫瘤相關因子,C類因子是由效應細胞分泌的具有生物活性的小分子蛋白,CXCL蛋白為cl-2原癌基因編碼產物,是促細胞存活因子,通過組織細胞色素c從線粒體釋放至細胞質抑制細胞凋亡[14]。cl-2為細胞凋亡重要通路,研究表明,cl-2抑制劑已成為CRC治療的新型藥物[15]。CCL-CCR是一種能使細胞無限增殖并促進細胞分裂的基因,與多種腫瘤發生發展密切相關。HAN等[16]研究發現,CCL20-CCR6因子在肺癌患者中高表達,并與TNM分期、組織學分級、淋巴結轉移及術后復發密切相關,其過度表達的患者術后復發轉移風險明顯升高。QIAN等[17]研究發現,結直腸腺癌患者體內CX3類蛋白呈低表達,參與癌癥發生發展過程,主要機制為降解細胞內蛋白導致其死亡。SHIBUTANI等[18]采用免疫組化方法分析CRC細胞體內外細胞因子發現,體內細胞因子水平更高,考慮細胞因子參與癌細胞免疫機制、可抑制細胞生長誘導細胞凋亡。CRC細胞在生長過程中快速增殖,代謝異常,機體供血不足導致CRC細胞耗氧量增加發生病理性缺氧,而病理性缺氧可刺激CD4+T細胞、CD8+T細胞、Th1細胞表達上調,從而調節微環境生成以緩解病理性缺氧[19]。提示趨化因子通過募集特定T細胞群共同作用于癌組織發揮作用。
本研究選取CRC組織和癌旁正常組織進行檢測,通過分析趨化因子、T細胞亞群表達水平及其與腸道微生物群關系闡明其可促進T細胞亞群激活CRC細胞浸潤。關于CRC微環境觸發因素的報道較少,但對糞便樣本進行腸道微生物群分析可將CRC或癌前息肉檢出率提高5倍,說明腸道微生物群是CRC的作用機制[20]。腸道微生物群可控制人體對癌癥治療藥物的反應[21]。腫瘤可破壞腸道黏液層,腸道細菌進入循環系統,部分可募集至淋巴結的細菌可促進趨化因子生成,促進免疫細胞形成并攻擊癌細胞[22]。本研究顯示,CRC組織T細胞標志物和趨化因子表達水平高于癌旁正常組織,提示T細胞亞群和趨化因子在CRC檢測中的特異性,與既往研究結果相似。本研究通過受體譜間相關性分析確定CRC組織中顯著趨化因子特征及與免疫細胞群水平,在2個蛋白相對表達的隊列中可見,CCL、CXCR配體與CD4+T細胞、CD8+T細胞、Th1、Foxp3+、Tregs可同時表達,說明趨化因子與T細胞亞群浸潤相平行。CCL、CXCR配體表達與CD4+T細胞、CD8+T細胞、Th1、Foxp3+、Tregs顯著相關,提示趨化因子與T細胞亞群受某種因素影響募集,對CRC發生發展具有重要意義。細胞亞群因子間表達特征相似,且T細胞因子與Tregs、Th1顯示趨化因子受體譜相似,提示CRC組織中T細胞與趨化因子具有相同募集,進一步驗證其相關性。而趨化因子吸引有益T細胞群,共同抑制癌細胞增殖和分化,有助于CRC預后改善。本研究證實了T細胞群和趨化因子表達的相關性及其對療效改善具有重要價值;但受前瞻性分析的限制,未對預后進行評估。為研討T細胞募集趨化因子的細胞來源,腫瘤細胞對趨化因子的表達研究發現,從體內和體外分離的CRC細胞并對其沉默RNA進行分析,發現體內培養的CRC原代細胞顯示出更高的趨化因子基因表達水平。體內細胞因子表達主要受內環境影響;湯鈺琪等[23]在小樣本實驗中證實,腸道腫瘤細胞中,微環境刺激對調節趨化因子表達作用更強。腸道微環境與趨化因子有一定相關性,可能促進其表達上調。既往研究表明,腫瘤上皮細胞中轉移的腸道共生細菌可能與腫瘤細胞相互作用并誘導腫瘤生成,也可釋放促腫瘤生成細胞因子[24]。T細胞群在促腫瘤生成中起重要作用,本研究也證明腸道細菌可使更多T細胞募集至腫瘤異種移植物中,可能與腸道共生細菌可控制有益免疫細胞腫瘤浸潤有關。體外實驗結果顯示,不同種類CRC相關細菌均可在不同程度促進T細胞募集趨化因子基因表達,進一步說明腸道微環境與T細胞群、趨化因子的相關性。于鑫等[25]研究顯示,趨化因子誘導的T細胞主要通過影響腸癌微環境相關因子分泌而導致腸道失衡,本研究體外實驗可證實該觀點。本研究假設腫瘤細胞中趨化因子產生可能由腸道菌群衍生微生物刺激引發,T細胞激動劑刺激正常細胞系和CRC細胞系,誘導其趨化因子基因重新表達,發現激動劑刺激CRC細胞系后趨化因子CXCL12、CCL20-CCR6、CX3CLICX3CR1、CX3CL與腸道微生物群各因子可同時表達,且趨化因子表達水平與腸道微生物群因子具有一定相關性,證實趨化因子誘導的T細胞對腸癌微環境的影響機制為T細胞誘導的結果。綜合本研究結果,考慮可重點關注CRC患者腸道微環境,根據既往研究可采用相關生物制劑或益生菌改善腸道微生態紊亂。另CRC組織中趨化因子表達水平可輔助判斷CRC患者腸道微生態變化。
綜上,微生物群可觸發CRC趨化因子產生,募集T細胞而改善預后,為臨床研究提供依據。但本研究受時間限制,收集病例數有限,有待擴大樣本數進一步研究。