姜黃素對子宮內膜異位癥大鼠PI3K/AKT/GSK‐3β通路及肥大細胞活化的影響
曹立花 李麗娟 胡曉丹 張曉鈿(海口市中醫醫院婦產科,海口 570100)
子宮內膜異位癥(endometriosis,EM)是一種發生在育齡婦女之間常見的慢性炎癥疾病,給個人和社會帶來沉重的經濟負擔[1‐2]。目前,手術是EM治療的常規方法,但必須權衡手術復發風險和卵巢儲備的潛在減少,給EM的手術治療帶來困難,因此開發新藥對改善臨床EM治療至關重要[3]。與EM相關的異常免疫細胞包括巨噬細胞、中性粒細胞和肥大細胞等,其中肥大細胞活化能夠釋放炎癥因子,導致疼痛發生[4]。姜黃素(curcumin)是姜黃傳統藥物的一種多酚成分,具有抗氧化、抗炎和抗癌活性,能夠改善腦功能、控制肥胖癥和糖尿病,還可用作香料和食用色素[5]。JELODAR等[6]研究證實,姜黃素可以預防大鼠EM異位灶組織生長。磷脂酰肌醇3‐激酶(phosphatidylinositol 3‐kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK‐3β)信號通路的減弱與肥大細胞活化較少密切相關,但姜黃素對EM的治療作用及其機制是否與PI3K/AKT/GSK3β途徑相關尚不明確[7]。本研究通過建立EM模型,研究姜黃素對EM大鼠的治療效果及其對PI3K/AKT/GSK3β通路相關蛋白表達的影響,以期為揭示姜黃素的治療機制提供理論依據。
1 材料與方法
1.1 材料
1.1.1 實驗動物SPF級SD大鼠70只,雌性未孕,6周齡,體重(200±10)g,購自河南省實驗動物中心,生產許可證號:SCXK(豫)2017‐0001。實驗經本院動物倫理委員會批準,并遵守3R保護原則。
1.1.2 藥品與試劑姜黃素(MF‐008974)購自信陽市沐凡生物科技有限公司;蘇木素伊紅(HE)染色試劑盒(G1120)、大鼠TNF‐α(SEKR‐0009)、IL‐6(SEKR‐0005)和IL‐1β(SEKR‐0002)ELISA試劑盒購自北京Solarbio公司;PI3K(PA5‐86800)、p‐AKT(PA5‐104866)和β‐肌動蛋白(β‐actin)(PA1‐183)兔抗大鼠多克隆抗體、AKT兔抗大鼠單克隆抗體(MA5‐14916)、山羊抗兔lgG(H+L)(A32731)和山羊抗小鼠IgG(H+L)(A32723)二級抗體購自美國Thermo Fisher Scientific公司;GSK‐3β(ab185141)和p‐GSK‐3β(ab68476)兔抗大鼠單克隆抗體和購自英國Ab-cam公司。
1.1.3 主要儀器MA100N型倒置顯微鏡由日本Nikon生產;Gel DocTMXR+型凝膠成像儀由美國Bio-Rad公司生產。
1.2 方法
1.2.1 動物模型制備參照文獻[8]方法,將大鼠禁食24 h后,腹腔注射3%戊巴比妥鈉麻醉,剖開大鼠腹部,分離右側子宮與周圍組織,結扎兩端子宮血管后,分離子宮內膜,修剪為5 mm×5 mm的子宮內膜碎片,內膜向里移植入大鼠左側腹部腹壁后,縫合大鼠腹部。術后連續5 d向上述各組大鼠腹腔注射容量為4 000 U/只的硫酸慶大霉素注射液,術后次日開始給予大鼠0.1 mg/kg的雌二醇(1%羧甲基纖維素納溶液溶解)灌胃處理,1次/4 d,共灌胃3次,在末次灌胃雌二醇后第4天麻醉大鼠,觀察異位內膜形成透明囊狀,內有積液和表面血管生成,則造模成功。假手術組進行右側子宮截取,但不進行左側異位內膜移植處理,術后次日給予等量1%羧甲基纖維素納溶液,其余參照上述造模方法進行。
1.2.2 分組及藥物處理造模成功大鼠為56只,隨機分為模型組(11只,給予等量蒸餾水灌胃)、姜黃素低(11只)、中(11只)、高(12只)劑量組(分別給予60、120和240 mg/kg姜黃素灌胃)、陽性對照組(11只,給予125 mg/kg孕三烯酮灌胃),灌胃1次/d,連續21 d。21 d假手術組(10只,給予等量蒸餾水連續灌胃)[9]。
1.2.3 樣品采集末次給藥12 h后,戊巴比妥鈉麻醉各組大鼠,脫頸處死,剖腹,觀察大鼠異位灶個數,參考文獻[10]方法,評價盆腔黏連情況,計算異灶面積。分別剪取假手術組正常子宮內膜組織和各實驗組異位子宮內膜異位灶組織,部分經脫水、石蠟包埋后制成切片,用于后續實驗;其余部分組織分別用PBS清洗后,-80℃保存備用。
1.2.4 HE染色實驗取1.2.3各組大鼠切片,經HE染色后,顯微鏡下觀察異位灶組織病理學變化。
1.2.5 甲苯胺藍染色實驗按照試劑盒說明書步驟,對1.2.3各組大鼠組織切片染色后,隨機選取5個視野,計每平方毫米肥大細胞個數,取均值。將形態規則、邊界清晰的肥大細胞定義為未脫落肥大細胞,周圍可見明顯顆粒的肥大細胞定義為脫落顆粒肥大細胞。
1.2.6 炎癥因子ⅠL‐1β、ⅠL‐6和TNF‐α檢測將1.2.3中-80℃保存的組織制備勻漿液,按照ELISA試劑盒說明書步驟檢測異位灶組織中IL‐1β、IL‐6和TNF‐α水平。
1.2.7 蛋白免疫印跡分析實驗將1.2.3中-80℃保存的組織勻漿后,加入RIPA提取各組總蛋白并測量蛋白含量。經電泳、轉膜、封閉、清洗后,依次加入PI3K、AKT、p‐AKT、GSK3β、p‐GSK3β和β‐actin一抗(1∶1 000)孵育過夜后,添加二抗(1∶5 000)繼續孵育2 h,曝光顯影,分析蛋白表達水平。
1.3 統計學分析采用SPSS25.0軟件進行統計學分析,計量數據均采用±s表示,多組間比較行單因素方差分析,進一步比較采用SNK-q檢驗。P<0.05表示差異有統計學意義。
2 結果
2.1 各組大鼠內異灶和盆腔黏連情況除假手術組外,其余各組內異灶個數差異無統計學意義;假手術組無內異灶,與假手術組相比,模型組EM大鼠內異灶面積和盆腔黏連評分均顯著升高(P<0.05);與模型組相比,姜黃素低、中、高劑量組EM大鼠內異灶面積和盆腔黏連評分依次降低(P<0.05),陽性對照組大鼠上述指標均顯著降低(P<0.05),見表1。
2.2 異位內膜組織病理學觀察如圖1所示,假手術組大鼠子宮內膜完整,上皮細胞柱狀排列整齊,腺體自然;模型組大鼠異位內膜組織生長狀態良好,腺體上皮細胞和基質細胞均正常;姜黃素低、中、高劑量組大鼠異位子宮內膜上皮細胞形狀逐漸變為地單層柱狀,腺體和基質細胞數量逐漸減少,并出現空化現象;陽性對照組上述現象介于姜黃素中劑量組和高劑量組之間。

圖1 各組大鼠子宮內膜異位灶組織HE染色圖片(×200)Fig.1 HE staining pictures of endometriosis tissue in each group(×200)
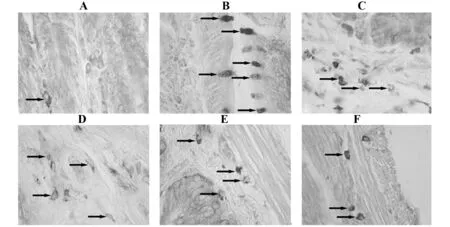
圖2 各組大鼠異位灶組織肥大細胞浸潤情況Fig.2 Mast cell infiltration of heterotopic foci in each group
表1 各組大鼠EM內異灶解剖觀察結果(±s)Tab.1 Anatomical observation results of EM in rats of each group(±s)
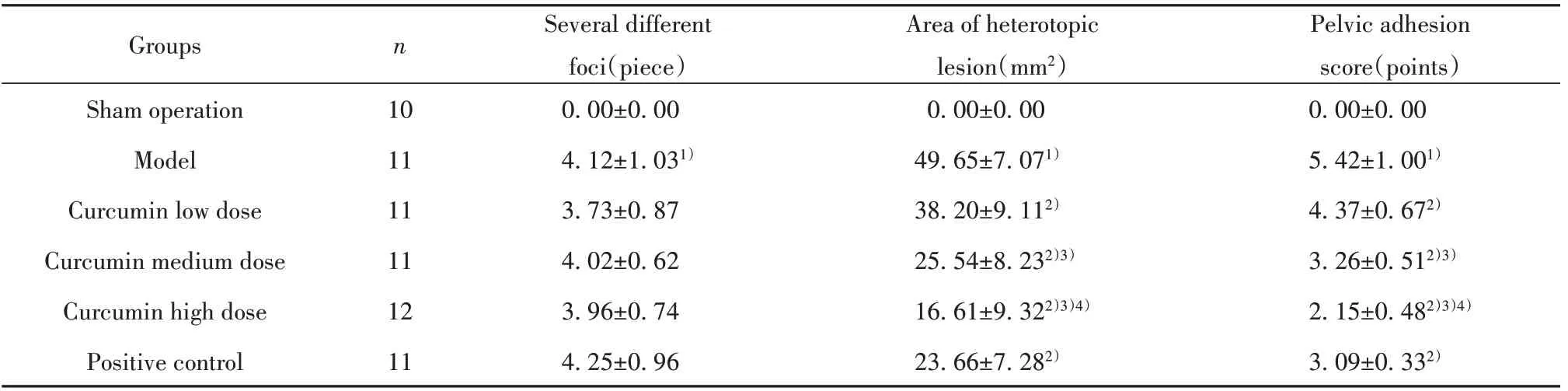
表1 各組大鼠EM內異灶解剖觀察結果(±s)Tab.1 Anatomical observation results of EM in rats of each group(±s)
Note:1)P<0.05 vs Sham operation group;2)P<0.05 vs Model group;3)P<0.05 vs Curcumin low dose group;4)P<0.05 vs Curcumin medium dose group.
Pelvic adhesion score(points)0.00±0.00 5.42±1.001)4.37±0.672)3.26±0.512)3)2.15±0.482)3)4)3.09±0.332)Groups Sham operation Model Curcumin low dose Curcumin medium dose Curcumin high dose Positive control n 10 11 11 11 12 11 Several different foci(piece)0.00±0.00 4.12±1.031)3.73±0.87 4.02±0.62 3.96±0.74 4.25±0.96 Area of heterotopic lesion(mm2)0.00±0.00 49.65±7.071)38.20±9.112)25.54±8.232)3)16.61±9.322)3)4)23.66±7.282)
2.3 姜黃素對EM大鼠異位灶組織肥大細胞數量和活化的影響如圖2所示,假手術組異位灶組織肥大細胞及脫顆粒肥大細胞數較少,模型組大鼠肥大細胞數和脫顆粒肥大細胞數明顯增加,而姜黃素低、中和高劑量組大鼠異位灶組織肥大細胞數目無明顯差異,脫顆粒肥大細胞相對數量呈減少趨勢;陽性對照組的脫顆粒肥大細胞相對數量介于姜黃素中高劑量組之間。與假手術組相比,模型組大鼠異位灶組織肥大細胞總數、脫顆粒肥大細胞數和脫顆粒肥大細胞與肥大細胞總數比值均顯著升高(P<0.05);與模型組相比,姜黃素低、中、高劑量組大鼠異位灶組織脫顆粒肥大細胞數和脫顆粒肥大細胞與肥大細胞總數比值依次降低(P<0.05),見表2。
2.4 姜黃素治療對各組大鼠異位灶部位炎癥因子表達影響與假手術組相比,模型組EM大鼠異位灶 組 織TNF‐α、IL‐1β和IL‐6表 達顯 著 增加(P<0.05);與模型組相比,姜黃素低、中、高劑量組EM大鼠異位灶組織TNF‐α、IL‐1β和IL‐6表達依次減少(P<0.05),陽性對照組上述指標顯著降低(P<0.05),見表3。
2.5 姜黃素治療對各組大鼠異位灶組織PⅠ3K、AKT和GSK‐3β蛋白表達的影響與假手術組相比,模型組EM大鼠異位灶組織PI3K、p‐AKT和p‐GSK‐3β蛋白表達顯著升高(P<0.05);與模型組相比,姜黃素低、中、高劑量組EM大鼠異位灶組織PI3K、p‐AKT和p‐GSK‐3β蛋白表達依次降低(P<0.05),陽性對照組上述指標顯著降低(P<0.05),見表4、圖3。
表2 各組大鼠異位灶組織中肥大細胞及脫顆粒肥大細胞數比較(±s)Tab.2 Comparison of mast cells and degranulated mast cells in ectopic foci of rats in each group(±s)

表2 各組大鼠異位灶組織中肥大細胞及脫顆粒肥大細胞數比較(±s)Tab.2 Comparison of mast cells and degranulated mast cells in ectopic foci of rats in each group(±s)
Note:1)P<0.05 vs Sham operation group;2)P<0.05 vs Model group;3)P<0.05 vs Curcumin low dose group;4)P<0.05 vs Curcumin medium dose group.
Degranulated mast cells/total mast cells 0.21±0.06 0.46±0.051)0.37±0.022)0.25±0.032)3)0.17±0.022)3)4)0.21±0.032)Groups Sham operation Model Curcumin low dose Curcumin medium dose Curcumin high dose Positive control n 10 11 11 11 12 11 Total number of mast cells(piece)1.46±0.47 4.13±1.531)3.24±0.51 3.11±0.96 3.96±1.03 4.07±0.88 Number of degranulated mast cells(piece)0.26±0.13 1.69±0.231)0.98±0.262)0.58±0.112)3)0.25±0.132)3)4)0.39±0.092)
表3 各組大鼠異位灶組織TNF‐α、IL‐1β及IL‐6表達情況(±s,pg/ml)Tab.3 Expressions of TNF‐α,IL‐1β and IL‐6 in ectopic foci of rats in each group(±s,pg/ml)

表3 各組大鼠異位灶組織TNF‐α、IL‐1β及IL‐6表達情況(±s,pg/ml)Tab.3 Expressions of TNF‐α,IL‐1β and IL‐6 in ectopic foci of rats in each group(±s,pg/ml)
Note:1)P<0.05 vs Sham operation group;2)P<0.05 vs Model group;3)P<0.05 vs Curcumin low dose group;4)P<0.05 vs Curcumin medium dose group.
IL‐6 73.49±8.35 135.61±9.921)117.32±7.232)70.58±8.522)3)43.83±9.542)3)4)51.95±8.851)Groups Sham operation Model Curcumin low dose Curcumin medium dose Curcumin high dose Positive control n 10 11 11 11 12 11 TNF‐α 31.14±6.32 98.78±10.431)70.36±9.182)52.52±10.022)3)12.39±3.222)3)4)29.64±5.131)IL‐1β 0.67±0.09 2.44±0.121)2.05±0.082)0.99±0.082)3)0.37±0.132)3)4)0.59±0.101)
表4 各組大鼠異位灶組織中PI3K、AKT和GSK‐3β蛋白表達比較(±s)Tab.4 Comparison of PI3K,Akt and GSK‐3 β protein expression in ectopic foci of rats in each group(±s)

表4 各組大鼠異位灶組織中PI3K、AKT和GSK‐3β蛋白表達比較(±s)Tab.4 Comparison of PI3K,Akt and GSK‐3 β protein expression in ectopic foci of rats in each group(±s)
Note:1)P<0.05 vs Sham operation group;2)P<0.05 vs Model group;3)P<0.05 vs Curcumin low dose group;4)P<0.05 vs Curcumin medium dose group.
p‐GSK‐3β/GSK‐3β 0.29±0.03 0.83±0.061)0.61±0.022)0.36±0.062)3)0.10±0.022)3)4)0.23±0.032)Groups Sham operation Model Curcumin low dose Curcumin medium dose Curcumin high dose Positive control n 10 11 11 11 12 11 PI3K/β‐actin 0.16±0.03 1.26±0.031)0.98±0.042)0.57±0.062)3)0.21±0.022)3)4)0.34±0.042)p‐AKT/AKT 0.32±0.04 1.18±0.021)0.99±0.072)0.65±0.042)3)0.13±0.032)3)4)0.22±0.022)
3 討論
通過外科手術將子宮組織移植到腹壁和腸系膜是常見的建立小鼠或大鼠的實驗性異位癥子宮內膜模型的方法,該模型的廣泛應用對EM的發病及治療機制的研究具有重要意義[10‐11]。研究發現,EM大鼠的惡化程度與內異灶體積大小及盆腔黏連變化密切相關[12‐13]。本研究結果顯示,模型組大鼠內異灶個數、內異灶體積和盆腔黏連相較于假手術組均顯著升高,提示EM造模成功。此外,模型組大鼠異位內膜組織生長狀態良好,腺體上皮細胞和基質細胞均正常,表明EM病灶組織生長未得到有效控制。給予EM大鼠不同劑量的姜黃素治療后,各組大鼠內異灶體積和盆腔黏連均相應減少,表明姜黃素對EM具有治療作用,與既往研究結果一致[6]。
肥大細胞在炎癥性疾病中至關重要,研究表明,肥大細胞脫顆粒可以釋放炎癥因子促進EM病理性疼痛持續發生,且EM病變中的肥大細胞和活化數明顯增加[14]。病理水平上EM會導致炎癥因子表達增加,而改善炎癥水平能夠阻止異位灶組織生長[15]。本研究結果顯示,與假手術組相比,模型組EM大鼠異位灶組織肥大細胞數、肥大細胞總數、脫顆粒肥大細胞數和脫顆粒肥大細胞與肥大細胞總數比值、炎癥因子TNF‐α、IL‐1β和IL‐6表達顯著增加,提示EM大鼠異位灶組織肥大細胞及其活化狀態升高,處于炎癥反應狀態。給予姜黃素治療后,各組異位灶組織肥大細胞脫顆粒占比和上述炎癥因子表達顯著降低,提示姜黃素可抑制EM大鼠異位灶組織肥大細胞活化,可能與降低炎癥反應相關。另有研究證實,姜黃素能夠通過減輕炎癥反應對高果糖飲食誘導的代謝綜合征大鼠和中腦動脈阻塞大鼠產生治療作用,因此推測姜黃素可能是EM治療的潛在有效藥物,這可能與降低肥大細胞活化,抑制炎癥反應相關[16‐17]。
PI3K是細胞信號通路的重要調節劑,LIN等[18]研究發現,抑制PI3K及其下游激酶AKT表達能夠抑制肥大細胞活化。徐南輝等[19]利用肥大細胞脫顆粒肽誘導肥大細胞脫顆粒進程,發現PI3K/AKT通路相關蛋白表達明顯升高。GSK3β是AKT下游效應分子之一,激活小鼠下丘腦中哺乳動物雷帕霉素靶蛋白/AKT/GSK3β級聯反應可觸發肥大細胞脫顆粒[20]。本研究結果顯示,模型組大鼠異位灶組織中PI3K蛋白、AKT和GSK3β磷酸化水平相較于假手術組顯著升高,提示EM大鼠異位灶組織PI3K/AKT/GSK3β信號通路處于激活狀態。給予姜黃素治療后上述蛋白表達水平呈劑量依賴性降低,提示姜黃素能夠抑制EM大鼠異位灶組織中PI3K/AKT/GSK3β信號通路激活。在心肺旁手術誘導的腦損傷中,使用PI3K抑制劑降低AKT和GSK3β磷酸化水平可減輕腦組織的炎癥反應,抵制腦損傷,因此推測姜黃素可能通過調控PI3K/AKT/GSK3β途徑降低異位灶組織的炎癥反應,從而達到抑制EM異位灶組織生長的效果,但姜黃素干預下EM大鼠異位灶組織肥大細胞活化受到抑制是否與PI3K/AKT/GSK3β途徑相關尚待更深入的探索[21]。
綜上所述,姜黃素能夠抑制EM異位灶組織生長,可能與抑制PI3K/AKT/GSK3β信號通路、降低肥大細胞活化及炎癥反應相關,揭示了姜黃素用于治療EM的潛在價值。但EM是一種多因素疾病,機制比較復雜,因此本課題組將進一步聯合動物模型和臨床試驗以期提供更多數據支持姜黃素在EM病理學中的治療效果。