mTOR介導的細胞自噬在依維莫司治療甲狀腺癌中的作用及機制
王 寧,劉金彪
(河南科技大學第一附屬醫院甲狀腺外科,洛陽 471003)
目前,甲狀腺癌已成為全球范圍內發病率上升最快的內分泌系統惡性腫瘤,但在臨床上其具體的發病機制尚未明確,多認為是由碘攝入不足或過量、接觸大量放射性碘或頸部放射線照射等原因引起甲狀腺激素異常分泌,最終導致甲狀腺細胞的惡變及癌變[1-2]。甲狀腺癌大多因無痛性頸部腫塊就診,并伴有呼吸困難、聲音嘶啞等;部分患者可能會出現淋巴結及遠處器官組織的侵犯和轉移[3-4]。甲狀腺癌根據病理類型主要分為乳頭狀癌、濾泡狀癌、未分化癌和髓樣癌,其中以乳頭狀癌最為常見[5-6]。由于甲狀腺癌對一般的臨床化療藥物并不敏感,因此選擇特異性的靶向治療藥物已成為臨床治療的主要研究方向。依維莫司能通過持續有效地抑制哺乳動物的雷帕霉素靶蛋白(mTOR),發揮抑制腫瘤新生血管形成、腫瘤生長與增殖、腫瘤營養代謝等三重抗腫瘤作用[7]。國外的研究中[8],依維莫司在臨床上批準用于治療晚期乳腺癌、腎癌等,但依維莫司對于甲狀腺癌的療效及具體機制尚未明確。本研究主要通過給裸鼠甲狀腺癌動物模型進行依維莫司藥物治療,觀察和探討依維莫司對甲狀腺惡性腫瘤的治療和緩解作用,及mTOR介導的細胞自噬信號通路在此過程中的重要作用。
1 材料與方法
1.1 藥品與試劑
依維莫司(瑞士諾華制藥有限公司,注冊證號H20150093,規格2.5 mg/片);多克隆抗體mTOR、LC-3II、p62、Atg5、NF-κB、三磷酸甘油醛脫氫酶(GAPDH,美國SantaCruz生物技術有限公司);山羊抗兔IgG二抗(AP堿性磷酸酶標記,上海碧云天生物工程有限公司,批號A0423,100 μl)。NIH3T3 “HOOK3-RET”所構建的穩定細胞株,甲狀腺癌細胞株SW579(中國科學院細胞庫)。
1.2 儀器
Prime Script?RT和SYBR Premix Ex TaqTMII試劑盒(日本TaKaRa生物技術有限公司)。
1.3 實驗動物
SPF級BALB/C裸鼠,雌性,5~8周,體重15~20 g,實驗室許可證號:SYXK(豫)2019-0002。晝夜循環光照(12 h/12 h),溫度為(22±2)℃。選用小鼠胚胎成纖細胞(NIH3T3)穩定細胞株構建甲狀腺腫瘤BALB/C裸鼠皮下移植模型,隨機分為對照組、模型組和治療組,每組30只。參考李毅等[2]構建BALB/C裸鼠甲狀腺腫瘤的皮下移植模型的方法:采用含15%胎牛血清的培養液,37 ℃、5% CO2適應性培養NIH3T3 1周,待細胞覆蓋率達80%~90%左右,用0.25%胰酶消化,1000 r/min離心10 min,并制成單細胞懸液,調整其濃度為1×107/ml。于裸鼠的頸背部皮下注射細胞懸液100 μl。每隔1天稱量裸鼠體重,精密測量裸鼠腫瘤體積。治療組:造模成功后給予依維莫司(1.5 mg/kg)連續灌胃(ig)給藥30天[8]。模型組:造模成功后給予生理鹽水(1.5 mg/kg)連續灌胃給藥30天;對照組:未進行造模實驗,并灌胃給予等計量生理鹽水。
1.4 細胞分組和處理
研究發現依維莫司抑制細胞半數增殖的濃度為7.5 nmol/L[9],因此將5 nmol/L定義為低劑量,10 nmol/L定義為高劑量。用不同濃度的依維莫司處理SW579細胞株培養48 h,分別為空白組、低劑量組和高劑量組(依維莫司0、5和10 nmol/L)制備成細胞懸液接種于96孔板中,更換培養基后加入10 μl CCK8試劑,37 ℃、5% CO2條件下培養2 h,賽默飛FC/K3全自動多功能酶標儀(賽默飛世爾科技)在450 nm波長處測定吸光度(A)值,并計算SW579細胞存活率。用AnnexinV-FITC細胞凋亡檢測試劑盒進行染色,貝克曼庫爾特Cyto FLEX流式細胞儀(美國貝克曼庫爾特有限公司)檢測SW579細胞凋亡率,象限取Q2,檢測晚期細胞凋亡。
1.5 腫瘤指標觀察及測定
依據O’Reilly等[10]的研究,使用依維莫司(1.5 mg/kg)進行小鼠實驗。依維莫司連續灌胃給藥30天結束后,麻醉處死全部小鼠并獲取甲狀腺腫瘤,用游標卡尺測量移植瘤長徑(L)和短徑(W),計算腫瘤體積:V=L×W2×0.52,測定甲狀腺腫瘤裸鼠瘤體體積和重量。然后將瘤體固定于10%中性福爾馬林,采用石蠟包埋,常規脫水、透明及浸蠟包埋,連續石蠟切片6張(5 μm/張),切片用于HE染色。
1.6 Western Blot法檢測甲狀腺癌組織相關蛋白表達水平
取BALB/C裸鼠甲狀腺腫瘤組織剪碎后放入勻漿器反復抽吸,12 000 r/min(4 ℃)離心10 min,提取蛋白,調整蛋白水平為30 μg/μl。各組蛋白樣品在10% SDS聚丙烯酰胺凝膠中進行凝膠電泳和轉膜,加入大鼠多克隆抗體mTOR、LC-3II、p62、Atg5、NF-κB、GAPDH和二抗。顯色采用ECL顯色劑,Bio-Pro Bio-Red XRS+凝膠成像分析儀(美國伯樂生命醫學產品有限公司)成像,各泳道條帶進行灰度掃描得出相應蛋白表達量,采用Quantity-one軟件進行分析。
1.7 統計學處理
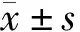
2 結果
2.1 裸鼠瘤體體積和重量
模型組和治療組裸鼠在細胞移植后逐漸成瘤,治療前瘤體體積和重量無統計學差異(P>0.05)。隨移植時間延長,模型組裸鼠的瘤體體積和重量逐漸增大(P<0.05);給予依維莫司后,治療組裸鼠的瘤體體積和重量逐漸降低(P<0.05)。見表1和圖1。
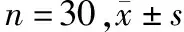
表1 裸鼠瘤體體積和體重變化情況
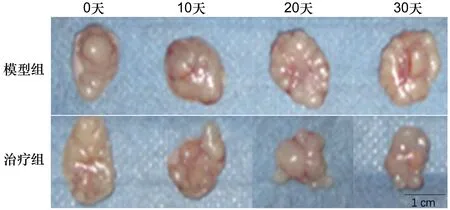
圖1 裸鼠瘤體圖片
2.2 HE染色結果
對照組裸鼠甲狀腺細胞輪廓正常清晰、胞漿豐富、核仁明顯、異型性明顯;模型組和治療組甲狀腺細胞呈島狀生長方式,可見細胞壞死、細胞核分裂增多、細胞輪廓消失模糊不清;治療組較模型組甲狀腺細胞恢復,甲狀腺細胞壞死數量減少、異型性降低。見圖2。
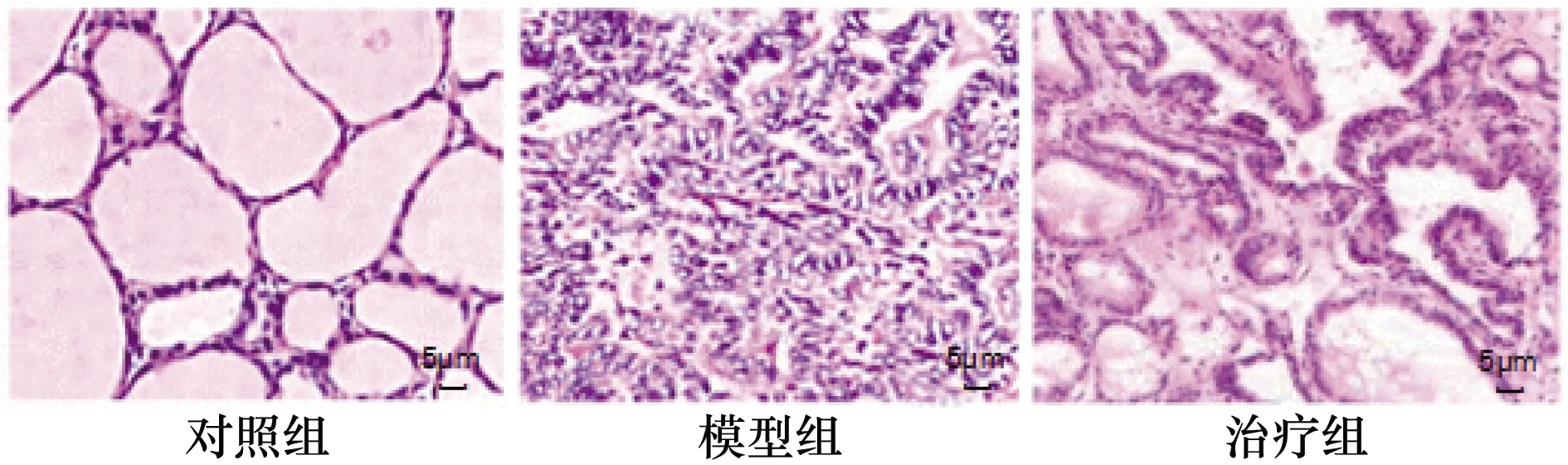
圖2 甲狀腺細胞HE染色結果(400×)
2.3 Western Blot法檢測蛋白表達水平
與對照組相比,模型組和治療組LC-3II、Beclin-1和Atg5蛋白水平降低,模型組mTOR、p62和NF-κB蛋白水平增加(P<0.05);與模型組相比,治療組LC-3II、Beclin-1和Atg5蛋白水平升高,mTOR、p62和NF-κB蛋白水平降低(P<0.05)。見圖3。

與對照組相比,a:P<0.05;與模型組相比,b:P<0.05
2.4 SW579細胞存活和細胞凋亡檢測
低劑量組和高劑量組的SW579細胞存活率均低于對照組,而SW579細胞凋亡率均高于對照組;隨著依維莫司劑量的升高,SW579細胞存活率降低,SW579細胞凋亡率升高(P<0.05)。見圖4。
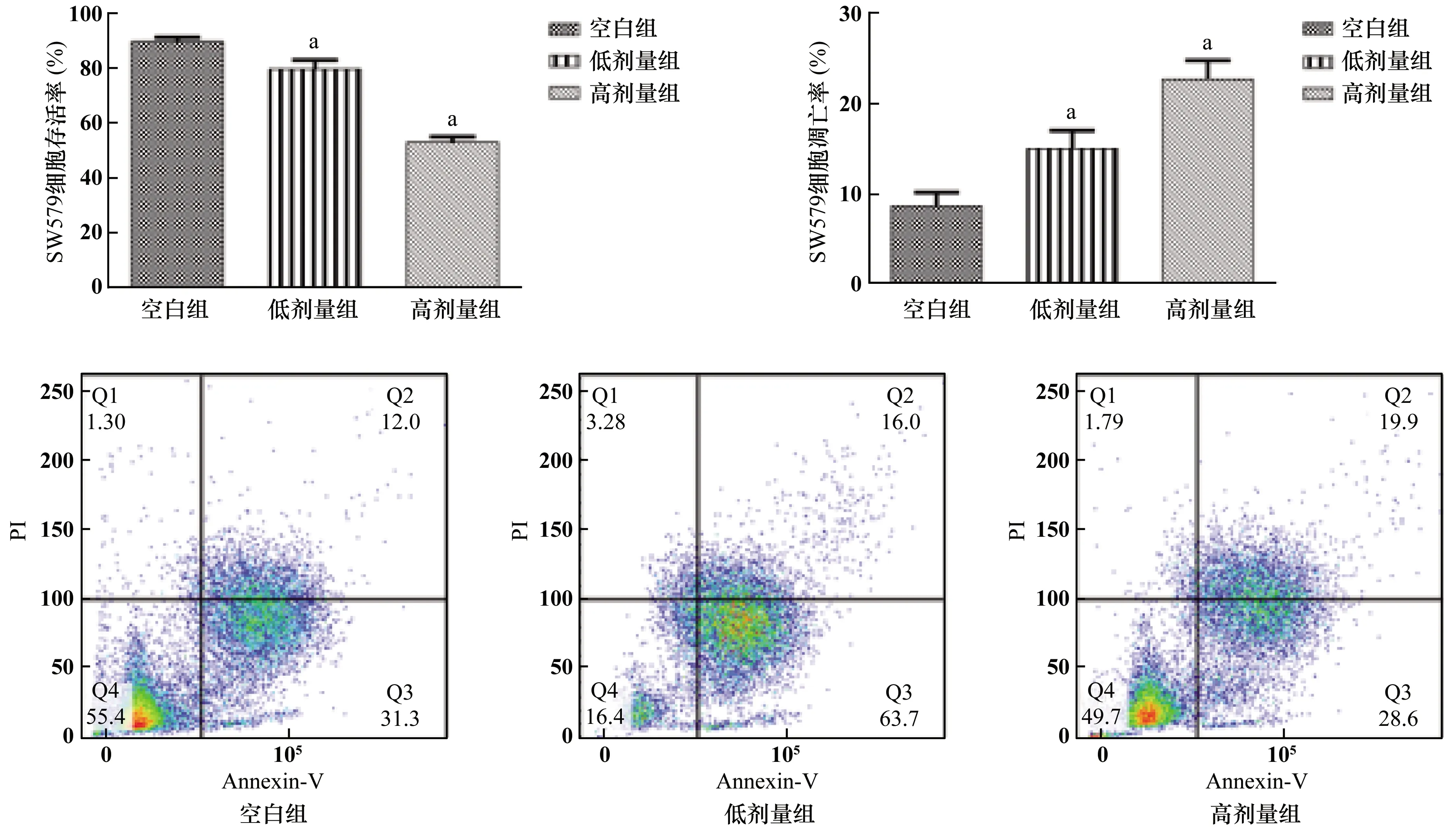
與對照組相比,a:P<0.05
3 討論
mTOR是一種絲氨酸/蘇氨酸激酶,具有調控細胞生長、增殖與能量代謝的作用,可以抑制細胞自噬的發生[11-12]。有研究證明[13-14],AMPK/AKT/mTOR信號通路與甲狀腺腫瘤的發病機制密切相關。活化的腺苷酸活化蛋白激酶AMPK可以負調節mTOR,在富含氨基酸和營養生長因子等充足時,細胞中被激活的mTOR可以阻斷下游自噬通路;反之mTOR活性受抑制,從而解除對自噬通路的抑制。細胞自噬與細胞增殖和存活等多種信號傳導密切相關,可加速誘導細胞的損傷和死亡[15]。自噬激活的主要細胞學標志LC3存在于前自噬泡和自噬泡膜表面,主要用于調控mTOR信號通路[16]。Beclin1的復合體Beclin1-PI3KC3通過LC3結合參與自噬體的形成,p62是SQSTMI編碼的泛素結合蛋白,其參與自噬相關蛋白和泛素蛋白酶系統降解[17-18]。下游NF-κB是mTOR信號通路的主要效應靶蛋白,可調節細胞凋亡及凋亡基因的轉錄調控[19-20]。
本研究結果表明,模型組和治療組裸鼠在細胞移植后逐漸成瘤。隨移植時間延長,模型組裸鼠的瘤體體積和重量逐漸增大;給予依維莫司治療后,治療組裸鼠的瘤體體積和重量逐漸降低。同時發現對照組裸鼠甲狀腺細胞輪廓正常清晰、胞漿豐富、核仁明顯、異型性明顯。模型組和治療組甲狀腺細胞呈島狀生長方式,可見細胞壞死、細胞核分裂增多、細胞輪廓消失模糊不清;治療組較模型組甲狀腺細胞恢復,說明給予裸鼠依維莫司治療后可有效緩解裸鼠體內的成瘤情況和改善甲狀腺組織的損傷。低劑量組和高劑量組的SW579細胞存活率均低于對照組,而SW579細胞凋亡率均高于對照組;且隨著依維莫司劑量的升高,SW579細胞存活率降低,SW579細胞凋亡率升高(P<0.05),說明依維莫司可誘導SW579細胞凋亡,且隨著劑量的增加,其效果越強。模型組和治療組LC-3II、Beclin-1和Atg5蛋白水平降低;mTOR、p62和NF-κB蛋白水平增加;與模型組相比,治療組LC-3II、Beclin-1和Atg5蛋白水平升高;mTOR、p62和NF-κB蛋白水平降低,說明依維莫司可有效抑制mTOR靶點,調控細胞自噬通路,從而抑制甲狀腺腫瘤生長與增殖的發生、發展過程。
綜上所述,mTOR及其誘導的細胞自噬信號通路在甲狀腺癌的發生、發展及治療過程中具有一定的調控作用;且mTOR抑制劑依維莫司可以通過抑制mTOR介導的自噬信號通路來促進甲狀腺癌細胞的凋亡,起到治療甲狀腺癌的作用。

